Азооспермия — что это, виды, симптомы, лечение, стоимость
Главная
/
Лечение бесплодия
/
Мужское бесплодие
/
Нарушение сперматогенеза — диагностика и лечение
/
Азооспермия
Состояние, при котором в семенной жидкости мужчины отсутствуют сперматозоиды – одно из самых тяжелых отклонений
Подробнее о патологии
Патологии спермы часто приводят к проблемам с зачатием – почти в половине случаев бесплодия в паре. Азооспермия – состояние, при котором в семенной жидкости мужчины отсутствуют сперматозоиды – одно из самых тяжелых отклонений. Спермиев не просто мало, как при олигозооспермии, их нет вообще. Диагностируется у каждого пятого мужчины с бесплодием. Естественное зачатие в такой ситуации невозможно.
Спермиев не просто мало, как при олигозооспермии, их нет вообще. Диагностируется у каждого пятого мужчины с бесплодием. Естественное зачатие в такой ситуации невозможно.
20-30 лет назад азооспермия была непреодолимым препятствием на пути к беременности. Сейчас такой диагноз не приговор для репродуктивной функции мужчины. Методы лечения зависят от вида и причины патологии.
Преимущества лечения азооспермии в центре «Линия жизни»
Отцовство при этом недуге стало возможным благодаря относительно недавним достижениям вспомогательных репродуктивных технологий. Значит, в клинике, куда вы обратитесь, должны быть внедрены новые методики. В Центре репродукции «Линия жизни» применяется несколько эффективных методов, которые позволяют преодолеть отсутствие сперматозоидов в семенной жидкости. Мы помогаем стать папами мужчинам с самым сложным анамнезом!
- Мы имеем все нужное, чтобы обеспечить комплексную диагностику и получить развернутую характеристику особенностей сперматогенеза у конкретного пациента
- Специалисты центра обладают высокой квалификацией и большим практическим опытом в микрохирургии
- Часто зачатие невозможно без проведения ЭКО.
 «Линия жизни» среди лидеров по результативности программ экстракорпорального оплодотворения
«Линия жизни» среди лидеров по результативности программ экстракорпорального оплодотворения
Виды и причины
Как лечить азооспермию? Ответ на вопрос зависит в первую очередь от формы патологии у конкретного пациента. Потому что каждая обладает характерными признаками, которые требуют совершенно разных подходов в лечении.
Обструктивная азооспермия
Связана с нарушенной проходимостью или полной непроходимостью спермиев из яичек наружу. При такой форме яички вырабатывают нормальные сперматозоиды с хорошим потенциалом к зачатию, но они не добираются до нужного места из-за препятствия.
Непроходимость может быть связана с врожденной патологией – когда у новорожденного мальчика отсутствуют семенные канальцы, вызвана воспалительными процессами, хирургическими вмешательствами (вазэктомией – мужской стерилизацией, операцией по поводу паховой грыжи), травмами репродуктивных органов. Перекрыть семенные протоки могут рубцовые образования или кисты, затруднить выброс семени – склеротические явления в придатках, предстательной железе, уретре.
Обструктивная форма выявляется в 25-30% всех случаев.
Секреторная азооспермия
При этой форме у мужчины все в порядке с семявыводящими протоками. Спермии отсутствуют в эякуляте из-за дисфункции яичек, которые не вырабатывают сперматозоиды вовсе или вырабатывают в недостаточном количестве.
К секреторной или необструктивной азооспермии могут привести:
- гормональные нарушения на фоне дисфункции гипофиза и щитовидной железы;
- врожденное недоразвитие яичек;
- повреждение яичек, связанное с варикоцеле, травмами, грыжей мошонки;
- лучевая и химиотерапия онкологических заболеваний;
- гиповитаминоз и голодные диеты;
- диабет и патологическое ожирение;
- венерические болезни, сепсис и туберкулез;
- работа на химическом производстве, рентгеновское облучение;
- прием угнетающих сперматогенез лекарственных средств.
Секреторный вид встречается примерно в 60% случаев.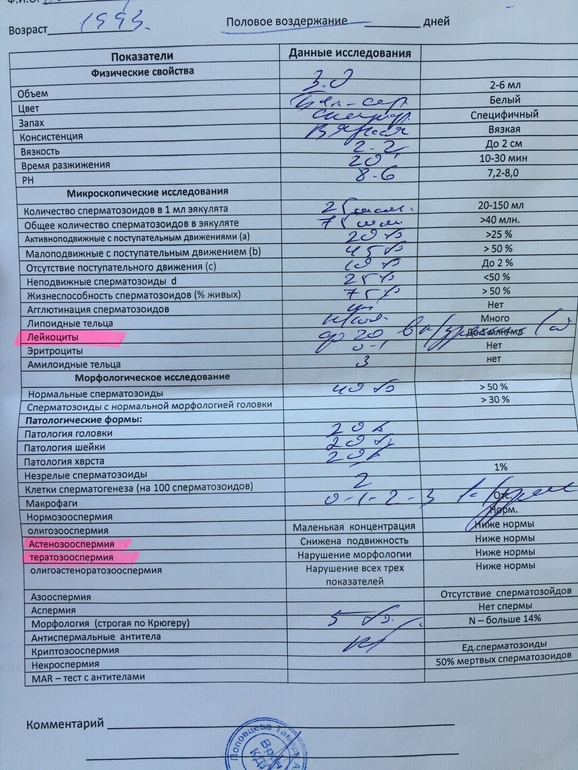
Другие виды патаспермии
Есть еще одна форма – транзиторная или временная. Она возникает на не определенный период времени, полностью обратима, может быть следствием как обструктивных, так и секреторных факторов. Кроме «чистых видов» существует смешанная азооспермия, при которой одновременно наблюдаются дисфункция яичников и непроходимость семявыносящих протоков. Встречается редко и считается самой сложной для лечения формой.
Как ставится диагноз?
В большинстве случаев азооспермия проявляется только бесплодием – мужчины не испытывают болезненных ощущений, недомогания, проблем с эректильной функцией. А так как у проблем с зачатием может быть много причин (включая другие патологии спермы – олигозооспермию, тератозооспермию), необходимо для начала подтвердить или опровергнуть отсутствие спермиев в эякуляте, и таким образом установить причину патоспермии.
Диагностика азооспермии включает несколько видов исследований:
- Осмотр андролога.
 Позволяет выявить внешние признаки – уменьшение размеров яичек, нарушение строения яичек и придатков, предстательной железы, возможные аномалии уретры и пр.
Позволяет выявить внешние признаки – уменьшение размеров яичек, нарушение строения яичек и придатков, предстательной железы, возможные аномалии уретры и пр. - Спермограмма. Микроскопическое исследование эякулята позволяет определить наличие/отсутствие сперматозоидов, а если они есть – уточнить их концентрацию и подвижность, изучить строение. Кроме того, в рамках исследования устанавливается наличие в сперме лейкоцитов и антиспермальных тел.
- Биопсия придатков или яичек. Помогает выяснить, есть ли сперматогенез, определить причины его нарушения.
- Анализ крови на гормоны. Дает возможность подтвердить секреторную форму.
- Рентгеновское исследование семенных протоков с применением контрастного вещества (генитография) позволяет определить точные характеристики обструктивной азооспермии.
Достижение беременности при азооспермии
Проанализировав результаты обследования, определив форму и вероятную причину патологии, врач разрабатывает оптимальную тактику дальнейших действий. Цель всегда одна – добиться беременности и рождения здорового малыша.
Цель всегда одна – добиться беременности и рождения здорового малыша.
Оперативная и консервативная терапия
Если у мужчины диагностировано обструктивная азооспермия, восстановить репродуктивную функцию может помочь операция. Чтобы открыть спермиям путь из яичек, используются микрохирургические реконструктивные методы. Схема проведения операции зависит от локализации и протяженности участка с непроходимостью.
При секреторной азооспермии у лечения мало перспектив. Впрочем, при отдельных гормональных нарушениях пациентам назначается медикаментозная терапия, направленная на коррекцию эндокринных нарушений и возобновление сперматогенеза. Если причиной патологии стало варикоцеле, то к преодолению бесплодия может привести оперативное лечение основного заболевания.
Иногда лечение дает результат. Но в целом шансы стать отцом естественным путем у пациентов с этой патологией остаются довольно низкими. При отсутствии эффекта или при заведомой бесперспективности хирургических/медикаментозных методов на помощь приходят вспомогательные репродуктивные технологии.
Врач рекомендует паре с мужским фактором бесплодия программу ЭКО.
ЭКО при азооспермии
Процедуре экстракорпорального оплодотворения больше 40 лет, и значительную часть этого срока она применялась в том числе для решения проблемы азооспермии. Однако раньше все ограничивалось использованием донорской спермы – генетическое отцовство для мужчин с азооспермией было недоступно. С внедрением и развитием методов биопсии ситуация изменилась. Сейчас ЭКО проводится с собственной спермой мужчины, которую предварительно получают непосредственно из яичек и придатков. Для этого используются различные виды биопсии.
Читайте подробную информацию о биопсии яичек/придатков в центре «Линия жизни» здесь
Биопсия яичка далеко не всегда позволяет получить достаточное для классического ЭКО количество здоровых спермиев. Поэтому в наших клиниках для преодоления бесплодия при азооспермии ЭКО дополняется методикой ИКСИ (ICSI). В ходе процедуры эмбриолог вводит отобранный сперматозоид – самый лучший из тех, что удалось получить – непосредственно в яйцеклетку. Для проведения ЭКО с ИКСИ может быть достаточно одной качественной мужской половой клетки.
Для проведения ЭКО с ИКСИ может быть достаточно одной качественной мужской половой клетки.
Получение сперматозоидов из ткани яичек и их последующее использование в ЭКО с ИКСИ серьезно расширяет возможности преодоления азооспермии. Дополнительным фактором высокой результативности программ ЭКО в нашем центре становится четкое взаимодействие между урологами, репродуктологами и эмбриологами.
Чтобы записаться на прием к репродуктологу или урологу, оставьте заявку на сайте или позвоните нам в клинику.
все сотрудники
Помогут стать мамой и папой
врач-уролог-андролог, врач ультразвуковой диагностики
Брусенский Вадим Алексеевич
кандидат медицинских наук
все сотрудники
Записаться на прием
Имя *
Телефон *
Сообщение
Нажимая на кнопку, Вы даете согласие на обработку своих персональных данных. Данный сайт защищен reCaptcha, к которой применяются Политика конфиденциальности и Условия обслуживания Google.
Данный сайт защищен reCaptcha, к которой применяются Политика конфиденциальности и Условия обслуживания Google.
Урология » Стимуляция сперматогенеза у мужчин при патоспермии и бесплодии
- Архив журнала
/ - 2016
/ - №1 (supplement)
Стимуляция сперматогенеза у мужчин при патоспермии и бесплодии
Р.В. Роживанов, Н.С. Кравцова, Д.Г. Курбатов
ФГБУ «Эндокринологический научный центр» Минздрава РФ (директор – акад. РАН И. И. Дедов)
Цель. Исследование методов лечения, направленных на увеличение количества сперматозоидов в эякуляте.
Материалы и методы. В исследовании использовали кломифен и рекомбинантный ФСГ в комбинации с хорионическим гонадотропином у 60 мужчин с бесплодием.
Результаты. Эффективность монотерапии кломифеном составила 20% в отношении зачатия и 63% в отношении олиготератозооспермии. Эффективность комбинированной терапии ХГЧ в сочетании с рекомбинантным ФСГ составила 40% в отношении зачатия и 87% в отношении олиготератозооспермии. Эффективность комбинированной терапии препаратом ФСГ и ХГЧ в случаях предшествующей неэффективности монотерапии ХГЧ и кломифеном в отношении олиготератозооспермии составила 65%.
Эффективность комбинированной терапии ХГЧ в сочетании с рекомбинантным ФСГ составила 40% в отношении зачатия и 87% в отношении олиготератозооспермии. Эффективность комбинированной терапии препаратом ФСГ и ХГЧ в случаях предшествующей неэффективности монотерапии ХГЧ и кломифеном в отношении олиготератозооспермии составила 65%.
Заключение. Наиболее эффективна комбинированная терапия препаратом ФСГ и ХГЧ. При этом исследованные виды стимулирующей терапии являются безопасными и не приводят к развитию побочных эффектов.
Ключевые слова: кломифен, сперматогенез, гонадотропины, бесплодие
Актуальность. В течение последних 50 лет концентрация сперматозоидов в эякуляте здоровых мужчин, проживающих в технологически развитых странах, постоянно снижалась, при этом в большинстве случаев мужское бесплодие было связано со снижением количества и качества сперматозоидов [1]. В связи с этим часто возникает вопрос о необходимости применения методов лечения, направленных на увеличение количества сперматозоидов в эякуляте, в том числе и гормональной стимулирующей терапии.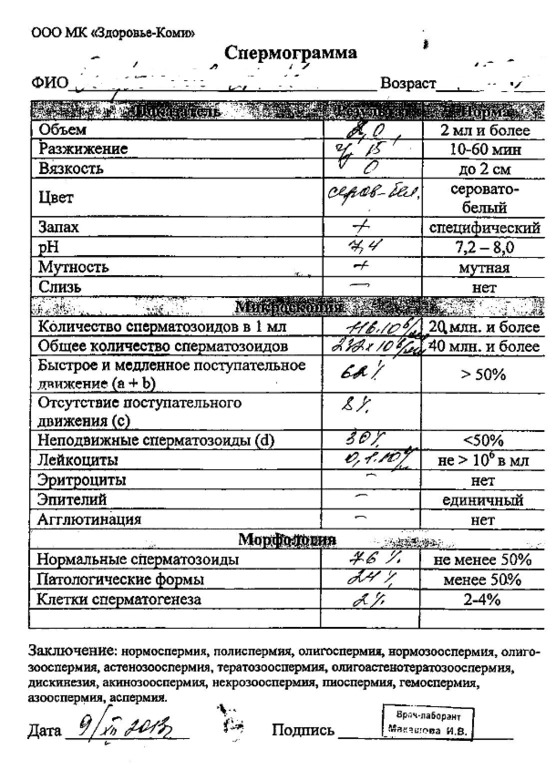
В настоящий момент из препаратов для гормональной стимулирующей терапии используются: хорионический гонадотропин (ХГЧ), антиэстрогены, рекомбинантные препараты фолликулостимулирующего гормона (ФСГ), а также их комбинации [2, 3].
Цель: исследование эффективности и безопасности разных видов стимулирующей терапии у пациентов с патоспермией и бесплодием.
Материалы и методы исследования. В проспективное когортное исследование были включены 60 бесплодных мужчин с олигоастенотератозооспермией, сочетавшейся с нормальными или сниженными уровнями лютеинезирующего и фолликулостимулирующего гормонов. Критериями исключения являлись наличие в анамнезе травм или хирургических вмешательств на половых органах, криптозооспермия, азооспермия, любые формы обструктивного бесплодия, гипергонадотропный гипогонадизм, гипотиреоз, гиперпролактинемия, гиперкортицизм, нарушения кариотипа, делеции AZF, опухоли яичек, опухоли гипофиза, варикоцеле, урогенитальные инфекции, воспалительные заболевания половых желез, бактериоспермия, лейкоспермия, носительство антиспермальных антител. Включенные в исследование пациенты были рандомизированы в сопоставимые группы путем стратифицированной рандомизации, табл. 1.
Включенные в исследование пациенты были рандомизированы в сопоставимые группы путем стратифицированной рандомизации, табл. 1.
Пациенты первой группы (группа кломифена, n=30) получали кломифена цитрат (Клостилбегит, «Эгис»; Венгрия) 50 мг перорально утром ежедневно. Пациенты второй (группа ХГЧ+ФСГ, n=30) получали комбинированную терапию препаратами Хорионический гонадотропин в индивидуально подобранной дозе, которая составила от 1000 до 3000 ЕД 1 раз в 3 дня внутримышечно и рекомбинантный препарат ФСГ (Гонал-Ф, «Мерк Сероно», Швейцария) в дозе 75 ЕД подкожно через день. Доза ХГЧ определялась путем оценки уровня общего тестостерона утром натощак после инъекции препарата (целевым значением являлось 20–33 нмоль/л).
Первичная эффективность лечения оценивалась через 3 месяца стимулирующей терапии. Под эффективностью терапии понималось наличие зачатия и/или устранение олиготератозооспермии. Пациенты, от которых наступило зачатие на фоне исследуемого лечения, в дальнейшее исследование не включались.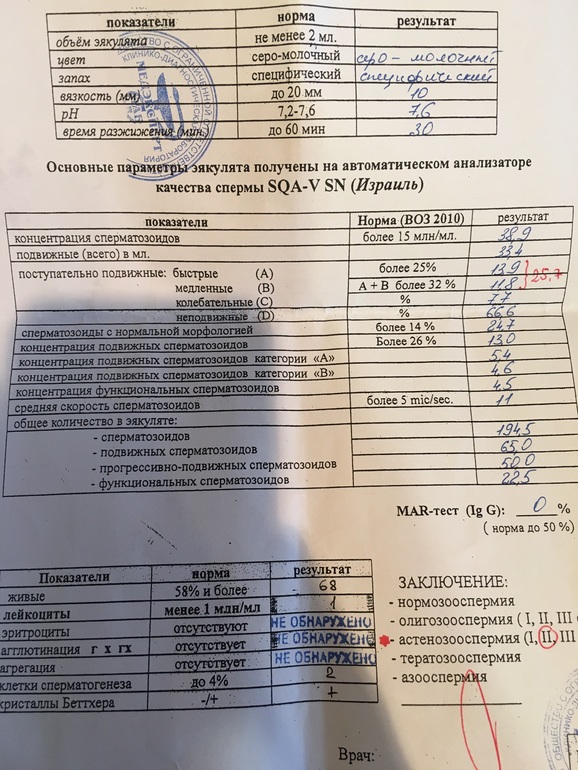 Мужчины, от которых зачатие на фоне лечения не наступило, но было достигнуто устранение олиготератозооспермии, продолжили получать назначенную терапию еще 3 месяца с дальнейшей оценкой ее эффективности.
Мужчины, от которых зачатие на фоне лечения не наступило, но было достигнуто устранение олиготератозооспермии, продолжили получать назначенную терапию еще 3 месяца с дальнейшей оценкой ее эффективности.
Кроме того, в исследовании оценивалась эффективность комбинированной терапии препаратами ХГЧ в сочетании с ФСГ, аналогичной той, которая применялось во второй группе, у 17 пациентов с первичной неэффективностью кломифена цитрата и монотерапии ХГЧ.
С целью оценки объема яичек проводилось ультразвуковое исследование на аппарате Aloka ProSound SSD-α 10 с использованием линейного датчика с частотой 10 МГц. При лабораторном обследовании состояния половых желез проводилось определение лютеинезирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ), общего тестостерона и ингибина В в трех аликвотах сыворотки крови. Уровни ЛГ (норма 2,5–11,0 ЕД/л), ФСГ (норма 1,6–9,7 ЕД/л) и тестостерона (норма 12,0–33,3 нмоль/л) определялись на автоматическом анализаторе «Vitros ECi» (Johnson and Johnson [Великобритания]) методом усиленной хемилюминесценции, а уровни ингибина В (норма – 25–325 пг/мл) методом иммуноферментного анализа с использованием тест-системы DSL (США). Кровь для исследования забиралась в пробирки типа «вакутейнер» в утреннее время натощак из локтевой вены.
Кровь для исследования забиралась в пробирки типа «вакутейнер» в утреннее время натощак из локтевой вены.
Оценка качества эякулята осуществлялась в соответствии с рекомендациями ВОЗ (2010 г.) путем световой микроскопии с помощью микроскопа Olimpus 41 CX (Япония) и камеры Маклера того же производителя. Учитывая, что на параметры спермограммы может влиять множество различных факторов, ее анализировали двухкратно (ориентировались на лучший результат) и оценивались наиболее «стабильные» показатели: количество сперматозоидов в 1 млн эякулята (норма – 15 млн и более), количество морфологически нормальных форм (норма – 4% и более [критерий Крюгера]), подвижность А+В (норма 40% и более). Кроме того, проводилось электронно-микроскопическое исследование эякулята (ЭМИС) путем центрифугирования, этаноловой, далее эпоксидной фиксации клеток эякулята с дальнейшим электронным микроскопированием х16000–18000 для исследования органоидов и х20000–25000 для исследования жгутиков. Оценивались: число интактных головок (норма >4%), содержание сперматозоидов с недостаточно конденсированным хроматином (норма <30%), содержание многоядерных сперматозоидов (норма <5%), содержение сперматозоидов с патологией акросомы (норма <20%), жгутика (норма <30%), деградирорвавших сперматозоидов. Забор эякулятата осуществлялся в стерильные контейнеры путем мастурбации (половое воздержание – 3–5 суток).
Забор эякулятата осуществлялся в стерильные контейнеры путем мастурбации (половое воздержание – 3–5 суток).
Статистическая обработка полученных данных была проведена с использованием пакета прикладных программ STATISTICA (StatSoft Inc. США, версия 8.0). Сравнение по количественным признакам осуществлялось непараметрическим методом с использованием U критерия Манна–Уитни для независимых групп, и теста Вилкоксона – для зависимых групп. Сравнение групп по качественным признакам осуществлялось непараметрическим методом путем анализа таблиц сопряженности с использованием точного критерия Фишера для независимых групп. Статистически значимыми считали различия при p<0,05.
Результаты и обсуждение. При одинаковых исходных данных пациентов проводимая стимулирующая терапия оказывала разный эффект в зависимости от выбранного препарата. Эффективность монотерапии препаратом кломифена представлена в табл. 2.
Терапия кломифеном наряду с увеличением уровня тестостерона, гонадотропинов и ингибина В, приводила не только к статистически значимому увеличению числа сперматозоидов в 1 мл эякулята, но и к статистически значимому улучшению их морфологии. При этом отмечалась тенденция к улучшению подвижности, однако различия не являлись статистически значимыми. Препарат устранил олиготератозооспермию у 73% пациентов (22 человека). Из них от 2 мужчин на 3-м месяце лечения наступило зачатие. Беременность окончилась естественными родами здоровых детей женского пола.
При этом отмечалась тенденция к улучшению подвижности, однако различия не являлись статистически значимыми. Препарат устранил олиготератозооспермию у 73% пациентов (22 человека). Из них от 2 мужчин на 3-м месяце лечения наступило зачатие. Беременность окончилась естественными родами здоровых детей женского пола.
Таким образом, эффективность монотерапии кломифеном через 3 месяца в отношении олиготератозооспермии составила 73% (22 человека) и в отношении наступления зачатия – 7% (2 человека). Оставшиеся 8 пациентов были переведены на комбинированную терапию ХГЧ и рекомбинантным ФСГ. Двадцать человек, от которых не наступило зачатия, но отмечалось устранение олиготератозооспермии, продолжили терапию кломифеном в прежнем режиме и были повторно обследованы еще через 3 месяца, табл. 2.
На фоне продолжающейся еще 3 месяца терапии кломифена цитратом было выявлено дальнейшее статистически значимое увеличение уровней гонадотропинов и ингибина В при тенденции к увеличению уровня тестостерона, что сопровождалось улучшением подвижности сперматозоидов, но статистически значимых различий в отношении концентрации сперматозоидов или их морфологии дополнительно к промежуточной точке исследования (3 месяца) выявлено не было. Тем не менее еще от 4 пациентов на фоне 6 месяцев лечения кломифеном наступило зачатие. Беременности окончились естественными родами здоровых детей (три женского пола, один мужского).
Тем не менее еще от 4 пациентов на фоне 6 месяцев лечения кломифеном наступило зачатие. Беременности окончились естественными родами здоровых детей (три женского пола, один мужского).
У 13 пациентов зачатия достигнуто не было, но олиготератозооспермия была устранена, из них у 4 мужчин в анамнезе имелись дети. Таким образом, суммарная эффективность терапии кломифеном составила 20% (6 человек) в отношении зачатия и 63% (19 человек) в отношении олиготератозооспермии. Пациентам с устраненной олиготератозооспермией, но не достигшим зачатия, было рекомендовано использование вспомогательных репродуктивных технологий (ВРТ).
Терапия кломифеном являлась безопасной, нами не было выявлено побочных эффектов, однако на фоне продолжающейся терапии кломифеном у 3 пациентов было выявлено ухудшение достигнутых ранее показателей – персистирование олиготератозооспермии. Этим пациентам была рекомендована криоконсервировация эякулята и использование ВРТ.
Исследования других авторов, использовавших антиэстрогены для стимуляции сперматогенеза, были объеденены в мета-анализе, проведенном в 2013 г. [4]. В результате было показано, что использование антиэстрогенов приводило к статистически значимому повышению частоты наступления беременности по сравнению с контрольной группой. При этом отмечалось значительное увеличение концентрации сперматозоидов и их подвижности. Данные изменения сопровождались повышением сывороточных концентраций ФСГ и тестостерона. Не было отмечено существенной разницы в количестве нежелательных эффектов между группами, получавшими терапию антиэстрогенами и группами контроля. Таким образом, как результаты проведенного исследования, так и приведенный мета-анализ свидетельствуют о том, что антиэстрогены в качестве медицинской эмпирической терапии идиопатического мужского бесплодия могут обеспечить наступление спонтанной беременности, увеличить концентрацию сперматозоидов и их подвижность с низким риском несерьезных побочных эффектов. Это подтверждается и отечественными исследователями [5].
[4]. В результате было показано, что использование антиэстрогенов приводило к статистически значимому повышению частоты наступления беременности по сравнению с контрольной группой. При этом отмечалось значительное увеличение концентрации сперматозоидов и их подвижности. Данные изменения сопровождались повышением сывороточных концентраций ФСГ и тестостерона. Не было отмечено существенной разницы в количестве нежелательных эффектов между группами, получавшими терапию антиэстрогенами и группами контроля. Таким образом, как результаты проведенного исследования, так и приведенный мета-анализ свидетельствуют о том, что антиэстрогены в качестве медицинской эмпирической терапии идиопатического мужского бесплодия могут обеспечить наступление спонтанной беременности, увеличить концентрацию сперматозоидов и их подвижность с низким риском несерьезных побочных эффектов. Это подтверждается и отечественными исследователями [5].
Хорошие результаты лечения также отмечались при использовании комбинированной терапии ХГЧ в сочетании с рекомбинантным ФСГ, табл. 3.
3.
Комбинированная терапия гонадотропинами наряду с увеличением уровня тестостерона и ингибина В приводила как к статистически значимому увеличению числа сперматозоидов в 1 мл эякулята, так и статистически значимому улучшению их морфологии. На подвижность сперматозоидов лечение не повлияло. Препараты устранили олиготератозооспермию у 70% пациентов (21 человек). Из них от 3 мужчин на 3-м месяце лечения наступило зачатие. Беременности окончились естественными родами здоровых детей мужского пола.
Таким образом, эффективность комбинированной терапии через 3 месяца в отношении олиготератозооспермии составила 70% (21 человек) и в отношении наступления зачатия – 10% (3 человека). Пациенты с ненаступившим зачатием продолжили терапию гонадотропинами в прежнем режиме и были повторно обследованы еще через 3 месяца, табл. 3.
На фоне продолжающейся еще 3 месяца комбинированной терапии гонадотропинами у 9 мужчин с отсутствием олиготератозооспермии наступило зачатие, закончившееся рождением здоровых детей (5 женского, 4 – мужского пола), у 6 из этих мужчин в анамнезе имелись дети. Еще у 5 мужчин было отмечено устранение олиготератозооспермии, но зачатия не наступило (у 3 из этих мужчин в анамнезе также имелись дети). У 4 пациентов эффекта от лечения не отмечалось, олиготератозооспермия сохранялась.
Еще у 5 мужчин было отмечено устранение олиготератозооспермии, но зачатия не наступило (у 3 из этих мужчин в анамнезе также имелись дети). У 4 пациентов эффекта от лечения не отмечалось, олиготератозооспермия сохранялась.
Таким образом, суммарная эффективность комбинированной терапии гонадотропинами составила 40% (12 человек) в отношении зачатия и 87% (26 человек) в отношении олиготератозооспермии. Пациентам, не достигшим зачатия, было рекомендовано использование ВРТ. Комбинированная терапия гонадотропинами являлась безопасной, нами не было выявлено побочных эффектов, кроме нерезких тянущих болей в области яичек, на которые жаловались 4 пациента. Боли отмечались в начале лечения, купировались самостоятельно, не требовали отмены терапии и были связаны с увеличением объема яичек.
Другие исследователи, использовавшие терапию гонадотропинами для стимуляции сперматогенеза, также продемонстрировали хорошие результаты [6, 7]. Так, в исследовании М. А. Amirzargar и др. (2012) было показано, что комбинированная терапия препаратами ХГЧ в сочетании с ФСГ приводит к большему числу беременностей – 57%, нежели чем монотерапия ХГЧ – 32% [6]. К подобному выводу пришли и A.A. Sinisi и др. (2010), в исследовании которых было установлено, что использование рекомбинантного ФСГ у пациентов с гипогонадотропным гипогонадизмом, в дополнение к лечению ХГЧ способствует лучшей индукции сперматогенеза по сравнению с монотерапией последним [8]. Это подтверждается и результатами нашего исследования пациентов с первичной неэффективностью кломифена цитрата и монотерапии ХГЧ на фоне лечения комбинацией гонадотропинов, которые представлены в табл. 4.
К подобному выводу пришли и A.A. Sinisi и др. (2010), в исследовании которых было установлено, что использование рекомбинантного ФСГ у пациентов с гипогонадотропным гипогонадизмом, в дополнение к лечению ХГЧ способствует лучшей индукции сперматогенеза по сравнению с монотерапией последним [8]. Это подтверждается и результатами нашего исследования пациентов с первичной неэффективностью кломифена цитрата и монотерапии ХГЧ на фоне лечения комбинацией гонадотропинов, которые представлены в табл. 4.
Комбинированная терапия гонадотропинами, назначенная после использования других препаратов, привела как к статистически значимому увеличению уровня ингибина В, так и числа сперматозоидов в 1 мл эякулята, а также к статистически значимому улучшению их морфологии. На подвижность сперматозоидов лечение не повлияло. Препараты устранили олиготератозооспермию у 65% (11 человек) – у 5 из группы кломифена (62,5% от всех ранее получавших кломифен) и у 6 из группы ХГЧ (67% от всех ранее получавших монотерапию ХГЧ). Из этих пациентов у 3-х мужчин из группы кломифена и 3 из группы ХГЧ в анамнезе имелись дети. При этом от 2 мужчин из группы ХГЧ и от 1 из группы кломифена с устраненной олиготератозооспермией на 5-м и 4-м месяцах лечения, соответственно, наступило зачатие. Беременности окончились естественными родами здоровых детей женского пола. Всем пациентам с ненаступившим зачатием было рекомендовано использование ВРТ. Побочных эффектов при смене стимулирующей терапии не отмечено.
Из этих пациентов у 3-х мужчин из группы кломифена и 3 из группы ХГЧ в анамнезе имелись дети. При этом от 2 мужчин из группы ХГЧ и от 1 из группы кломифена с устраненной олиготератозооспермией на 5-м и 4-м месяцах лечения, соответственно, наступило зачатие. Беременности окончились естественными родами здоровых детей женского пола. Всем пациентам с ненаступившим зачатием было рекомендовано использование ВРТ. Побочных эффектов при смене стимулирующей терапии не отмечено.
С целью уточнонения аспектов эффективности используемой терапии в отношении ее влияния на сперматогенез проведено сравнение мужчин с достигнутым эффектом от лечения (устранение олиготератозооспермии) и без такового, табл. 5.
Были выявлены статистически значимые различия в наличии детей в анамнезе, объеме яичек, уровне тестостерона, ингибина В и параметрах сперматогенеза. Все эти показатели в группе пациентов с недостигнутым эффектом были существенно хуже таковых в группе с хорошим результатом лечения. Следует отметить, что у пациентов с недостигнутым эффектом в большинстве случаев отмечалась тотальная тератозооспермия. Кроме того, при проведении ЭМИС было установлено, что у пациентов с отсутствием эффекта от стимулирующей терапии исходные показатели числа интактных головок, а также «конденсации» хроматина и патологии жгутиков статистически значимо хуже таковых по сравнению с больными, для которых лечение было эффективным. Полученные нами результаты подтверждаются другими авторами. Так, S. Belloc и соавт. (2014) в своем исследовании, посвященном изучению факторов риска и нарушению сперматогенеза при мужском бесплодии, пришли к выводу о том, что тератозооспермия является одним из наиболее негативных факторов, приводящих к невозможности спонтанного зачатия [9]. С ними согласены C. Krausz и C. Giachini (2007), которые также считают тератозооспермию одним из основных факторов риска мужского бесплодия [10].
Кроме того, при проведении ЭМИС было установлено, что у пациентов с отсутствием эффекта от стимулирующей терапии исходные показатели числа интактных головок, а также «конденсации» хроматина и патологии жгутиков статистически значимо хуже таковых по сравнению с больными, для которых лечение было эффективным. Полученные нами результаты подтверждаются другими авторами. Так, S. Belloc и соавт. (2014) в своем исследовании, посвященном изучению факторов риска и нарушению сперматогенеза при мужском бесплодии, пришли к выводу о том, что тератозооспермия является одним из наиболее негативных факторов, приводящих к невозможности спонтанного зачатия [9]. С ними согласены C. Krausz и C. Giachini (2007), которые также считают тератозооспермию одним из основных факторов риска мужского бесплодия [10].
Заключение. Проведенное нами исследование продемонстрировало, что все исследованные виды стимулирующей терапии приводят к повышению уровня тестостерона, ингибина В и концентрации сперматозоидов, являясь безопасными и не приводящими к развитию побочных эффектов. В отношении устранения олиготератозооспермии и достижения спонтанного зачатия наиболее эффективна комбинированная терапия гонадотропинами (ХГЧ в сочетании с ФСГ), при этом длительность лечения должна составлять 3–6 месяцев. Эта терапия может быть с успехом использована в случаях неэффективного лечения другими видами стимулирующей терапии.
В отношении устранения олиготератозооспермии и достижения спонтанного зачатия наиболее эффективна комбинированная терапия гонадотропинами (ХГЧ в сочетании с ФСГ), при этом длительность лечения должна составлять 3–6 месяцев. Эта терапия может быть с успехом использована в случаях неэффективного лечения другими видами стимулирующей терапии.
Литература
1. The world Health Organization laboratory manual for the examination and processing of human semen – 5th ed. 2010; 271p.
2. Nieschlag E., Behre H.M., Nieschlag S. Andrology: Male reproductive health and disfunction. Springer-Verlag Berlin Heidelberg. 2010;629. ISBN: 978-3-540-78354-1.
3. Yang L., Zhang S.X., Dong Q., Xiong Z.B., Li X. Application of hormonal treatment in hypogonadotropic hypogonadism: more than ten years experience. Int. Urol. Nephrol. 2012; 44:393–399.
4. Chua M.E., Escusa K.G., Luna S., Tapia L.C., Dofitas B., Morales M. Revisiting oestrogen antagonists (clomiphene or tamoxifen) as medical empiric therapy for idiopathic male infertility: a meta-analysi. Andrology. 2013;1(5):749.
Andrology. 2013;1(5):749.
5. Bozhedomov V.A., Rokhlikov I.M., Tret’yakov A.A., Lipatova N.A., Vinogradov I.V., Nikonov E.L. Topical issues of helping couples with male factor childless marriage: clinical, organizational and methodological aspects. Andrologiya i genital’naya khirurgiya. 2013;4:4–13. Russian (Божедомов В.А., Рохликов И.М., Третьяков А.А., Липатова Н.А., Виноградов И.В., Никонов Е.Л. Актуальные вопросы оказания помощи парам с мужским фактором бездетного брака: клинические и организационно-методические аспекты. Андрология и генитальная хирургия. 2013;4:4–13).
6. Amirzargar М.А., Yavangi М., Basiri А., Babbolhavaeji Н., Amirzargar N., Moadabshoar L. Comparison of recombinant human follicle stimulating hormone (rhFSH), human chorionic gonadotropin (HCG) and human menopausal gonadotropin (HMG) on semen parameters after varicocelectomy: a randomized clinical trial. Iran J. Reprod. Med. 2012;10(5):441–452.
7. Zagarskikh E.Yu., Labygina A.V., Kurashova N.A. Experience in the treatment of normogonadotropic infertility in men. Urologiya. 2014;5:87–89. Russian (Загарских Е.Ю., Лабыгина А.В., Курашова Н.А. Опыт лечения нормогонадотропного бесплодия у мужчин. Урология. 2014;5:87–89).
Urologiya. 2014;5:87–89. Russian (Загарских Е.Ю., Лабыгина А.В., Курашова Н.А. Опыт лечения нормогонадотропного бесплодия у мужчин. Урология. 2014;5:87–89).
8. Sinisi A.A., Esposito D., Bellastella G., Maione L., Palumbo V., Gandini L., Lombardo F., De Bellis A., Lenzi A., Bellastella A. Efficacy of recombinant human follicle stimulating hormone at low doses in inducing spermatogenesis and fertility in hypogonadotropic hypogonadism. J. Endocrinol. Invest. 2010;33(9):618–623.
9. Belloc S., Benkhalifa M., Cohen-Bacrie M., Dalleac A., Chahine H., Amar E., Zini A. Which isolated sperm abnormality is most related to sperm DNA damage in men presenting for infertility evaluation. J. Assist. Reprod. Genet. 2014;31(5):527–532.
10. Krausz C., Giachini C. Genetic risk factors in male infertility. Arch. Androl. 2007;53(3):125–133.
Об авторах / Для корреспонденции
Автор для связи: Р.В. Роживанов – д.м.н., главный научный сотрудник отделения урологии и андрологии ФГБУ ЭНЦ Минздрава РФ; e-mal: rrozhivanov@mail. ru
ru
Сведения об авторах:
Роживанов Р.В. – д.м.н., главный научный сотрудник отделения урологии и андрологии ФГБУ ЭНЦ Минздрава РФ, e-mal: [email protected]
Кравцова Н.С. – аспирант отделения урологии и андрологии ФГБУ ЭНЦ Минздрава РФ
Курбатов Д.Г. – д.м.н., профессор, заведующий отделением урологии и андрологии ФГБУ ЭНЦ Минздрава РФ
Похожие статьи
- Основные аспекты влияния новой коронавирусной инфекции SARS-CoV-2 на развитие бесплодия у мужчин
- Докозагексаеновая кислота в лечении идиопатических форм мужского бесплодия
- Ассоциация полиморфных маркеров гена GSTP1 c параметрами окислительного стресса у инфертильных мужчин
- Кисты предстательной железы
- Молекулярные механизмы мужского бесплодия: основные направления научного поиска
К содержанию номера
Терапия рекомбинантным гонадотропином для улучшения сперматогенеза у пациентов с необструктивной азооспермией – исследование для подтверждения концепции
1. Esteves SC. Клиническая значимость рутинного анализа спермы и противоречия вокруг критериев Всемирной организации здравоохранения 2010 года для исследования спермы. Инт Браз Дж. Урол. 2014; 40:443-53. [PubMed] [Google Scholar]
Esteves SC. Клиническая значимость рутинного анализа спермы и противоречия вокруг критериев Всемирной организации здравоохранения 2010 года для исследования спермы. Инт Браз Дж. Урол. 2014; 40:443-53. [PubMed] [Google Scholar]
2. Esteves SC. Клиническое ведение бесплодных мужчин с необструктивной азооспермией. Азиат Джей Андрол. 2015 г.; 17:459-70. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Achermann APP, Esteves SC. Диагностика и лечение бесплодия из-за обструкции семявыбрасывающего протока: сводка доказательств. Инт Браз Дж. Урол. 2021; 47:868-881. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Кемаль Харциф А., Майдарти М., Сильвия М., Мариана А., Деви Мутиа Х., Вивеко Б. Знания, отношение, намерение и религиозный аспект сохранения фертильности среди акушеров. и резиденты-гинекологи в Индонезии: перекрестное исследование. Int J Reprod Biomed. 2020; 18:47-56. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Эстевес СК. Экстракция спермы микродиссекцией яичка (микро-TESE) как метод получения спермы у мужчин с необструктивной азооспермией, стремящихся к фертильности: операционные и лабораторные аспекты. Инт Браз Дж. Урол. 2013; 39:440. [PubMed] [Google Scholar]
Инт Браз Дж. Урол. 2013; 39:440. [PubMed] [Google Scholar]
6. Эстевес С.К., Мияока Р., Агарвал А. Методы извлечения спермы для вспомогательной репродукции. Инт Браз Дж. Урол. 2011 г.; 37:570-83. [PubMed] [Google Scholar]
7. Shiraishi K, Ohmi C, Shimabukuro T, Matsuyama H. Лечение хорионическим гонадотропином человека перед экстракцией сперматозоидов микродиссекцией яичка при необструктивной азооспермии. Хум Репрод. 2012 г.; 27:331-9. [PubMed] [Google Scholar]
8. Shinjo E, Shiraishi K, Matsuyama H. Влияние гормональной терапии на основе хорионического гонадотропина человека на уровень интратестикулярного тестостерона и синтез сперматогониальной ДНК у мужчин с необструктивной азооспермией. Андрология. 2013; 1:929-35. [PubMed] [Google Scholar]
9. Kato Y, Shiraishi K, Matsuyama H. Экспрессия тестикулярного рецептора андрогенов при необструктивной азооспермии и ее изменение после гормональной терапии. Андрология. 2014; 2:734-40. [PubMed] [Академия Google]
10. Андраде Д.Л., Виана М.С., Эстевес С.К. Дифференциальная диагностика азооспермии у мужчин с бесплодием. Дж. Клин Мед. 2021; 10:3144. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Андраде Д.Л., Виана М.С., Эстевес С.К. Дифференциальная диагностика азооспермии у мужчин с бесплодием. Дж. Клин Мед. 2021; 10:3144. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Laursen RJ, Elbaek HO, Povlsen BB, Lykkegaard J, Jensen KBS, Esteves SC, et al. Гормональная стимуляция сперматогенеза: новый способ лечения мужского бесплодия с необструктивной азооспермией? Инт Урол Нефрол. 2019; 51:453-6. [PubMed] [Google Scholar]
12. Esteves SC. Эффективность, эффективность и результативность гонадотропиновой терапии при лечении бесплодия. Медицинский Экспресс 2015; 2:M150302. [Академия Google]
13. Джонс Т.Х., Дарн Дж.Ф., МакГарригл Х.Х. Суточный ритм тестостерона, индуцированный терапией человеческим хорионическим гонадотропином (ХГЧ) при изолированном гипогонадотропном гипогонадизме: сравнение между подкожным и внутримышечным введением ХГЧ. Евр Дж Эндокринол. 1994 год; 131:173-8. [PubMed] [Google Scholar]
14. Endo Y, Fujii Y, Kurotsuchi S, Motoyama H, Funahashi H. Успешные роды, полученные из витрифицированных нагретых сперматозоидов пациента с необструктивной азооспермией. Фертил Стерил. 2012 г.; 98:1423-7. [PubMed] [Google Scholar]
Успешные роды, полученные из витрифицированных нагретых сперматозоидов пациента с необструктивной азооспермией. Фертил Стерил. 2012 г.; 98:1423-7. [PubMed] [Google Scholar]
15. Coetzee K, Ozgur K, Berkkanoglu M, Bulut H, Isikli A. Надежная криоконсервация отдельных сперматозоидов в Cell Sleepers для лечения азооспермии. Андрология. 2016; 48:203-10. [PubMed] [Google Scholar]
16. Selice R, Garolla A, Pengo M, Caretta N, Ferlin A, Foresta C. Ответ на лечение ФСГ у мужчин с олигозооспермией зависит от полиморфизма гена рецептора ФСГ. Int J Androl. 2011 г.; 34:306-12. [PubMed] [Google Scholar]
17. Simoni M, Santi D, Negri L, Hoffmann I, Muratori M, Baldi E, et al. Лечение человеческим рекомбинантным ФСГ улучшает фрагментацию ДНК спермы у мужчин с идиопатическим бесплодием в зависимости от полиморфизма рецептора ФСГ p.N680S: фармакогенетическое исследование. Хум Репрод. 2016; 31:1960-9. [PubMed] [Google Scholar]
18. Санти Д., Граната А.Р., Симони М. Лечение ФСГ мужского идиопатического бесплодия повышает частоту наступления беременности: метаанализ. Эндокр Коннект. 2015, 4: С46–С58. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Эндокр Коннект. 2015, 4: С46–С58. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Симони М., Санти Д. Лечение ФСГ мужского идиопатического бесплодия: время для смены парадигмы. Андрология. 2020; 8:535-44. [PubMed] [Google Scholar]
20. Santi D, De Vincentis S, Alfano P, Balercia G, Calogero AE, Cargnelutti F, et al. Использование фолликулостимулирующего гормона для мужчин-партнеров пар с идиопатическим бесплодием в Италии: результаты многоцентрового обсервационного исследования клинической практики. Андрология. 2020; 8:637-44. [PubMed] [Академия Google]
21. Каннарелла Р., Ла Виньера С., Кондорелли Р.А., Монжио Л.М., Калоджеро А.Е. Влияние дозы ФСГ на обычные параметры спермы: метаанализ рандомизированных контролируемых исследований. Азиат Джей Андрол. 2020; 22:309-16. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Tharakan T, Salonia A, Corona G, Dhillo W, Minhas S, Jayasena C. Роль гормональной стимуляции у мужчин с необструктивной азооспермией, подвергающихся хирургическому извлечению спермы. J Clin Endocrinol Metab. 2020; 105: дгаа556. [PubMed] [Академия Google]
J Clin Endocrinol Metab. 2020; 105: дгаа556. [PubMed] [Академия Google]
23. Minhas S, Bettocchi C, Boeri L, Capogrosso P, Carvalho J, Cilesiz NC, et al. Рабочая группа EAU по мужскому сексуальному и репродуктивному здоровью. Руководство Европейской ассоциации урологов по мужскому сексуальному и репродуктивному здоровью: обновление 2021 г. по мужскому бесплодию. Евр Урол. 2021; 80:603-20. [PubMed] [Google Scholar]
24. Caroppo E, Colpi GM. Гормональное лечение мужчин с необструктивной азооспермией: на что указывают данные? Дж. Клин Мед. 2021; 10:387. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Foresta C, Bettella A, Spolaore D, Merico M, Rossato M, Ferlin A. Подавление высоких эндогенных уровней ФСГ в плазме у бесплодных мужчин связано с улучшением функции клеток Сертоли, что отражается в повышенных уровнях ингибина B в плазме. , Hum Reprod. 2004 г.; 19:1431-7. [PubMed] [Google Scholar]
26. Themmen AP, Blok LJ, Post M, Baarends WM, Hoogerbrugge JW, Parmentier M, et al. Понижающая регуляция рецептора фоллитропина включает зависимое от цАМФ посттранскрипционное снижение экспрессии мРНК рецептора. Мол Селл Эндокринол. 1991; 78:R7-13. [PubMed] [Google Scholar]
Понижающая регуляция рецептора фоллитропина включает зависимое от цАМФ посттранскрипционное снижение экспрессии мРНК рецептора. Мол Селл Эндокринол. 1991; 78:R7-13. [PubMed] [Google Scholar]
27. Намики М., Окуяма А., Сонода Т., Мияке А., Аоно Т., Мацумото К. Понижающая регуляция рецепторов фолликулостимулирующего гормона яичка человеческим менопаузальным гонадотропином у мужчин с бесплодием. Фертил Стерил. 1985 год; 44:710-2. [PubMed] [Google Scholar]
28. Zhang S, Li W, Zhu C, Wang X, Li Z, Zhang J, Zhao J, et al. Специфическая для клеток Сертоли экспрессия ассоциированного с метастазами белка 2 (MTA2) необходима для регуляции транскрипции гена рецептора фолликулостимулирующего гормона (FSHR) во время сперматогенеза. Дж. Биол. Хим. 2012 г.; 287:40471-83. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Намики М., Накамура М., Окуяма А., Сонода Т., Итатани Х., Сугао Х. и др. Снижение рецепторов гормонов, стимулирующих фолликулы яичек человека и крысы, человеческим менопаузальным гонадотропином in vivo и in vitro. Клин Эндокринол (Oxf). 1987 год; 26:675-84. [PubMed] [Google Scholar]
Клин Эндокринол (Oxf). 1987 год; 26:675-84. [PubMed] [Google Scholar]
30. Gnanaprakasam MS, Chen CJ, Sutherland JG, Bhalla VK. Процессы истощения и восполнения рецепторов: регуляция in vivo рецепторов гонадотропина лютеинизирующим гормоном, фолликулостимулирующим гормоном и этанолом в семенниках крыс. Биол Репрод. 1979; 20:991-1000. [PubMed] [Google Scholar]
31. Oduwole OO, Peltoketo H, Huhtaniemi IT. Роль фолликулостимулирующего гормона в сперматогенезе. Фронт Эндокринол (Лозанна). 2018; 9:763. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Oka S, Shiraishi K, Matsuyama H. Влияние хорионического гонадотропина человека на интерстициальные ткани яичка у мужчин с необструктивной азооспермией. Андрология. 2017; 5:232-9. [PubMed] [Google Scholar]
33. Аттиа А.М., Абу-Сетта А.М., Аль-Инани Х.Г. Гонадотропины при идиопатическом мужском факторе бесплодия. Кокрановская система базы данных, ред. 2013 г.; (8):CD005071. [PubMed] [Академия Google]
34. Аршад М.А., Майзуб А., Эстевес С.К. Предикторы хирургического извлечения сперматозоидов при необструктивной азооспермии: резюме современной литературы. Инт Урол Нефрол. 2020; 52:2015-38. [PubMed] [Google Scholar]
Аршад М.А., Майзуб А., Эстевес С.К. Предикторы хирургического извлечения сперматозоидов при необструктивной азооспермии: резюме современной литературы. Инт Урол Нефрол. 2020; 52:2015-38. [PubMed] [Google Scholar]
35. Achermann APP, Pereira TA, Esteves SC. Экстракция сперматозоидов методом микродиссекции яичка (микро-TESE) у мужчин с бесплодием вследствие необструктивной азооспермии: сводка современной литературы. Инт Урол Нефрол. 2021; 53:2193-210. [PubMed] [Google Scholar]
36. Esteves SC, Ramasamy R, Colpi GM, Carvalho JF, Schlegel PN. Показатели извлечения сперматозоидов с помощью микро-TESE по сравнению с обычным TESE у мужчин с необструктивной азооспермией — предположение о независимости величин эффекта может привести к ошибочным выводам. Обновление воспроизведения гула. 2020; 26:603-5. [PubMed] [Академия Google]
37. Берни А.М., Мата Д.А., Рамасами Р., Шлегель П.Н. Сравнение извлечения спермы из яичка с помощью микродиссекции, обычного извлечения спермы из яичка и аспирации спермы из яичка при необструктивной азооспермии: систематический обзор и метаанализ. Фертил Стерил. 2015 г.; 104:1099-103. [PubMed] [Google Scholar]
Фертил Стерил. 2015 г.; 104:1099-103. [PubMed] [Google Scholar]
38. Сираиси К., Исикава Т., Ватанабэ Н., Ивамото Т., Мацуяма Х. Спасительная гормональная терапия после неудачного извлечения спермы из яичка методом микродиссекции: многоцентровое проспективное исследование. Int J Урол. 2016; 23:496-500. [PubMed] [Google Scholar]
39. Kalsi JS, Shah P, Thum Y, Muneer A, Ralph DJ, Minhas S. Извлечение спермы из яичек методом микродиссекции спасения; исход у мужчин с необструктивной азооспермией с предыдущим неудачным извлечением спермы. БЖУ Интерн. 2015 г.; 116:460-5. [PubMed] [Google Scholar]
40. Punjani N, Flannigan R, Kang C, Khani F, Schlegel PN. Количественная гетерогенность гистопатологии яичек у мужчин с необструктивной азооспермией. Дж Урол. 2021; 206:1268-75. [PubMed] [Академия Google]
41. Фрайетта Р., Зильберштейн Д.С., Эстевес С.К. Повторный взгляд на гипогонадотропный гипогонадизм. Клиники (Сан-Паулу). 2013; 68 (Приложение 1):81-8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Hanson HA, Anderson RE, Aston KI, Carrell DT, Smith KR, Hotaling JM. Сниженная фертильность увеличивает риск рака яичек: данные популяционных образцов спермы. Фертил Стерил. 2016; 105:322-8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Hanson HA, Anderson RE, Aston KI, Carrell DT, Smith KR, Hotaling JM. Сниженная фертильность увеличивает риск рака яичек: данные популяционных образцов спермы. Фертил Стерил. 2016; 105:322-8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Hanson BM, Eisenberg ML, Hotaling JM. Мужское бесплодие: биомаркер индивидуального и семейного риска рака. Фертил Стерил. 2018; 109:6-19. [PubMed] [Google Scholar]
44. Fukagai T, Kurosawa K, Sudo N, Aso T, Sugawara S, Naoe M, et al. Двусторонние опухоли яичек у бесплодного мужчины, ранее получавшего фолликулостимулирующие гормоны. Урология. 2005 г.; 65:592. [PubMed] [Google Scholar]
45. Leão Rde B, Esteves SC. Терапия гонадотропином при вспомогательной репродукции: эволюционный взгляд от биологии к биотехнологии. Клиники (Сан-Паулу). 2014; 69:279-93. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Оптимизация гормонов, регулирующих сперматогенез, у пациентов с необструктивной азооспермией и ее влияние на получение спермы: многоцентровое исследование
Многоцентровое исследование
. 2013 март; 111 (3 часть B): E110-4.
2013 март; 111 (3 часть B): E110-4.
doi: 10.1111/j.1464-410X.2012.11485.x.
Epub 2012 7 сентября.
Алайман Хусейн
1
, Ясар Озгок, Лоуренс Росс, Правин Рао, Крейг Нидербергер
Принадлежности
принадлежность
- 1 Миниа Отделение исследований и лечения бесплодия, Университет Эль-Миния, Эль-Миния, Египет. [email protected]
PMID:
22958644
DOI:
10.1111/j.1464-410X.2012.11485.x
Многоцентровое исследование
Alayman Hussein et al.
БЖУ Интерн.
2013 март
. 2013 март; 111 (3 часть B): E110-4.
doi: 10.1111/j.1464-410X.2012.11485.x.
Epub 2012 7 сентября.
Авторы
Алайман Хусейн
1
, Ясар Озгок, Лоуренс Росс, Правин Рао, Крейг Нидербергер
принадлежность
- 1 Миниа Отделение исследований и лечения бесплодия, Университет Эль-Миния, Эль-Миния, Египет. [email protected]
PMID:
22958644
DOI:
10.
 1111/j.1464-410X.2012.11485.x
1111/j.1464-410X.2012.11485.x
Абстрактный
Тип исследования — Терапия (исходы) Уровень доказательности 2a Что известно по этому вопросу? и Что добавляет исследование? Цитрат кломифена, ХГЧ и человеческий менопаузальный гонадотропин (чМГ) широко используются при лечении олигоспермии, поскольку они повышают уровень ФСГ и тестостерона, необходимых для сперматогенеза. Поиск сперматозоидов при необструктивной азооспермии для интрацитоплазматической инъекции сперматозоидов является сложной задачей, и требуется много усилий для достижения оптимального метода извлечения сперматозоидов. Исследование показывает, что новый протокол цитрата кломифена, ХГЧ и ЧМГ при лечении необструктивной азооспермии обеспечивает повышение уровней ФСГ, ЛГ и общего тестостерона до целевых уровней, которые мы установили. Наш целевой уровень ФСГ был в 1,5 раза выше исходного уровня, а для сывороточного тестостерона он составлял 600-800 нг/дл. Используя описанный нами протокол лечения в случаях необструктивной азооспермии, сперматозоиды могут быть обнаружены в эякуляте пациентов (~ 11%), и если они останутся азооспермиями, у них будет большая вероятность получения сперматозоидов при экстракции сперматозоидов из яичек.
Используя описанный нами протокол лечения в случаях необструктивной азооспермии, сперматозоиды могут быть обнаружены в эякуляте пациентов (~ 11%), и если они останутся азооспермиями, у них будет большая вероятность получения сперматозоидов при экстракции сперматозоидов из яичек.
Цель:
Оценить влияние оптимизации уровня фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ) и тестостерона в сыворотке на получение сперматозоидов для интрацитоплазматической инъекции сперматозоидов.
Пациенты и методы:
В общей сложности 612 пациентов с необструктивной азооспермией были обследованы с обычным сбором анамнеза, физическим осмотром и гормональной оценкой. Из них 116 пациентам была выполнена микрохирургическая (микро)тестикулярная экстракция сперматозоидов (TESE) без какого-либо медикаментозного лечения и они составили контрольную группу, а остальные 496 пациентам вводили цитрат кломифена в титруемой дозе. Пациенты были разделены на четыре группы в зависимости от их реакции на цитрат кломифена. 1-я группа: больные с явным повышением ФСГ и общего тестостерона (n=372). Группа 2: пациенты с повышением уровня ФСГ при отсутствии или незначительном увеличении ЛГ и общего тестостерона (n = 62). Для этих пациентов мы продолжили лечение цитратом кломифена и добавили хорионический гонадотропин человека (ХГЧ). 3-я группа: больные без повышения уровня трех гормонов (n = 46). Группа 4: пациенты с постоянно снижающимся уровнем тестостерона в сыворотке крови в ответ на увеличение дозы кломифена цитрата (n = 16). Соответственно, пациентки в группах 3 и 4 прекратили прием цитрата кломифена и начали прием ХГЧ и человеческого менопаузального гонадотропина (чМГ). Анализы спермы проводились периодически, а у пациентов, у которых сохранялась азооспермия, выполнялся микро-TESE.
Пациенты были разделены на четыре группы в зависимости от их реакции на цитрат кломифена. 1-я группа: больные с явным повышением ФСГ и общего тестостерона (n=372). Группа 2: пациенты с повышением уровня ФСГ при отсутствии или незначительном увеличении ЛГ и общего тестостерона (n = 62). Для этих пациентов мы продолжили лечение цитратом кломифена и добавили хорионический гонадотропин человека (ХГЧ). 3-я группа: больные без повышения уровня трех гормонов (n = 46). Группа 4: пациенты с постоянно снижающимся уровнем тестостерона в сыворотке крови в ответ на увеличение дозы кломифена цитрата (n = 16). Соответственно, пациентки в группах 3 и 4 прекратили прием цитрата кломифена и начали прием ХГЧ и человеческого менопаузального гонадотропина (чМГ). Анализы спермы проводились периодически, а у пациентов, у которых сохранялась азооспермия, выполнялся микро-TESE.
Полученные результаты:
Сперматозоиды были отмечены у 54 пациентов (10,9%) в анализе спермы после лечения во всех группах (без существенных различий) при средней (sd) концентрации 2,3 (4,1) млн/мл. У 442 пациентов, у которых после лечения осталась азооспермия, успешное извлечение сперматозоидов было значительно выше (57%) по сравнению с контрольной группой (33,6%).
У 442 пациентов, у которых после лечения осталась азооспермия, успешное извлечение сперматозоидов было значительно выше (57%) по сравнению с контрольной группой (33,6%).
Заключение:
У пациентов с необструктивной азооспермией введение цитрата кломифена, чХГ и чМГ, приводящее к повышению уровня ФСГ и общего тестостерона, приводит к увеличению количества сперматозоидов в эякуляте и повышению вероятности успешного проведения микро-TESE.
© 2012 АВТОРЫ. БЖУ ИНТЕРНЭШНЛ © 2012 БЖУ ИНТЕРНЭШНЛ.
Похожие статьи
Re: Оптимизация гормонов, регулирующих сперматогенез, у пациентов с необструктивной азооспермией и ее влияние на получение спермы: многоцентровое исследование.
Нидербергер К.
Нидербергер К.
Дж Урол. 2013 декабрь; 190(6):2209. doi: 10.1016/j.juro.2013.08.092. Epub 2013, 6 сентября.
doi: 10.1016/j.juro.2013.08.092. Epub 2013, 6 сентября.
Дж Урол. 2013.PMID: 24209557
Аннотация недоступна.
Лечение хорионическим гонадотропином человека перед экстракцией сперматозоидов микродиссекцией яичка при необструктивной азооспермии.
Сираиси К., Оми С., Симабукуро Т., Мацуяма Х.
Шираиши К. и др.
Хум Репрод. 2012 фев; 27 (2): 331-9. дои: 10.1093/humrep/der404. Epub 2011 28 ноября.
Хум Репрод. 2012.PMID: 22128297
Назначение кломифена при необструктивной азооспермии: многоцентровое исследование.
Хусейн А., Озгок Ю., Росс Л., Нидербергер К.
Хусейн А. и др.
Дж Андрол. 2005 ноябрь-декабрь; 26(6):787-91; обсуждение 792-3. doi: 10.2164/jandrol.04180.
Дж Андрол. 2005.PMID: 16291975
Клиническое испытание.

Беременность после интрацитоплазматической инъекции спермы после расширенной подготовки спермы и гормональной терапии у мужчины с азооспермией, остановкой созревания и микролитиазом: отчет о клиническом случае и обзор литературы.
Барботин А.Л., Баллот С., Сигала Дж., Лерой М., Ригот Дж.М., Дьюайли Д., Робин Г., Митчелл В.
Барботин А.Л. и соавт.
Андрология. 2017 июнь;49(5). doi: 10.1111/and.12665. Epub 2016 29 июля.
Андрология. 2017.PMID: 27469438
Обзор.
Гормональные маркеры как неинвазивные предикторы извлечения сперматозоидов при необструктивной азооспермии.
Зарезаде Р., Фаттахи А., Никанфар С., Огбаи Х., Ахмади Ю., Растгар Резаи Ю., Нури М., Диттрих Р.
Зарезаде Р. и соавт.
J Assist Reprod Genet. 2021 авг; 38 (8): 2049-2059. doi: 10.1007/s10815-021-02176-3. Epub 2021 31 марта.
2021 авг; 38 (8): 2049-2059. doi: 10.1007/s10815-021-02176-3. Epub 2021 31 марта.
J Assist Reprod Genet. 2021.PMID: 33791895
Бесплатная статья ЧВК.Обзор.
Посмотреть все похожие статьи
Цитируется
Оценка эффективности визуализации передачи насыщения химического обмена креатина при оценке зрелости яичек.
Курибаяси С., Фукухара С., Цудзимура Г., Иманака Т., Окада К., Уэда Н., Такедзава К., Киучи Х., Сайто С., Такахаши Ю., Киока Х., Оура С., Шимада К., Икава М., Нономура Н.
Курибаяши С. и др.
Репрод Мед Биол. 2023 23 февраля; 22 (1): e12507. doi: 10.1002/rmb2.12507. электронная коллекция 2023 янв-дек.
Репрод Мед Биол. 2023.PMID: 36845001
Бесплатная статья ЧВК.Насколько успешно хирургическое извлечение спермы при синдроме Клайнфельтера?
Кайлаш Ю.
 , Рахим А.А., Хома СТ.
, Рахим А.А., Хома СТ.
Кайлаш Ю. и др.
Передняя часть здоровья. 2021, 18 февраля; 3:636629. doi: 10.3389/frph.2021.636629. Электронная коллекция 2021.
Передняя часть здоровья. 2021.PMID: 36303963
Бесплатная статья ЧВК.Обзор.
Изучение прогностических маркеров для успешных процедур извлечения спермы: линейная модель и систематический обзор.
Майор Н., Эдвардс К.Р., Симпсон К., Роджерс М.
Майор Н. и др.
Азиат Джей Андрол. 2023 янв-февраль;25(1):38-42. дои: 10.4103/aja202221.
Азиат Джей Андрол. 2023.PMID: 35645045
Бесплатная статья ЧВК.Улучшает ли гормональная терапия скорость извлечения сперматозоидов у мужчин с необструктивной азооспермией: систематический обзор и метаанализ.
Таракан Т.


 «Линия жизни» среди лидеров по результативности программ экстракорпорального оплодотворения
«Линия жизни» среди лидеров по результативности программ экстракорпорального оплодотворения Позволяет выявить внешние признаки – уменьшение размеров яичек, нарушение строения яичек и придатков, предстательной железы, возможные аномалии уретры и пр.
Позволяет выявить внешние признаки – уменьшение размеров яичек, нарушение строения яичек и придатков, предстательной железы, возможные аномалии уретры и пр. Врач рекомендует паре с мужским фактором бесплодия программу ЭКО.
Врач рекомендует паре с мужским фактором бесплодия программу ЭКО. 1111/j.1464-410X.2012.11485.x
1111/j.1464-410X.2012.11485.x doi: 10.1016/j.juro.2013.08.092. Epub 2013, 6 сентября.
doi: 10.1016/j.juro.2013.08.092. Epub 2013, 6 сентября.
 2021 авг; 38 (8): 2049-2059. doi: 10.1007/s10815-021-02176-3. Epub 2021 31 марта.
2021 авг; 38 (8): 2049-2059. doi: 10.1007/s10815-021-02176-3. Epub 2021 31 марта. , Рахим А.А., Хома СТ.
, Рахим А.А., Хома СТ.