Медицинский центр «Консультант» — Спермограмма
Медицинский центр «Консультант» предлагает исследование «Определение фрагментации ДНК в сперматозоидах методом TUNEL»совместно с ЗАО медико-биологическим центром «Пастер» г.Москва
Что такое ДНК фрагментация в сперматозоида?
Это разрушение или повреждение генетической цепочки, расположенной в головке сперматозоида. Из-за разрывов в спирали ДНК «выпадает» часть генетической информации,т.е сперматозоид теряет способность передавать правильный генетический материал будущему ребенку,что может вызвать нарушения оплодотворения и развития эмбриона,а так же вызвать самопроизвольное прерывание беременности.
Существует несколько методов определения ДНК фрагментации; TUNEL-тест обладает наиболее прогнозирующей способностью и отражает реальные результаты .
Пороговая величина TUNEL — теста составляет 15%, т.е. если число клеток с фрагментацией в норме не должно превышать 15%.
Показания к проведениюTUNEL — теста:
- Бесплодие неясного генеза
- Неудачные попытки искусственного оплодотворения
- Пациенткам с неоднократно происходившими самопроизвольными выкидышами или «замершей» беременностью
- Мужское бесплодие(при нормальных показателях спермограмм)
Как подготовится к исследованию.
- Половое воздержание 2-7 дней (ВОЗ, 2010). В клинической практике удобно, если воздержание соблюдается 3-4 дня. Дело в том, что в последствии может возникнуть необходимость в повторной спермограмме. Сравнение результатов будет более корректным, если воздержание перед повторным анализом будет в точности таким же, как и перед первым, с точностью до 1 дня. Повторную спермограмму желательно выполнить в той же лаборатории, что и первую.
- Не употреблять алкоголь.
- Не принимать некоторые лекарственные препараты (проконсультироваться с врачом).
- Воздержаться от тепловых процедур (УВЧ, баня, сауна, солярий, солнечные ванны). Можно принимать теплый душ.
- Отсутствие в течение последних 10 дней заболеваний, протекающих с лихорадкой.
Причины высокого уровня фрагментации ДНК в сперматозоидах.
- Особенности образа жизни: перегревание, курение ,ожирение, действие токсических веществ(ионизирующее излучение, прием некоторых лекарств средств, алкоголь, даже выхлопные газы)
- Воздержание (редкая половая активность) — индекс фрагментации увеличивается прямо пропорционально сроку воздержания
- Варикоцеле
- Инфекционно-воспалительные процессы мочеполовой системы(простатит,везикулит)
- Системные иммунные заболевания(диабет)
- Генетические фактора(наследственные дефекты сперматогенеза)
Анализ спермограммы и МАР-тест не позволяют оценить целостность генетического материала сперматозоидов!!!
Срок исполнения результата.
Результат исследования будет готов через14-20 рабочих дней, выдается только на бумажном носителе. Информацию о готовности результата можно узнать у сотрудников Call-центра по телефону 701-391
*Данное исследование является логистической услугой и результат анализа не будет отображаться в личном кабинете на сайте МЦ «Консультант»
TUNEL фрагментация сперматозоидов — исследование в Нижнем Новгороде
Исследование Tunel
Серьёзной причиной бесплодия и прерывания беременности может оказаться такой фактор, как фрагментация ДНК сперматозоидов.
Фрагментация — нарушение генетической структуры сперматозоидов, которая обуславливается наличием разрывов в цепочке ДНК. Удачное оплодотворение вероятно только в случае, если процент таких нарушений низок (менее 15%). Если этот процент выше, то вероятность наступления или сохранения беременности уменьшается.
Генетическая структура ДНК влияет на качество и развитие эмбриона, его имплантацию и течение самой беременности.
Иногда может произойти оплодотворение и при высоком проценте фрагментации, но на определенных сроках беременности большая вероятность её раннего прерывания.
Данную патологию обязательно необходимо выявить для избежания повторения неудач в попытках забеременеть самостоятельно или в программах ЭКО.
Такой анализ, как спермограмма даёт лишь информацию о морфологии, концентрации и подвижности сперматозоидов. Но она не измеряет параметры целостности структуры цепочки ДНК.
Самым точным способом оценки является тест на фрагментацию ДНК сперматозоидов методом TUNEL.
TUNEL даёт возможность достоверно оценить фрагментацию путём процентного соотношения сперматозоидов с нормальной структурой цепочки ДНК и сперматозоидов с повреждениями. С помощью TUNEL выявляются реальные, а не вероятные нарушения, благодаря чему данный метод признан самым точным.
Подготовка к исследованию такая же, как и при спермограмме. Материалом для исследования является эякулят мужчины.
Важно отметить, что даже при нормозооспермии, выявленной на спермограмме, когда все параметры эякулята в пределах нормы, есть вероятность высокой степени фрагментации, особенно у мужчин старшего репродуктивного возраста (40, а по некоторым данным и 35 лет!).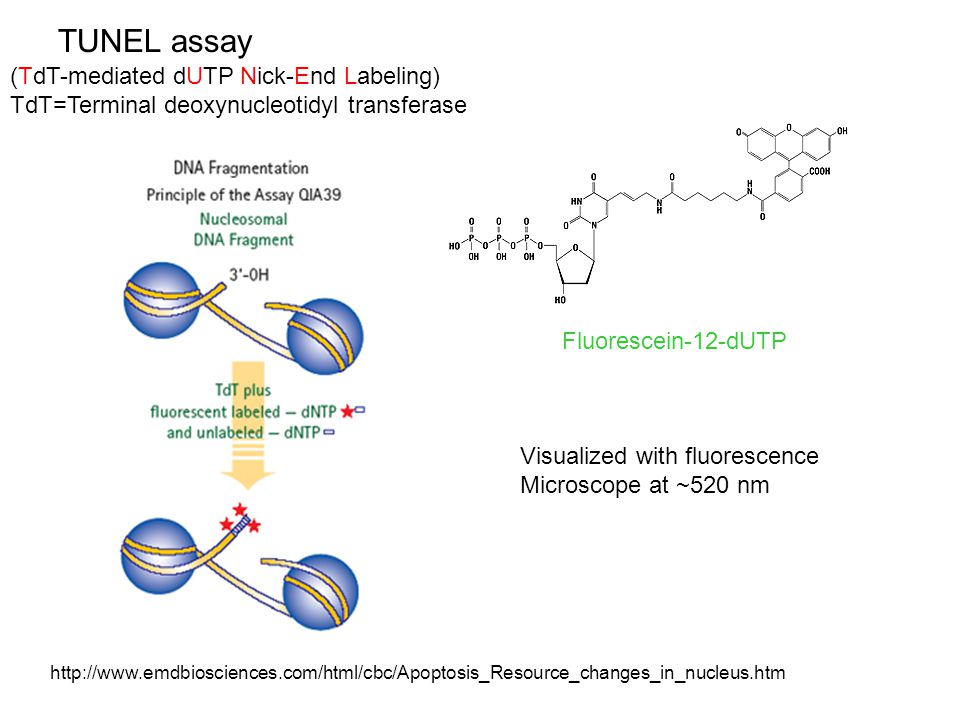
Причины повышенной фрагментации ДНК:
- генетические нарушения (дефицит белков протаминов, поддерживающих нормальную структуру молекул ДНК)
- хронические и воспалительные заболевания
- влияние на организм высоких температур, токсичных веществ, излучений
- вредные привычки (употребление алкоголя и курение)
- варикоцеле
Показания к проведению оценки фрагментации методом Tunel:
- Бесплодие неясного генеза, при отсутствии отклонений по спермограмме;
- Раннее прерывание беременности;
- Одна и более неудачных попыток ЭКО в анамнезе;
- Диагностированное варикоцеле у мужчины;
- Старший репродуктивный возраст мужчины.
В некоторых случаях, если нарушения в цепочке генов не слишком масштабные, яйцеклетка может самостоятельно восстановить структуру мужской ДНК при помощи своего генетического материала. Но это встречается далеко не всегда.
Тактика лечения при высокой фрагментации ДНК зависит от причин нарушений и определяется врачом.
Возможны как медикаментозная терапия с применением комплекса антиоксидантов, лечение инфекционных и воспалительных заболеваний полового тракта, так и оперативное лечение варикоцеле.
В случае отсутствия эффекта от терапии и высоком проценте поврежденных сперматозоидов методом преодоления фрагментации является ИКСИ. В тяжёлых случаях используются тестикулярные сперматозоиды, поскольку установлено, что степень фрагментации в яичке значительно ниже.
Самостоятельные мероприятия, способствующие уменьшению фрагментации:
- нормализация образа жизни — правильное питание, полный отказ от вредных привычек, исключение тепловых процедур (посещение бань, саун).
- регулярная половая жизнь – существуют данные, говорящие о том, что степень фрагментации ДНК может расти из-за больших периодов воздержания, при которых увеличивается время пребывания спермиев в семявыводящих путях.
Вы можете пройти исследование фрагментации ДНК сперматозоидов методом TUNEL в Нижнем Новгороде в клинике лечения бесплодия «Папа, мама и малыш».
|
Медика на проспекте Тореза пр-т Тореза, д. 72
|
пр-т Тореза, д. 72 | ||||
| |||||
|
Next Generation Clinic (NGC) 13-я линия В.О., д. 10А
|
13-я линия В.О., д. 10А | ||||
| |||||
|
ЦРМ на Комендантском проспекте Комендантский пр-т, д. 53, корп. 1
|
Комендантский пр-т, д. 53, корп. 1 | ||||
| |||||
|
Центр медицины плода на проспекте Тореза пр-т Мориса Тореза, д. 72
|
пр-т Мориса Тореза, д. 72 | ||||
| |||||
|
Мать и Дитя на Среднем проспекте В.О. Средний пр-т В.О., д. 88
|
Средний пр-т В.О., д. 88 | ||||
| |||||
|
XXI век на Б. Сампсониевском проспекте Б. Сампсониевский пр-т, д. 45
|
Б. Сампсониевский пр-т, д. 45 | ||||
| |||||
|
XXI век на Коломяжском проспекте Коломяжский пр-т, д. 28
|
Коломяжский пр-т, д. 28 | ||||
| |||||
|
XXI век на Пограничника Гарькавого ул. Пограничника Гарькавого, д. 15, к. 3
|
ул. Пограничника Гарькавого, д. 15, к. 3 | ||||
| |||||
|
XXI век на проспекте Косыгина пр-т Косыгина, д. 34, корп. 1
|
пр-т Косыгина, д. 34, корп. 1 | ||||
| |||||
|
XXI век на Марата ул. Марата, д. 48
|
ул. Марата, д. 48 | ||||
| |||||
|
XXI век на Б.  Пушкарской Пушкарской
ул. Б. Пушкарская, д. 20
|
ул. Б. Пушкарская, д. 20 | ||||
| |||||
|
XXI век на Щербакова ул.
|
ул. Щербакова, д. 11 | ||||
| |||||
|
XXI век в Моравском переулке Моравский пер.
|
Моравский пер., д. 3, корп. 2 | ||||
| |||||
|
XXI век на Гастелло ул.
|
ул. Гастелло, д. 22 | ||||
| |||||
|
XXI век на Сикейроса ул. Сикейроса, д.
|
ул. Сикейроса, д. 7, корп. 2 | ||||
| |||||
|
XXI век на проспекте КИМа пр-т КИМа, д.
|
пр-т КИМа, д. 28 | ||||
| |||||
|
МЦ доктора Добродеева на Жукова ул. Жукова, д.
|
ул. Жукова, д. 18 | ||||
| |||||
|
XXI век на Валерия Гаврилина ул. Валерия Гаврилина, д.
|
ул. Валерия Гаврилина, д. 11, корп. 1 | ||||
| |||||
|
XXI век на Коллонтай 4 ул.
|
ул. Коллонтай, д. 4 | ||||
| |||||
|
XXI век на Брянцева ул. Брянцева, д.
|
ул. Брянцева, д. 13, корп. 1 | ||||
| |||||
|
XXI век на Старо-Петергофском проспекте пр-т Старо-Петергофский, д.
|
пр-т Старо-Петергофский, д. 39, лит. А | ||||
| |||||
|
XXI век на Комендантском проспекте Комендантский пр-т, д.
|
Комендантский пр-т, д. 51, корп. 1 | ||||
| |||||
|
XXI век на Богатырском проспекте Богатырский пр-т, д.
|
Богатырский пр-т, д. 49, корп. 1 | ||||
| |||||
|
XXI век на проспекте Маршака пр-т Маршака, д.
|
пр-т Маршака, д. 4 | ||||
| |||||
|
XXI век на Коллонтай 6 ул. Коллонтай, д. 6, корп.
|
ул. Коллонтай, д. 6, корп. 1 | ||||
| |||||
Причины репродуктивных потерь у мужчин – фрагментация ДНК сперматозоидов | Овчинников Р.И., Гамидов С.И., Попова А.Ю., Ижбаев С.Х., Ушакова И.
 В., Голубева О.Н.
В., Голубева О.Н.
В настоящее время около 15–20% всех наступивших беременностей заканчиваются неудачно — это либо не-развивающаяся беременность, либо невынашивание (выкидыш) [1, 2]. Также к данной категории можно отнести и внематочную беременность. Все эти состояния относятся к репродуктивным потерям беременности. Значительную долю среди них составляют неудачные попытки применения программ вспомогательных репродуктивных технологий (ВРТ) — неразвивающиеся беременности после экстракорпорального оплодотворения (ЭКО) и/или интрацитоплазматической инъекции сперматозоида (ИКСИ).
Принято считать, что в абсолютно здоровой супружеской паре может встречаться не более 3 случаев невынашивания беременности в сроках ранее 20 нед. беременности, и это не требует какого-либо лечения. Однако при превышении этого порога такое состояние называют привычным невынашиванием беременности (ПНБ) или привычным выкидышем. Существует мнение, что этот диагноз должен ставиться уже после 2 произошедших выкидышей, поскольку вероятность последующего невынашивания беременности после 2 и 3 выкидышей схожа [2]. А (II класса), хромосомные анеуплоидии [4, 5].
А (II класса), хромосомные анеуплоидии [4, 5].
Новый взгляд на роль мужчины при ПНБ
В то же время остается невыясненной роль мужского фактора в ПНБ. До сих пор считалось, что у мужчин необходимо только лечение инфекционно-воспалительных заболеваний мочеполовой системы. Следовало добиться эрадикации возбудителей инфекций, в т. ч. передающихся половым путем (хламидии, микоплазмы, уреаплазмы, гарднереллы и т. д.). Однако в последнее время были выяснены новые обстоятельства.
Как известно, с возрастом у женщин снижаются овариальный резерв и целостность ооцитов. У мужчин существует способность поддерживать определенный уровень фертильности в течение всей жизни, однако эта функция ухудшается постепенно. Наблюдаются снижение уровня половых гормонов, ухудшение сексуальной функции, ухудшение показателей сперматогенеза и, как следствие, снижение фертильности. Кроме того, увеличиваются неблагоприятные исходы беременности, мутации сперматозоидов de novo (растут на 4% в год), чаще встречаются хромосомные анеуплоидии. Все это приводит к репродуктивным потерям беременности или врожденным дефектам и заболеваниям у потомства [6].
Все это приводит к репродуктивным потерям беременности или врожденным дефектам и заболеваниям у потомства [6].
Влияние отцовского возраста на качество спермы
Возрастные изменения обычных параметров спермы проявляются в сокращении объема спермы, уменьшении общего количества сперматозоидов, ухудшении подвижности и морфологии сперматозоидов. При этом концентрация сперматозоидов достоверно не меняется. Многие изменения до настоящего времени остаются предметом дискуссии. Этиология изменений связана с накоплением с возрастом сопутствующих заболеваний, таких как: сосудистая недостаточность (диабет, артериальная гипертензия), хронические инфекции (простатит и др.), ожирение, гормональная недостаточность. Однако до конца этиология все еще четко не определена [6].
L. Vagnini et al. оценивали влияние возраста на качество спермы. Оказалось, что с возрастом уменьшается количество и ухудшается качество сперматозоидов, увеличивается количество сперматозоидов с большими ядерными вакуолями (более 50% объема ядра), значительно возрастает степень фрагментации ДНК сперматозоидов (TUNEL, p<0,05). Авторы делают вывод, что возраст не только матери, но и отца влияет на репродуктивные способности пары [7].
Авторы делают вывод, что возраст не только матери, но и отца влияет на репродуктивные способности пары [7].
Значение фрагментации ДНК сперматозоидов
Фрагментация ДНК сперматозоидов — нарушение целостности их ДНК, связанное с упаковкой патологического хроматина или дефицита протамина, оказывающее негативное влияние на репродуктивные исходы при естественном зачатии или в программах ВРТ. У бесплодных мужчин процент сперматозоидов с нарушением целостности ДНК — более 30%, у здоровых фертильных мужчин — менее 15%. При фрагментации ДНК спермы более 30% вероятность наступления беременности крайне низка [8].
Каково же клиническое значение оценки состояния хроматина и повреждения ДНК сперматозоидов? В исследовании канадских авторов в 2014 г. продемонстрировано, что такие изменения приводят к уменьшению мужского фертильного потенциала, низкой частоте наступления беременности, а также репродуктивным потерям. Результатами этого являются не только снижение эффективности программ ВРТ, но и невынашивание или неразвивающиеся беременности. Также увеличивается вероятность возникновения хромосомных нарушений у детей, врожденных дефектов, и наблюдается уменьшение срока жизни потомства [9, 10].
Также увеличивается вероятность возникновения хромосомных нарушений у детей, врожденных дефектов, и наблюдается уменьшение срока жизни потомства [9, 10].
Сравнительный анализ 3 методов оценки повреждения ДНК сперматозоидов представлен в исследовании L. Simon et al. (США, 2014). 238 мужчин обследовались в центре репродукции при помощи методов COMET, TUNEL и флоуцитометрической оценки хроматина. Методы TUNEL и COMET оказались более точными предикторами успешности ВРТ, чем флоуцитометрическая оценка хроматина. При этом было показано, что подготовленная сперма вместо нативной в программах ВРТ может отличаться ятрогенным увеличением повреждения ДНК сперматозоидов. Кроме того, женские факторы могут снизить прогностическое значение анализа ДНК спермы [11].
Группой иранских ученых исследовалось влияние фрагментации ДНК сперматозоидов на ПНБ. В 1-ю группу были включены 30 пар с ПНБ, во 2-ю (контроль) — 30 фертильных пар. В 1-й группе уровень фрагментации ДНК сперматозоидов составил 43,3%, что достоверно превышало таковой в группе контроля, — 16,7% (p=0,024). Сперма мужчин в парах с ПНБ имела более высокий уровень фрагментации ДНК, чем в контрольной группе, что указывает на возможную связь между идио-патическими репродуктивными потерями и фрагментацией ДНК сперматозоидов [12].
Сперма мужчин в парах с ПНБ имела более высокий уровень фрагментации ДНК, чем в контрольной группе, что указывает на возможную связь между идио-патическими репродуктивными потерями и фрагментацией ДНК сперматозоидов [12].
В недавно опубликованном метаанализе, в основу которого были положены результаты 16 когортных и 14 проспективных исследований (n=2969), было выявлено, что фрагментация ДНК сперматозоидов увеличивает риск невынашивания беременности после ИКСИ. Оценка фрагментации ДНК сперматозоидов проводилась методами TUNEL и COMET. Риск возникновения нераз-вивающейся беременности после ВРТ/ИКСИ у больных с высокой степенью фрагментации ДНК сперматозоидов составил 2,16 (1,54–3,03) (р<0,00001) [13].
В обзоре J. J. Tarin et al. рассматривались результаты использования программ ВРТ. Авторы проанализировали, почему процент рождения детей столь низок. Оказалось, что на данный показатель влияет множество факторов: прежде всего возраст родителей, хромосомные аномалии эмбриона, экологические факторы риска. Непосредственно сами ВРТ-процедуры: стимуляция яичников, криоконсервация гамет/эмбрионов, ооцитов, ИКСИ, биопсии эмбриона могут вызвать эпигенетические изменения в половых клетках и/или преимпланта-ционных эмбрионах. Влияние оказывают митохондриальные, генетические и эпигенетические свойства гамет и эмбрионов. Исследователи пришли к выводу, что индуцированные и/или унаследованные нарушения ДНК в потомстве вряд ли можно предотвратить, даже заменив всю цитоплазму яйцеклеток в программах ВРТ [14].
Непосредственно сами ВРТ-процедуры: стимуляция яичников, криоконсервация гамет/эмбрионов, ооцитов, ИКСИ, биопсии эмбриона могут вызвать эпигенетические изменения в половых клетках и/или преимпланта-ционных эмбрионах. Влияние оказывают митохондриальные, генетические и эпигенетические свойства гамет и эмбрионов. Исследователи пришли к выводу, что индуцированные и/или унаследованные нарушения ДНК в потомстве вряд ли можно предотвратить, даже заменив всю цитоплазму яйцеклеток в программах ВРТ [14].
С распространением ВРТ растет осознание важности повреждения ДНК спермы. На сегодня эти последствия еще в значительной степени неизвестны.
Бесплодные мужчины имеют значительно больше ДНК-повреждений спермы, чем фертильные мужчины, и это повреждение ДНК может негативно повлиять на репродуктивные исходы. Дефицит протаминов и воздействие активных форм кислорода могут быть причинами повреждения ДНК спермы. Повреждение ДНК сперматозоидов является вредным для исходов ВРТ. Тесты для оценки повреждения ДНК могут обеспечить лучшую прогностическую информацию, чем стандартные параметры спермы [15].
Тесты для оценки повреждения ДНК могут обеспечить лучшую прогностическую информацию, чем стандартные параметры спермы [15].
Важность оценки фрагментации ДНК сперматозоидов подтверждает следующий факт. В промышленном рыбоводстве для видов рыб, имеющих сперму с прота-минами, используются тесты, сравнимые с FISH и COMET, для оценки повреждения ДНК сперматозоидов. Высокий уровень фрагментации ДНК может помешать эффективному искусственному воспроизводству. Указывается, что хотя сперматозоиды с поврежденной ДНК существенно не влияют на оплодотворение ооцитов, они могут оказать влияние на развитие эмбрионов и репродуктивный успех в рыбоводстве в целом [16].
Этиология повреждения ДНК сперматозоидов
Этиология нарушений хроматина и повреждения ДНК сперматозоидов очень разнообразна. В первую очередь это первичные или внутренние дефекты сперматогенеза (аномалии развития или генетические дефекты), вторичные или внешние повреждения тестикул (гонадотоксины, гипертермия, оксидативный стресс, эндокринные заболевания). Патогенез повреждений ДНК связан с дефицитом протаминов, наличием активных форм кислорода, нарушениями апоптоза, нарушениями замены гистонов на протамины в сперматидах, плохой упаковкой хроматина, усилением чувствительности к оксидативному стрессу дефектных сперматозоидов [9].
Патогенез повреждений ДНК связан с дефицитом протаминов, наличием активных форм кислорода, нарушениями апоптоза, нарушениями замены гистонов на протамины в сперматидах, плохой упаковкой хроматина, усилением чувствительности к оксидативному стрессу дефектных сперматозоидов [9].
В практическом плане к повреждению ДНК сперматозоидов приводят поздний отцовский возраст, варико-целе, инфекции мочеполовых путей, травмы спинного мозга, лихорадки, гонадотоксины [17].
Поскольку повлиять на возраст в настоящее время медицина не может, в стратегии по оптимизации фертильности предлагаются: устранение варикоцеле, здоровый образ жизни, использование антиоксидантов, применение новых достижений ВРТ, сокращение количества внеклеточной ДНК [6].
Влияние варикоцелэктомии на фрагментацию ДНК сперматозоидов
Что дает устранение варикоцеле? По данным метаанализа на основе рандомизированных проспективных исследований (Embase, Medline), после варикоцелэктомии отмечались: увеличение концентрации сперматозоидов на 12,3 млн/мл, подвижности — на 10,86% (p<0,001), а также уменьшение оксидативного стресса, фрагментации ДНК и улучшение ультраструктурной морфологии сперматозоидов. Частота наступления спонтанной беременности была выше, чем в группе наблюдения (отношение шансов (ОШ) 2,23, 95% доверительный интервал (ДИ) 0,86–5,78) [18].
Частота наступления спонтанной беременности была выше, чем в группе наблюдения (отношение шансов (ОШ) 2,23, 95% доверительный интервал (ДИ) 0,86–5,78) [18].
В другом метаанализе рандомизированных проспективных исследований оценивались: концентрация, подвижность, морфология, оксидативный стресс, фрагментация ДНК сперматозоидов и частота наступления беременности. Отмечено статистически значимое улучшение показателей у пациентов после варикоцелэкто-мии по сравнению с группой наблюдения (ОШ 2,69, 95% ДИ 1,16–6,24). Частота наступления спонтанной беременности составила 30%, наблюдалось уменьшение количества случаев невынашивания беременности в I триместре. По мнению авторов, главной альтернативой ва-рикоцелэктомии является использование программ ВРТ [19].
В исследовании M. Smit et al. отмечено уменьшение фрагментации ДНК сперматозоидов после варикоцел-эктомии. У 49 бесплодных мужчин с варикоцеле оценивались: спермограмма, индекс фрагментации ДНК и частота наступления беременности до и через 2 года после операции по поводу варикоцеле. В результате хирургического лечения варикоцеле концентрация сперматозоидов возросла с 4,8 до 14,3 млн/мл, подвижность — с 16,7 до 26,6% (у 63% больных — более чем на 50%). Индекс фрагментации ДНК сперматозоидов сократился с 35,2 до 30,2% (р=0,019). Спонтанная беременность наступила у супруг 37% больных, беременность после ВРТ — у 24% [20].
В результате хирургического лечения варикоцеле концентрация сперматозоидов возросла с 4,8 до 14,3 млн/мл, подвижность — с 16,7 до 26,6% (у 63% больных — более чем на 50%). Индекс фрагментации ДНК сперматозоидов сократился с 35,2 до 30,2% (р=0,019). Спонтанная беременность наступила у супруг 37% больных, беременность после ВРТ — у 24% [20].
Также изменения качества ДНК спермы после микрохирургической варикоцелэктомии отмечены в исследовании американских авторов. 74 мужчины перенесли микрохирургическую варикоцелэктомию (27 — одностороннюю и 47 — двухстороннюю). Фрагментация ДНК (TUNEL) снизилась с 13,72 до 7,54% (р<0,001). Авторы сделали вывод, что микрохирургическая варикоцелэк-томия приводит к снижению высокого уровня фрагментации ДНК сперматозоидов как одного из патогенетических путей возникновения мужского бесплодия [21].
Интересные данные о влиянии варикоцеле на спонтанные выкидыши в I триместре привели M. Ghanaie et al. В исследование были включены 136 мужчин с варикоцеле и нормальными параметрами спермограммы, жены которых имели ПНБ. Больным 1-й группы была выполнена варикоцелэктомия (n=68), 2-я группа была контрольной (n=68). В результате частота ПНБ в 1-й группе составила 13,3%, а во 2-й группе — 69,2% (р=0,01). Таким образом, устранение варикоцеле приводило к достоверному снижению количества случаев ПНБ. Концентрация сперматозоидов, время, прошедшее после операции, и возраст супруги — наиболее важные прогностические факторы успешного течения беременности [22].
Устранение неблагоприятных факторов риска нарушений фертильности
Следующим пунктом стратегии оптимизации фертильности является устранение неблагоприятных факторов риска развития бесплодия. К ним относятся ожирение, гиподинамия, курение, алкоголь, перегревание, баня (сауна), мобильные телефоны, Wi-Fi, ноутбуки и др. [23].
В исследовании N. Zampieri et al. рассматривалось влияние коррекции неблагоприятных факторов образа жизни на качество эякулята у больных с бесплодием. Оценивалась спермограмма 52 курящих и употребляющих спиртное и кофе пациентов с бесплодием. У 76% мужчин, которые бросили курить или уменьшили количество сигарет, исключили кофе и спиртные напитки, включили в ежедневный рацион фрукты и овощи, наладили регулярную половую жизнь, отмечено улучшение показателей спермограммы [24].
Приведенные британскими учеными в метаанализе по влиянию мобильных телефонов на качество сперматозоидов данные о 1492 образцах спермы из 10 исследований свидетельствуют о том, что у пользователей наблюдалось снижение подвижности сперматозоидов на 8,1%, их жизнеспособности — на 9,1% (р<0,05). При этом концентрация сперматозоидов достоверно не менялась. Авторы указывают на необходимость дальнейших исследований в этой области и в области повреждения ДНК сперматозоидов [25].
Необходимо исключение профессиональных вредностей (работа на горячем производстве, в кулинарном цехе, контакт с тяжелыми металлами, пестицидами, полимерами, пылью, воздействие радиационного и электромагнитного излучения и др.) [26].
Отмена лекарственных препаратов, потенциально ухудшающих показатели спермограммы (циметидин, блокаторы Са2+, спиронолактон, статины, некоторые антибиотики (нитрофурантоины, эритромицин, сульфаниламиды), трициклические антидепрессанты, ингибиторы обратного захвата серотонина, литий, химиотерапевтические препараты, ингибиторы 5а-редуктазы, а-блокаторы и др.), также может привести к улучшению фертильности за счет снижения повреждения ДНК сперматозоидов [27].
Антиоксидантная терапия
Эффект применения пероральных антиоксидантов и микроэлементов (супероксиддисмутаза, каталаза, глу-татионпероксидаза, витамины Е, С, каротиноиды, уби-хинон, селен, цинк, фолиевая кислота, ацетилцистеин, L-карнитин, коэнзим Q10) оценивался в базе данных (Cochrane) мужчин из 2876 пар, проходящих программы ВРТ. Исследования показали, что употребление в пищу антиоксидантов и микроэлементов способствует повышению шансов на зачатие для субфертильных пар, прибегающих к использованию ВРТ. Дальнейший сравнительный анализ необходим для определения наиболее значимых микроэлементов [28].
Измерение способности сперматозоидов связываться с гиалуроновой кислотой применяется для прогнозирования возможности оплодотворения яйцеклетки во время ЭКО. А. Yagci et al. показали, что гиалуроно-вая кислота обладает высокой селективностью связывания сперматозоидов с высокой целостностью ДНК [29]. В. Breznik et al. указали, что использование тест-пластин HBA является полезным для прогнозирования способности сперматозоидов к оплодотворению яйцеклеток в условиях ЭКО и отбора образцов спермы, подходящих для ЭКО и ИКСИ [30].
Данные исследования показали, что HBA-тест может использоваться для оценки целостности ДНК сперматозоидов. Повышение способности связывания с гиалуроновой кислотой означает увеличение числа более подвижных и морфологически нормальных сперматозоидов с высоким уровнем целостности ДНК, что является признаком высокой вероятности эффективного оплодотворения и последующей нормальной беременности.
В современных публикациях широко обсуждается влияние микронутриентов на качество спермы. Целью работы австрийских авторов являлась оценка влияния препарата, содержащего 8 микронутриентов, на результаты теста связывания сперматозоидов с гиалуроновой кислотой в нативном эякуляте (HBA-тест) у мужчин с идиопатическим бесплодием в рамках открытого пилотного сравнительного исследования. В основную группу были включены 67 мужчин с идиопатическим бесплодием. В ходе исследования им было предложено в течение 3 мес. ежедневно принимать по 2 капсулы нутрицевти-ка, каждая капсула которого содержит L-карнитин, L-аргинин, цинк, витамин Е, глутатион, селен, коэнзим Q10 и фолиевую кислоту (PROfertil®). До и после исследования проводился анализ спермы. В группу контроля вошли 40 мужчин с бесплодием, не получавшие никакой терапии. У них также определялись изменения показателей HBA-теста по сравнению с исходными данными.
Было установлено, что результаты НВА-теста значительно улучшились в основной группе после 3 мес. лечения. Медиана показателей анализа изменилась с 56% в исходной точке до 74% в конце исследования (р<0,05). Полученная разница в основной группе была достоверно выше — на 19,7% по сравнению с исходным значением, при этом в контрольной группе показатели ухудшились на 2,1%. Доля пациентов с улучшением показателей НВА-теста через 3 мес. после исходного анализа была значительно выше в основной группе, чем в контрольной (74,6 и 30% соответственно, р=0,0001). Это свидетельствует о том, что у мужчин с бесплодием, получавших препарат, состоящий из микронутриентов, повысилась способность связывания сперматозоидов с гиалуроновой кислотой [31].
Применение данного подхода представляется важным для лечения бесплодия, т. к. низкие показатели целостности ДНК связаны со снижением вероятности естественного зачатия, уменьшением оплодотворяющего потенциала спермы, используемой в программах ВРТ, повышением частоты нарушений эмбрионального развития и выкидышей, а также увеличением вероятности заболеваний у новорожденных [32].
Вместе с тем роль антиоксидантов в улучшении качества спермы остается спорной — преимущественно по причине низкого качества большинства исследований и использования различных комбинаций антиоксидантов, их дозировок, а также различной длительности терапии. Частота наступления беременности, являющаяся наиболее значимым результатом, оценивалась только в некоторых исследованиях [33].
В рандомизированном исследовании иранских ученых оценивалось добавление антиоксидантной терапии к стандартной варикоцелэктомии в послеоперационном периоде. 1-ю группу составили 50 мужчин, перенесших ингвинальную варикоцелэктомию; 2-ю группу — 50 мужчин после ингвинальной варикоцелэктомии и приема L-карнитина 250 мг 3 р./сут в течение 6 мес. Повреждение ДНК сперматозоидов сократилось к 3 мес. в 1-й группе до 10,4%, а во 2-й группе — до 5,6%. Однако к 6 мес. составило 9,8 и 7,8% соответственно. Авторы делают вывод, что добавление антиоксидантной терапии после варикоцелэктомии улучшает эффект через 3 мес. после операции [34].
Новые достижения ВРТ
Недавно опубликован метаанализ, в котором оценивалась эффективность интрацитоплазматической инъекции морфологически избранного сперматозоида под большим увеличением (ИМСИ) на исходы ВРТ при фрагментации ДНК сперматозоидов (Великобритания, 2014). В анализ были включены 54 пары (ИКСИ — 20, ИМСИ — 34). Индекс фрагментации ДНК составлял более 30% (TUNEL). Не было статистических различий в частоте наступления беременности (ИКСИ — 55,6%, ИМСИ — 52,9%), частоте рождения живых детей (50%) или выкидышей (ИКСИ — 5,6%, ИМСИ — 8,8%). Авторами сделан вывод о том, что ИМСИ не может улучшить исходы ВРТ при высоком уровне фрагментации ДНК сперматозоидов [35].
Однако метаанализ оценки состояния здоровья 1028 детей, рожденных после проведения ЭКО с 2005 по 2010 г., показал, что при применении ИМСИ наблюдалась более низкая частота основных пороков развития (1,33%), чем при стандартной ИКСИ (3,8%). Были собраны медицинские данные и катамнез в течение 2 лет после рождения. Эти 2 группы были сопоставимы по возрасту родителей, проведенному лечению, количеству ооцитов, дней переноса эмбрионов, гестационно-му возрасту и весу при рождении. Тем не менее частота основных пороков была значительно ниже с ИМСИ (6/450, 1,33%) по сравнению с ИКСИ (22/578, 3,80%; ОШ 0,35, 95% ДИ 0,14–0,87, р=0,014). В заключение подчеркивается благотворное влияние ИМСИ на результаты ВРТ [36]. Однако требуются дальнейшие исследования в данной области.
Внеклеточная ДНК и протеомика спермы
Хорошо известны ограничения традиционных методов анализа спермы в диагностике и лечении мужского бесплодия. Для его оценки используется все большее число сложных анализов, включая измерения фрагментации ДНК сперматозоидов, окислительного стресса и антиоксидантной способности. В последние несколько лет отмечаются огромные достижения в области про-теомики спермы, определения количества внеклеточной ДНК, что обещает революцию в диагностике и лечении бесплодия и ПНБ [37].
Заключение
Оценка фрагментации ДНК сперматозоидов является важным прогностическим показателем. Показаниями к оценке фрагментации ДНК сперматозоидов являются: бесплодие неясного генеза при нормальных показателях спермограммы, ПНБ (неразвивающиеся беременности) у супруги, неудачные попытки использования ВРТ в анамнезе, поздний отцовский возраст.
Для устранения проблемы ПНБ в паре мужчине необходимо провести лечение инфекций мочеполовой системы, устранить варикоцеле, вести здоровый образ жизни, применять антиоксидантную терапию. Микрохирургическая варикоцелэктомия по собственной модифицированной методике повышает частоту спонтанной беременности и улучшает результаты ВРТ (в т. ч. при неудачных попытках в анамнезе). Варикоцелэктомия уменьшает оксидативный стресс и фрагментацию ДНК сперматозоидов, способствует сокращению репродуктивных потерь (особенно в I триместре беременности).
Арсенал андролога неуклонно расширяется. Все виды этой современной медицинской помощи парам с ПНБ оказываются в полном объеме в условиях отделения андрологии и урологии, сохранения и восстановления репродуктивной функции, отделения профилактики и терапии невынашивания беременности, а также в научных лабораториях ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. академика В. И. Кулакова» Минздрава России.
.
Возможности репродуктивной генетической диагностики в ЦМРТ на Яузе для повышения эффективности ЭКО
06.08.2018
- Главная /
- Блог /
- Возможности репродуктивной генетической диагностики в ЦМРТ на Яузе для повышения эффективности ЭКО
В нашем госпитале имеется собственная генетическая лаборатория, специализирующаяся на репродуктивной генетике. Мы сотрудничаем с ведущими мировыми центрами генетической диагностики (Испании, Великобритании), используя их потенциал и внедряя в практику лучшие инновационные методики. Это позволяет нам проводить эксклюзивные даже для Москвы исследования, некоторые из которых доступны только в нашем госпитале (тест ERA).
! Генетическое обследование в Клиническом госпитале на Яузе помогает установить причины бесплодия, что существенно повышает эффективность программ ВРТ.
Генетические исследования для пары
- Кариотипирование – определение нарушений в хромосомном наборе у будущих родителей (количество, структура хромосом). Позволяет выявить генетически обусловленный риск рождения больного, умственно отсталого ребёнка, выкидыша, мертворождения.
- Определение генетической совместимости супругов для снижения риска наследственных заболеваний у ребёнка. Выявляет носительство мутаций в генах, связанных с развитием 600 генетических заболеваний.
Генетические исследования для женщины
Генетические исследования для мужчины
- FISH спермы (флуоресцентная гибридизация in situ). Проводится с целью определения хромосомного статуса отдельных сперматозоидов в случае плохих показателей спермограммы.
- Определение индекса фрагментации хроматина (HALO- или TUNEL-тесты) – нарушение целостности ДНК сперматозоидов, что важно для оплодотворяющей способности спермы. Высокий процент дефектной ДНК снижает вероятность наступления беременности естественным путём.
- Установление отцовства и степени родства. Возможно, как после рождения малыша, так и во время беременности. В первом случае сравнивают генетический материал отца и ребёнка по анализу крови или соскоба эпителия щеки обоих исследуемых. Во втором случае сравнивают ДНК плода, полученную из крови беременной женщины, и ДНК отца из образца его защёчного эпителия.
Другие генетические исследования
- «Генетический паспорт» — комплекс исследований, направленных на определение особенностей организма пациента, вероятности развития у него наследственных заболеваний, в том числе онкологических, степени риска передать их потомству и множества разнообразных индивидуальных способностей, склонностей и качеств, генетической генеалогии исследуемого.
Смотреть все
Работаем без выходных
Обслуживание на двух языках: русский, английский.
Оставьте свой номер телефона, и мы обязательно перезвоним вам.
Спермограмма
Что такое спермограмма?
Спермограмма в Самаре – лабораторный анализ, в ходе которого производится оценка состоятельности сперматозоидов и семенной плазмы. Выделяют следующие показания к проведению такой диагностики:
- отсутствие детей у пары при регулярной половой жизни более 1 года без предохранения от беременности;
- перенесенные мужские болезни, ведущие к бесплодию (варикоцеле, воспаление яичек, орхит, простатит, травмы половых органов, гормональные расстройства) для оценки результативности проведенного лечения;
- планирование беременности;
- в рамках подготовки к экстракорпоральному оплодотворению или искусственной инсеминации;
Мужчина может также сдать анализ по собственному желанию, чтобы убедиться, что он может иметь детей.
Лечащий врач может также рекомедовать сдать спермограмму для проведения дополнительной диагностику по эякуляту:
- MAR-тест: в соответствии в рекомендациями ВОЗ проводится для выявления антиспермальных антител, которые разрушают мужские половые клетки, лишая их возможности проникновения в яйцеклетку. Тест исключает так называемое иммунологическое бесплодие;
- подсчет лейкоцитов и исследование микробиотов (бактерий, грибов и вирусов) назначается при поиске причин мужского бесплодия или хронического заболевания мочеполовой системы;
- исследование фрагментации ДНК сперматозоидов указывает на разрыв или повреждение цепочек сперматозоида. Чем больше таких повреждений, тем ниже степень целостности генетического материала и меньше шансов наступления беременности. Анализ проводится в случае, если другие причины бесплодия уже исключены.
Где сдать спермограмму в Самаре
Материал для спермограммы (в т.ч. с MAR-тестом) и исследования фрагментации ДНК сперматозоида рекомендуется сдавать по месту проведения анализа. Так для эякулята создается необходимые условия для наиболее объективного анализа: контейнер оставляют ненадолго при температуре 37 C до полного разжижжения, после чего лаборант сразу приступает к проведению анализа.
При других исследованиях спермы (посев на микрофлору) допускается доставка биоматериала в лабораторию в стерильном одноразовом контейнере при комнатной температуре в течение одного часа.
Сегодня в Медгарде созданы все необходимые условия и комфортная обстановка для выполнения столь деликатной задачи.
КОГДА?
Правила подготовки к спермограмме:
- Соблюдение полового воздержания в течение 2-4 суток до процедуры. Если в этот период произошло ночное семяизвержение (поллюция), следует перенести исследование на более поздний срок;
- Исключение приема алкогольных напитков, посещения саун и бань, принятия солнечных ванн и лекарственных препаратов (по согласованию с врачом) на две недели. После проведенной антибактериальной терапии должно пройти не менее 4 недель. Нежелательно курение.
- Исключение стресса накануне исследования.
- Соблюдение правил личной гигиены до и во время получения эякулята, это особенно важно для анализов на подсчет лейкоцитов и выявление бактерий, грибов и вирусов.
Срок изготовления результатов анализа — 1 рабочий день.
P.S.
Клинико-диагностическая лаборатория лечебно-диагностического комплекса «Медгард» проводит семиологические исследования с 2009 года.
- Спермограмма (в соответствии с последним протоколом ВОЗ)
-
MAR-тест IgG -
Исследование фрагментации ДНК сперматозоидов методом TUNEL -
Подсчет лейкоцитов в эякуляте -
Микробиологическое исследование: посев на микрофлору с определением чувствительности к антибиотикам -
ПЦР-исследования: вирусы папилломы человека (ВПЧ-генотипирование), Chlamidia tracomatis, Mycoplasma hominis, M. genitalium, Ureaplasma urealiticum, U.parvum, Neisseria gonorrhoeae, Gardnerella vaginalis, Trichomonas vaginalis, вирус простого герпеса (ВПГ 1,2) Андрофлор : 15 и 24 показателя
ВАЖНО!
В случае обнаружения отклонений от нормы важно не впадать в панику, а обратиться к врачу. Он назначит необходимую терапию, после чего дело останется только за тем, чтобы проводить ее и соблюдать все рекомендации. Это наилучший залог вашего здоровья.
Фрагментация ДНК спермы
Фрагментация ДНК спермы (индекс фрагментации ДНК)
Для чего нужен тест на фрагментацию ДНК?
Если первичная диагностика фертильности (спермограмма, МАР-тест, Ros-тест, HBA-тест и анализы крови) не прояснили причины отсутствия беременности, мужчине назначают тест на фрагментация ДНК спермы — позволяющий выявить процент сперматозоидов с неповрежденной и поврежденной ДНК.
Опытным путем показано, что увеличение содержания сперматозоидов с фрагментированной ДНК приводит к отсутствию беременности, произвольному прерыванию беременности и снижает эффект от процедур ВРТ. Тест основан на анализе специфически обработанных и прокрашенных ядер сперматозоидов в агарозном геле с использованием световой микроскопии. По результатам исследований врач может назначить дополнительную терапию, влияющую на качество фертильности и сперматогенеза.
Какой метод выбрать: SCD или TUNEL
Оба метода диагностики имеют высокие показатели точности. Различия в том, каким пациентам они назначаются.
Для мужчин, чье качество спермы снижено, либо требует дополнительной оценки (например перед зачатием, до/после лечения и т.п.) — показан метод SCD.
Такой метод диагностики подходит большинству пациентов.
В случаях, когда зачатие не наступает в течение года и более, либо наблюдались выкидыши, замершие беременности и т.п. — рекомендован метод TUNEL. Подробности у вашего лечащего врача.
Показания:
Бесплодие более 1 года / идеопатическое бесплодие
Структурные нарушения сперматозоидов (тератозооспермия)
Противоопухолевое лечение в анамнезе (химиотерапия, лучевая терапия)
Планирование инсеминации
Отбор/исследование образцов спермы для банка спермы
Оценка эффекта лечения бесплодия
Выбор стратегии лечения варикоцеле (оперативное/консервативное)
Выбор стратегии для ВРТ (ИСМ, ЭКО, ИКСИ, ПИКСИ, донорская сперма)
Подготовка к циклам ЭКО
Неудачные попытки ЭКО/ИКСИ (2 неудачные попытки при удовлетворительном качестве эмбрионов)
Остановка развития эмбрионов
Неполноценное развитие бластоцист
Тератозооспермия (менее 4% морфологически-нормальных клеток)
Как готовиться к исследованию?
Подготовка к исследованию включает стандартный перечень требований, выполняемый перед подготовкой к спермограмме: половой покой 2-7 дней, воздержание от перегрева тела (баня, сауна), воздержание от тяжелых физических нагрузок.
Трактовка результатов ДНК-теста
На основании имеющихся данных допустимый уровень фрагментации ДНК сперматозоидов не должен превышать 30%. Пациентам с превышением указанных значений рекомендуется проведение терапии, включающей антиоксиданты, противовоспалительные препараты, микроэлементы. В случае отсутствия эффекта от лечения рекомендуется проведение процедур ВРТ.
Ограничения для проведения ДНК-теста
Низкая концентрация сперматозоидов (менее 5 млн/мл)
The TUNEL Assay | Протокол
Тест TUNEL чаще всего используется для обнаружения клеток, подвергающихся апоптозу, который является формой запрограммированной гибели клеток. Апоптоз — важный биологический процесс во время развития и для поддержания гомеостаза тканей. Окрашивание TUNEL позволяет визуализировать и количественно оценить апоптотические клетки. Это помогает ученым проверить эффективность новых методов лечения заболеваний, при которых апоптоз либо подавляется, как при раке, либо усиливается, как при нейродегенерации.
В этом видео рассказывается, как можно использовать анализ TUNEL для маркировки клеток, подвергающихся апоптозу, пошаговый протокол для выполнения этого метода на срезах тканей и как исследователи применяют этот метод для понимания механизмов гибели клеток.
Прежде чем углубляться в протокол анализа TUNEL, давайте обсудим принципы, лежащие в основе этого метода.
Одной из многих отличительных характеристик апоптоза является фрагментация ДНК. Как происходит фрагментация ДНК? Апоптоз осуществляется ферментами, называемыми каспазами, присутствующими в цитозоле.Их основная роль — расщеплять белки с целью разрушения клетки. Кроме того, каспазы активируют фермент, называемый ДНКазой, активируемой каспазой, или CAD, отделяя его от своего ингибитора — ICAD. Активированная CAD — это эндонуклеаза, которая перемещается в ядро и расщепляет хромосомную ДНК.
Расщепление ДНК в конечном итоге вызывает накопление фрагментов ДНК с разорванными концами, и анализ TUNEL флуоресцентно маркирует эти разорванные концы фрагментированной ДНК, что позволяет ученым обнаруживать апоптоз. Но как это происходит? Для этого вы должны понимать реакцию TUNEL.TUNEL обозначает опосредованное терминальной дезоксинуклеотидилтрансферазой мечение ник-конца dUTP. Двумя основными реагентами TUNEL являются терминальная дезоксинуклеотидилтрансфераза, или TdT, и дезоксиуридинтрифосфат, или dUTP, которые для простоты обнаружения могут быть помечены флуоресцентной меткой.
Чтобы понять реакцию TUNEL, вернемся к апоптотическим клеткам с фрагментами ДНК. Эти разорванные фрагменты имеют свободные 3′-гидроксильные группы. После добавления реагентов TUNEL к образцу, содержащему апоптотические клетки, флуоресцентно меченые dUTP присоединяются к этим 3′-гидроксильным группам с помощью фермента-катализатора TdT.Клетки, окрашенные с помощью этой процедуры, называются TUNEL-положительными клетками, которые затем можно визуализировать с помощью флуоресцентной микроскопии.
Теперь, когда вы понимаете основные принципы и концепции, лежащие в основе анализа TUNEL, давайте набросаем общий протокол для выполнения этой техники на срезах тканей. Основные этапы анализа TUNEL включают фиксацию интересующей ткани, повышение проницаемости ткани, добавление реагентов TUNEL, остановку реакции TUNEL и, наконец, анализ.
Сначала необходимо зафиксировать интересующую ткань, чтобы сохранить биологические структуры.Фиксация работает путем сшивания белков внутри клеток. Для анализа TUNEL ткани можно зафиксировать, добавив их к раствору, содержащему 4% параформальдегида, на 4–24 часа при 4 ° C. После фиксации сделайте криосекцию ткани на тонкие срезы размером 10 мкм или меньше.
Следующим шагом является пермеабилизация, которая позволяет таким реагентам, как фермент TdT, проникать в ядро клетки. Проницаемость срезов ткани можно выполнить, добавив ткань в раствор протеиназы К на 5–15 минут при 37 ° C.Промойте срезы тканей физиологическим раствором с фосфатным буфером на орбитальном шейкере в течение 15–30 минут при комнатной температуре.
После пермеабилизации фермент TdT и флуоресцентно меченые dUTP добавляются к срезам ткани вместе с буфером для мечения, содержащим кобальт, который действует как кофактор для реакции TUNEL. Вместе реакционную смесь TUNEL и срез ткани инкубируют в течение 1–3 часов при 37 ° C и защищают от света, чтобы флуоресценция не исчезла.
После инкубации стоп-буфер добавляется к срезу ткани, чтобы остановить реакцию TUNEL, и после непродолжительной инкубации срезы промываются физиологическим раствором с фосфатным буфером.Наконец, срезы ткани, окрашенные с использованием флуоресцентно меченого dUTP, визуализируются с помощью флуоресцентной микроскопии и оцениваются на предмет локализации TUNEL-положительных клеток в данной ткани. Можно количественно оценить гибель клеток, просто подсчитав процент TUNEL-положительных клеток в данном срезе ткани.
Теперь, когда вы узнали, как проводить анализ TUNEL для обнаружения апоптозных клеток, давайте обсудим, как этот анализ можно использовать для ответа на вопросы, задаваемые клеточными биологами.
Гибель клеток происходит как нормальная часть развития при формировании тканей и структур, а также при удалении ненужных клеток.Поэтому ученые, заинтересованные в этом явлении, изучают влияние пренатального воздействия различных веществ на апоптоз во время развития. Здесь ученые были заинтересованы в изучении влияния пренатального воздействия алкоголя на развитие мозга. Результаты окрашивания TUNEL, проведенного на мозге плода, выявили повышенный апоптоз в тканях, которые пренатально подвергались воздействию алкоголя, по сравнению с контрольными животными.
Ученые также используют тест TUNEL для исследования апоптоза в ответ на бактериальную инфекцию.В этом эксперименте ученые разработали модель пневмонии, введя мышам синегнойную палочку, которая вызывает воспаление легких. Затем легочную ткань удаляли и проводили окрашивание TUNEL для изучения апоптоза в ответ на бактериальную инфекцию. Результаты показывают, что гибель апоптотических клеток увеличивалась у мышей, подвергшихся воздействию бактерий, по сравнению с контрольными животными.
Наконец, окрашивание TUNEL можно использовать на образцах опухолей человека, чтобы определить чувствительность опухоли к лекарствам.В этом примере образцы опухолей были взяты у пациентов-людей и культивированы ex vivo. Затем их лечили доклиническими препаратами и оценивали реакцию с помощью анализа TUNEL. Полученные данные показывают, что лечение препаратом, который ингибирует белок теплового шока 90, значительно увеличивает апоптоз в опухолевой ткани.
Вы только что посмотрели видео JoVE об использовании теста TUNEL для обнаружения клеток, подвергающихся апоптозу. В этом видео были рассмотрены принципы окрашивания TUNEL и пошаговый протокол для выполнения анализа TUNEL на срезах тканей.Мы также рассмотрели, как этот метод можно применить для понимания запрограммированной гибели клеток во время развития и болезни. Как всегда, спасибо за просмотр!
Методы и наборы для окрашивания TUNEL
Изучите методы, используемые для окрашивания TUNEL (также известного как анализ TUNEL), и ознакомьтесь с наборами для окрашивания TUNEL.
Окрашивание
TUNEL (терминальная дезоксинуклеотидилтрансфераза dUTP для мечения ников), также называемое анализом TUNEL, обнаруживает разрывы ДНК, образующиеся при фрагментации ДНК на последней стадии апоптоза.
Содержание
Принципы окрашивания TUNEL / анализа TUNEL
Метод окрашивания TUNEL / анализа TUNEL основан на ферментной терминальной дезоксинуклеотидтрансферазе (TdT), которая присоединяет дезоксинуклеотиды к 3’-гидроксильным концам разрывов ДНК. TdT экспрессируется в определенных иммунных клетках и действует во время рекомбинации V (D) J — процесса, который генерирует разнообразие антител.
При окрашивании TUNEL нуклеотиды, присоединенные TdT, маркируются либо непосредственно флуоресцентной меткой, либо химической меткой, которая может быть косвенно связана либо с флуоресцентной меткой, либо с ферментом.
Окрашивание TUNEL — это современная альтернатива анализу образования фрагментов ДНК во время апоптоза с использованием электрофореза в агарозном геле, который используется в наборе для выделения лестницы апоптоза ДНК ab65627.
Методы анализа TUNEL
Окрашивание TUNEL / анализ TUNEL чаще всего анализируется с помощью световой микроскопии. Методы флуоресцентного окрашивания TUNEL / анализа TUNEL также подходят для анализа методом проточной цитометрии.
Наиболее часто используемые методы окрашивания TUNEL / анализ TUNEL используют
1) нуклеотид, непосредственно конъюгированный с флуоресцентным красителем (обычно FITC)
— См. Набор для анализа FITC TUNEL ab66108
2) меченные биотином нуклеотиды, которые являются затем связывается стрептавидин-HRP и детектируется с использованием хромогенного субстрата HRP, такого как DAB, для получения коричневого цвета
— см. набор для анализа HRP-DAB TUNEL ab206386
3) нуклеотид, меченный бромом, дигоксигенином или FITC, который затем связывается антителом, специфичным для этой метки.Антитело метят либо флуоресцентным красителем, либо ферментом, таким как HRP, для хромогенного обнаружения.
— См. Набор для анализа BrdU-Red TUNEL ab66110.
Gao Y et al. использовали набор для анализа HRP-DAB TUNEL ab206386 для анализа срезов тканей яичников мыши. а . Участок, обработанный ДНКазой I в качестве положительного контроля. б . Отрицательный контроль без фермента TdT. c и f . репрезентативные экспериментальные изображения.Ядра, окрашенные с помощью теста TUNEL, имеют коричневый цвет. Срезы контрастировали с метиловым зеленым.
Преимущества и недостатки методов окрашивания TUNEL
Протоколы окрашивания TUNEL / анализа TUNEL, в которых используется нуклеотид, непосредственно помеченный флуоресцентным красителем, быстрее, чем непрямые методы, в которых используются либо антитело, либо комплекс стрептавидин-биотин, поскольку для них требуется меньше окрашивание ступеней.
Методы, основанные на использовании нуклеотидов, меченных биотином, могут выиграть от амплификации комплекса стрептавидин-биотин.Они действительно требуют дополнительных блокирующих шагов для нейтрализации эндогенного биотина и уменьшения фонового окрашивания, хотя они являются общими для всех исследователей, использующих традиционную хромогенную иммуногистохимию.
Методы на основе BrdU также могут давать более яркий сигнал, поскольку BrdU обычно легче включается ферментом TdT.
Относительная популярность методов окрашивания TUNEL / анализа TUNEL
Обзор 50 научных работ, опубликованных в 2017 г., содержащих термин «анализ TUNEL» или «окрашивание TUNEL», показал, что:
— 50% статей использовали dUTP, непосредственно конъюгированный согласно FITC
— 15% использовали биотин-dUTP и стрептавидин-HRP
— 15% использовали FITC-dUTP и антитело против FITC, конъюгированное с HRP
— 12% использовали дигоксигенин-dUTP и конъюгированное антитело против дигоксигенина к флуоресцентному красителю или HRP
— 8% использовали Br-dUTP и антитело против BrdU, конъюгированное с флуоресцентным красителем
. Во всех исследованных работах для визуализации использовался анализ TUNEL, а не проточная цитометрия.Когда использовали HRP, добавляли субстрат DAB для создания коричневого пятна. Более чем в 90% исследовательских работ использовался набор для окрашивания TUNEL.
% PDF-1.4
%
109 0 объект
>
эндобдж
xref
109 87
0000000016 00000 н.
0000002604 00000 н.
0000002905 00000 н.
0000002932 00000 н.
0000002982 00000 н.
0000003017 00000 н.
0000003516 00000 н.
0000003623 00000 н.
0000003730 00000 н.
0000003837 00000 н.
0000003944 00000 н.
0000004051 00000 н.
0000004185 00000 н.
0000004265 00000 н.
0000004344 00000 п.
0000004424 00000 н.
0000004503 00000 н.
0000004582 00000 н.
0000004661 00000 н.
0000004739 00000 н.
0000004818 00000 н.
0000004897 00000 н.
0000004975 00000 н.
0000005054 00000 н.
0000005133 00000 п.
0000005211 00000 н.
0000005290 00000 н.
0000005369 00000 н.
0000005447 00000 н.
0000005525 00000 н.
0000005602 00000 н.
0000005682 00000 н.
0000006142 00000 п.
0000006638 00000 н.
0000007396 00000 н.
0000007881 00000 н.
0000008147 00000 н.
0000008547 00000 н.
0000008623 00000 п.
0000008660 00000 н.
0000009415 00000 н.
0000009598 00000 п.
0000010067 00000 п.
0000010160 00000 п.
0000010519 00000 п.
0000011043 00000 п.
0000011286 00000 п.
0000011964 00000 п.
0000012669 00000 п.
0000013434 00000 п.
0000013601 00000 п.
0000014309 00000 п.
0000015012 00000 п.
0000015777 00000 п.
0000016159 00000 п.
0000016871 00000 п.
0000017525 00000 п.
0000020196 00000 п.
0000028535 00000 п.
0000035229 00000 п.
0000039188 00000 п.
0000041674 00000 п.
0000046262 00000 п.
0000046532 00000 п.
0000046752 00000 п.
0000047039 00000 п.
0000047097 00000 п.
0000047155 00000 п.
0000047323 00000 п.
0000047459 00000 п.
0000047495 00000 п.
0000047585 00000 п.
0000047693 00000 п.
0000047797 00000 п.
0000047897 00000 н.
0000048031 00000 п.
0000048133 00000 п.
0000048261 00000 п.
0000048391 00000 п.
0000048506 00000 п.
0000048605 00000 п.
0000048704 00000 п.
0000048832 00000 н.
0000048965 00000 н.
0000049080 00000 п.
0000049269 00000 п.
0000002036 00000 н.
трейлер
] >>
startxref
0
%% EOF
195 0 объект
> поток
xb«b`Td`c`]
TUNEL оценка повреждений ДНК сперматозоидов
Исследование клиники Кливленда сообщает о стандартизованных результатах анализа TUNEL (терминальное мечение концов дезоксинуклеотидилтрансферазы dUTP) для оценки повреждения ДНК сперматозоидов.Этот анализ измеряет наличие свободных 3′-гидроксильных групп, указывающих на фрагментацию цепи ДНК. Повреждение ДНК сперматозоидов является маркером исхода как для спонтанной беременности, так и для методов вспомогательной репродукции, и как таковое является важным клиническим параметром для мужчин, проходящих оценку фертильности. Однако на сегодняшний день пороговые значения для TUNEL не так широко установлены, как для альтернативного теста на повреждение ДНК, более технически сложного анализа структуры хроматина сперматозоидов. Настоящее исследование было направлено на устранение этого недостатка.
В исследование были включены 194 мужчины, обращавшиеся за медицинской помощью по поводу бесплодия по разным причинам, и 25 контрольных мужчин с нормальными результатами анализа спермы и доказанной или недоказанной фертильностью. Фрагментацию ДНК сперматозоидов оценивали с помощью анализа TUNEL (набор Apo-Direct; Pharmingen, San Diego, CA) с последующим анализом проточной цитометрии.
Пороговое значение фрагментации 19,25% максимизировало чувствительность и специфичность анализа (65% и 100% соответственно), при этом все контроли имели уровни повреждения ДНК ниже этой точки.В таком тесте важна высокая специфичность, поскольку основная цель — избежать ложноположительных результатов у здоровых мужчин и окончательно выявить мужчин, которые способствуют проблеме фертильности пары. В целом, пациенты имели более высокий уровень повреждения ДНК, чем контрольная группа (29,5% против 11,9%; P <0,001). Вариабельность между наблюдателем и исследователем и внутри них была низкой - обычно менее 10%.
«Этот тест можно эффективно использовать для установления целостности ДНК сперматозоидов», — говорит Ашок Агарвал, директор лаборатории андрологии клиники Кливленд, руководивший исследованием.«Его можно предложить группе избранных пациентов с идиопатическим бесплодием или когда тяжелый оксидативный стресс может отрицательно сказаться на качестве спермы». Эти эталонные значения могут быть использованы и адаптированы другими центрами, а тест TUNEL может быть предложен любым учреждением, имеющим доступ к проточной цитометрии, прежде чем будут рассмотрены другие, более дорогие методы вспомогательной репродукции.
Анализ TUNEL основан на предположении, что возрастающий уровень фрагментации ДНК сам по себе является патологическим, и не дает информации о конкретных генах, на которые может повлиять этот процесс.В будущем точная настройка теста может помочь лучше идентифицировать и охарактеризовать измеряемое им повреждение ДНК. В этом отношении могут помочь дополнительные шаги по деконденсации сильно уплотненной ДНК сперматозоидов и по различению жизнеспособных сперматозоидов от нежизнеспособных.
Об этой статье
Цитируйте эту статью
Groves-Kirkby, N. TUNEL оценка повреждения ДНК сперматозоидов.
Нат Рев Урол 7, 421 (2010). https: // doi.org / 10.1038 / nrurol.2010.109
Ссылка для скачивания
Обнаружение апоптоза с помощью анализа TUNEL
На клеточном уровне всегда существует гомеостаз между делением клеток и их гибелью. Процесс роста и развития предполагает активный баланс обоих этих механизмов. Смерть клеток происходит через три различных механизма в зависимости от молекулярного сигнала: апоптоз, некроз и аутофагия. Все эти процессы имеют определенные морфологические и биохимические признаки, которые помогают их идентифицировать с помощью различных методов.Кроме того, эти процессы имеют решающее значение в нормальном клеточном состоянии, в то время как повышенная или пониженная скорость этих процессов приводит к патологическим состояниям. Аутофагия включает внутриклеточную деградацию белка и является важным аспектом клеточного голодания, старения и дифференцировки. Апоптоз также известен как запрограммированная смерть клеток, когда строго контролируемое событие заставляет апоптозные тела способствовать гибели клеток. Некроз приводит к высвобождению клеточных компонентов во внеклеточное пространство после разрушения клетки.
Характерные морфологические и биохимические признаки апоптоза:
- Конденсация хроматина и усадка ячеек
- Образование апоптотических телец (образование мембраносвязанных фрагментов клеток)
- Деградация ДНК эндонуклеазами
Обработка образцов на агарозном геле дает приблизительное представление о гибели клеток по коротким или длинным фрагментам ДНК. Однако он не может предоставить пространственную информацию о фрагментации ДНК в ткани или популяции отдельных клеток.
Терминальная дезоксинуклеотидилтрансфераза (TdT) Мечение ник-конца dUTP (TUNEL) — наиболее распространенный метод, используемый для анализа локализации фрагментации ДНК, вызванной гибелью клеток. Апоптоз, отмеченный активацией нуклеаз и фрагментацией ДНК, приводит к образованию многих открытых концов 3′-гидроксила (ОН) ДНК, которые облегчают концевое мечение этих фрагментов с использованием флуорофоров. Степень флуоресценции можно определить с помощью флуоресцентной микроскопии или проточной цитометрии. Этот метод использует идентификацию открытых тупых концов двухцепочечной ДНК независимым от матрицы способом.Фермент TdT, используемый в этом методе, позволяет добавлять меченые dUTP на 3′-ОН-конце фрагментированной ДНК. Эти меченые фрагменты можно идентифицировать in-situ с помощью иммуногистохимических методов.
Эффективность включения модифицированного dUTP определяет чувствительность анализа TUNEL, на которую в целом влияет относительная громоздкость этикеток.
Существует множество меток, которые TdT может прикреплять к фрагментам ДНК, например
- ДУТФ с флуоресцентной меткой — анализ FITC TUNEL
- биотинилированные dUTP
- DIG или дигоксигенилированные dUTP
Однако эти метки громоздкие и создают множество стерических затруднений, что снижает чувствительность анализа.Напротив, более мелкие метки, такие как бром (BrdUTP) или группа алкинов (EdUTP), имеют более высокую чувствительность из-за меньших стерических затруднений. BrdUTP может быть обнаружен с помощью флуорофоров или антител, меченных репортерным ферментом, а обнаружение EdUTP достигается с помощью щелочной химии алкина-азидов.
Анализ
TUNEL состоит из трех простых этапов обработки:
- ПОДГОТОВКА ОБРАЗЦА: Анализ TUNEL можно проводить с любым типом образца (срезы тканей, суспензии клеток, линии клеток.Важно зафиксировать образец подходящим фиксатором (1-4% параформальдегида) и пропустить через метанол или Твин-20. Образцы можно хранить при –20 ° C для дальнейшего использования или сразу перейти к следующему этапу.
- Окрашивание TUNEL: Для окрашивания необходимы положительный и отрицательный контроли вместе с образцами тестируемых клеток. Все образцы подвергаются инкубации со смесью ферментов TdT в течение определенного интервала времени с последующей маркировкой смесью антител. Флуорохромы ДНК, такие как йодид пропидия, используются для фоновой маркировки ядер.
- АНАЛИЗ: Результаты можно наблюдать с помощью проточной цитометрии (суспензия клеток), световой или флуоресцентной микроскопии (прилипшие клетки или срезы ткани) в зависимости от типа мечения.
TUNEL assay — очень простой и удобный метод для выполнения, хотя он имеет несколько предостережений, которые необходимо учитывать при проведении экспериментов.
- Поскольку фрагментация ДНК может быть результатом различных ситуаций, таких как некроз, чрезмерная фиксация, длительное лечение протеиназой К, деление клеток и срезы тканей.Следовательно, необходимо установить базовый уровень или порог для каждого теста и контрольных образцов.
- Многие типы клеток требуют инкубации в 70% (об. / Об.) Этаноле в течение ночи при –20 ° C после фиксации для хорошей эффективности включения.
- Пути апоптоза различаются от клетки к клетке, поэтому анализ TUNEL требует дальнейшего подтверждения классическими морфологическими оценками, такими как использование флуорохрома ДНК для подтверждения апоптотических телец.
- Сигнал и результаты анализа TUNEL варьируются от образца к образцу, поэтому он требует оптимизации, особенно на двух этапах: фиксация параформальдегида и расщепление протеиназой К.Чрезмерная фиксация и чрезмерное переваривание протеиназой К приводит к снижению сигнала в положительных контролях и тестируемых образцах.
Тест TUNEL — это чувствительный и простой инструмент для выявления апоптотических клеток на ранней стадии и полезный подход для дальнейшего изучения патогенеза заболевания и физиологических механизмов.
Click-iT TUNEL Протокол анализа изображений с помощью флуоресцентного изображения Alexa | Thermo Fisher Scientific
Связанная информация о продукте
С момента появления в 1992 г. анализа терминальной дезоксинуклеотидилтрансферазы-dUTP для мечения ников (TUNEL), 1 анализ TUNEL является наиболее широко используемым тестом in situ для исследования апоптоза. 2 TUNEL анализ основан на включении модифицированных dUTP с помощью ферментной терминальной дезоксинуклеотидилтрансферазы (TdT) на 3’-OH концах фрагментированной ДНК, что является отличительным признаком, а также решающим фактором апоптоза. Модификации представляют собой гаптены флуорофоров, включая биотин или бром, которые могут быть обнаружены непосредственно в случае флуоресцентно-модифицированного нуклеотида (т.е. флуоресцеин-dUTP) или косвенно со стрептавидином или антителами, если используются биотин-dUTP или BrdUTP, соответственно.Часто на поздних стадиях апоптоза прилипшие клетки отслаиваются или «отрываются». Для надежного и воспроизводимого анализа изображений TUNEL модифицированный нуклеотид должен быть не только приемлемым субстратом для TdT, но и метод обнаружения должен быть чувствительным, не вызывая дополнительной потери клеток из образца. Это руководство включает протоколы для выполнения анализа изображений Invitrogen Click-iT TUNEL на прикрепленных клетках, выращенных на покровных стеклах (см. Экспериментальный протокол для клеток, выращенных на покровных стеклах) или 96-луночном микропланшете (см. Экспериментальный протокол для клеток, выращенных в 96-луночном стекле). Пластина).
Обзор системы
В тестах изображений Invitrogen Click-iT TUNEL Alexa Fluor используется dUTP, модифицированный алкином, небольшой биоортогональной функциональной группой, которая позволяет нуклеотиду легче встраиваться в TdT, чем другие модифицированные нуклеотиды ( Рисунки 1–2). Обнаружение основано на реакции щелчка, 3-6 катализируемой медью (I) реакции между азидом и алкином (рис. 3). Химия щелчков заполняет пустоту, когда такие методы, как прямое мечение или использование антител, неэффективны.Небольшой размер фтор азида Invitrogen Alexa (молекулярная масса ~ 1000) по сравнению с размером антитела (молекулярная масса ~ 150000) позволяет без усилий проникать в сложные образцы с минимальной фиксацией и необходимостью проницаемости. В результате, по сравнению с анализами с использованием других модифицированных нуклеотидов, анализ изображений Click-iT TUNEL является быстрым (завершается в течение 2 часов) и способен обнаруживать более высокий процент апоптозных клеток в идентичных условиях (рисунки 4–5). Кроме того, анализ Click-iT TUNEL позволяет объединить результаты с обнаружением поверхностных и внутриклеточных биомаркеров.(Таблица 1).
Анализ изображений Click-iT TUNEL Alexa Fluor был протестирован на клетках HeLa, A549 и CHO K1 с использованием различных реагентов, вызывающих апоптоз, включая стауроспорин (рис. 6). Тест Click-iT TUNEL Alexa Fluor для визуализации содержит все компоненты, необходимые для точного и надежного обнаружения апоптоза на прилипших клетках, выращенных на покровных стеклах или 96-луночном микропланшете, и включает ДНКазу I для создания разрывов цепей в качестве положительного контроля.
Рисунок 1.Модифицированные нуклеотидные структуры. Модификации алкина и брома значительно меньше флуоресцеина.
Рис. 2. Сравнение включения нескольких модифицированных нуклеотидов в TdT. Олигонуклеотид длиной 48 пар оснований инкубировали с 30 единицами TdT и эквимолярной смесью модифицированного нуклеотида с тремя другими нуклеотидами в течение 4 часов при комнатной температуре. Затем продукты реакции TdT анализировали с помощью гель-электрофореза после нанесения на предварительно отлитый гель с 20% TBE и затем окрашивали красителем на основе нуклеиновой кислоты Invitrogen SYBR Gold.
Рис. 3. Обнаружение апоптоза с помощью анализа изображений Click-iT® TUNEL.
| Рис. 4. Сравнение анализа TUNEL — обнаруженный процент положительных результатов. Клетки HeLa обрабатывали 0,5 мкМ стауроспорином в течение 4 часов. После фиксации и пермеабилизации были выполнены визуализационные тесты TUNEL в соответствии с инструкциями производителя.Процент положительных результатов был рассчитан на основе соответствующего отрицательного контроля. Визуализацию и анализ выполняли с использованием Thermo Fisher Scientific Cellomics ArrayScan II. |
| Рис. 5. Сравнение времени анализа TUNEL — процент обнаруженных положительных результатов . Клетки HeLa обрабатывали 0,5 мкМ стауроспорина в указанные моменты времени. После фиксации и пермеабилизации были выполнены методы визуализации Click-iT TUNEL с использованием Click-iT EdUTP или флуоресцеина dUTP (система Promega’s DeadEnd Fluorometric TUNEL) в соответствии с инструкциями производителя.Процент положительных результатов был рассчитан на основе соответствующего отрицательного контроля. Визуализацию и анализ выполняли с использованием Thermo Fisher Scientific Cellomics ArrayScan II. |
| Рис. 6. Дозовая реакция стауроспорина с использованием метода визуализации Click-iT TUNEL Alexa Fluor 488. Клетки HeLa обрабатывали стауроспорином в течение 18 часов при конечных концентрациях от 1 нМ до 1 мкМ.После фиксации и стабилизации был проведен анализ изображений Click-iT TUNEL. Точки данных представляют собой средние значения для 8 лунок, полосы ошибок показывают стандартные отклонения. |
Таблица 1. Совместимость реагентов для обнаружения Click-iT.
| Молекула | Совместимость * |
|---|---|
| Нанокристаллы Qdot | Используйте нанокристаллы Invitrogen Qdot после реакции обнаружения Click-iT. |
| Флуоресцентные белки | Используйте реагенты Invitrogen на основе органических красителей, такие как реагенты TC-FlAsH или TC-ReAsH, для определения экспрессии белка или кроличьи или куриные антитела против GFP после реакции обнаружения Click-iT. |
| Фаллоидин | Click несовместима с окрашиванием F-актина фаллоидином. Для окрашивания цитоскелета рекомендуются антитела, такие как анти-тубулин, после реакции обнаружения Click-iT. |
| Органические красители, такие как красители Alexa Fluor или флуоресцеинизотиоцианат (FITC) | Полностью совместим с реакцией обнаружения Click-iT. |
| Реагенты TC-FlAsH или TC-ReAsH | Обнаружьте метку тетрацистеина (TC) с помощью реагентов FlAsH или ReAsH перед реакцией обнаружения Click-iT. |
* Некоторые молекулы или методы обнаружения включают компоненты, которые нестабильны в присутствии медного катализатора, используемого для реакции обнаружения Click-iT.
Таблица 2. Содержание и информация о хранении.
| Материал | Сумма | Концентрация | Хранение * | Стабильность |
|---|---|---|---|---|
| Реакционный буфер TdT (компонент A) | 11 мл | Решение 1X |
| При хранении по назначению компоненты набора стабильны не менее 1 год. |
| Смесь нуклеотидов EdUTP (Компонент B) | 100 мкл | Решение 50X | ||
| TdT (терминальная дезоксинуклеотидил трансфераза) * рекомбинантный * (компонент C) | 6 ампул | Каждый флакон содержит 34 мкл фермента 15 Ед / мкл в глицерине | ||
| Буфер реакции Click-iT (компонент D) | 25 мл | 1X решение (содержит азид Alexa Fluor 488 для кат.№ C10245, Alexa Fluor 594 азид для кат. № C10246, Alexa Азид Fluor 647 для кат. № C10247) | ||
| Добавка реакционного буфера Click-iT (компонент E) | 50 мг | Не применимо | ||
| Hoechst 33342 (компонент F) | 18 мкл | раствор в воде 10 мг / мл | ||
| ДНКаза I (дезоксирибонуклеаза I, компонент G) | 18 мкл | Не применимо | ||
| Буфер ДНКазы I (компонент H) | 190 мкл | Решение 10X |
* Эти условия хранения подходят для хранения всего набора при получении.Для оптимального хранения каждого компонента см. Этикетки на отдельных компонентах.
Количество анализов: Обеспечивается достаточное количество материала для 1 × 96-луночного планшета или 50 покровных стекол в соответствии с протоколами, приведенными ниже.
Приблизительные максимумы возбуждения / испускания флуоресценции:
- Азид Invitrogen Alexa Fluor 488: 495/519 в нм
- Invitrogen Alexa Fluor 594 азид: 590/615 нм
- Invitrogen Alexa Fluor 647 азид: 650/670 нм
- Hoechst 33342: 350/461 в нм при связывании с ДНК.
Необходимые, но не поставляемые материалы
- 1X физиологический раствор с фосфатным буфером (PBS, Кат. № 14190-144 или 14190-250)
- 4% параформальдегид в PBS (фиксатор)
- 0,25% Invitrogen Triton X-100 в PBS (реагент для повышения проницаемости)
- 3% бычий сывороточный альбумин в PBS (3% BSA в PBS), pH 7,4
- Вода для молекулярной биологии (без ДНКаз / РНКаз)
- 96-луночный планшет (в соответствии с рекомендациями для конкретного прибора для автоматической визуализации)
- покровные стекла 22 × 22 мм или 18 × 18 мм (для стандартной микроскопии)
Осторожно
Буфер для реакции TdT (компонент A) содержит какодилат калия и хлорид кобальта и является вредным при проглатывании.В случае попадания в глаза немедленно промыть большим количеством воды и обратиться к врачу. При проглатывании немедленно обратиться к врачу. При работе с этим реагентом надевайте соответствующую лабораторную защитную одежду, перчатки и средства защиты глаз / лица.
Hoechst 33342 (компонент F) — известный мутаген. Используйте краситель с соответствующими мерами предосторожности.
10533073,10533065,141
,141
,18068015, h2399, h4570, h31492, C10245, C10246, C10247
Протокол для ячеек на покровных стеклах
Следующий протокол был разработан с использованием клеток HeLa, обработанных 0.5 мкМ стауроспорина в течение 4 часов, чтобы вызвать апоптоз. Тип клеток и лечение могут влиять на количество обнаруженных апоптотических клеток.
1. Фиксация клеток и пермеабилизация
Этот протокол оптимизирован с помощью этапа фиксации с использованием 4% параформальдегида в PBS, за которым следует этап пермеабилизации с 0,25% Triton X-100, но он поддается другим реагентам фиксации и проницаемости, таким как 70 % спирт этиловый.
- Удалите среду и один раз промойте покровные стекла PBS. Примечание: Если существует вероятность потери клеток на этом этапе промывки, переходите непосредственно к фиксации (этап 2), не выполняя этап промывки.
- Добавьте достаточный объем фиксатора (4% параформальдегида), чтобы полностью покрыть покровные стекла.
- Инкубируйте образцы в течение 15 минут при комнатной температуре.
- Удалить фиксатор.
- Добавьте достаточный объем реагента для повышения проницаемости (0,25% Triton X-100 в PBS), чтобы полностью покрыть покровные стекла.
- Инкубируйте образцы в течение 20 минут при комнатной температуре. Затем дважды промойте деионизированной водой.
2.Подготовка положительного контроля (необязательно)
ДНКаза I генерирует разрывы цепи в ДНК, обеспечивая положительную реакцию TUNEL. ДНКазы I достаточно для выполнения ~ 18 положительных контролей.
- Вымойте покровные стекла деионизированной водой или водой, пригодной для молекулярной биологии.
- Приготовьте раствор ДНКазы I в соответствии с таблицей 3 и хорошо перемешайте. Примечание. Не перемешивайте раствор ДНКазы I на вортексе, поскольку ДНКаза I денатурирует при интенсивном перемешивании.
- Добавьте 100 мкл раствора ДНКазы I (приготовленного на шаге 2) в каждое покровное стекло и инкубируйте 30 минут при комнатной температуре.
- Промыть покровные стекла один раз деионизированной водой, перейти к реакции TdT.
Таблица 3.Решение DNase I.
| Компоненты реакции | Количество покровных стекол | ||
|---|---|---|---|
| 1 | 2 | 3 | |
| Деионизированная вода | 89 мкл | 178 мкл | 267 мкл |
| Буфер ДНКазы I (компонент H) | 10 мкл | 20 мкл | 30 мкл |
| DNase I (компонент G) | 1 мкл | 2 мкл | 3 мкл |
| Общий объем | 100 мкл | 200 мкл | 300 мкл |
3. Реакция TdT
В этом протоколе используется 100 мкл реакционной смеси TdT на покровное стекло. Важно уравновесить клетки, чтобы максимизировать эффективность реакции TdT.
- Добавьте 100 мкл реакционного буфера TdT (компонент A) в каждое покровное стекло и дайте раствору полностью растекаться по поверхности.
- Инкубируйте покровные стекла в течение 10 минут при комнатной температуре.
- Удалите реакционный буфер TdT.
- Приготовьте реакционный коктейль TdT в соответствии с таблицей 4.
- Добавьте 100 мкл реакционной смеси TdT (приготовленной на шаге 4) в каждое покровное стекло и дайте раствору полностью распределиться по поверхности.
- Инкубируйте покровные стекла в течение 60 минут при 37 ° C. Используйте увлажненную камеру для защиты от испарения. Удалите реакционный коктейль. Примечание. Эту реакцию можно проводить в течение ночи при комнатной температуре.
- Вымойте покровные стекла дважды 3% BSA в PBS в течение 2 минут каждое.
Таблица 4. Реакционные коктейли TdT.
| Компоненты реакции | Количество покровных стекол | ||||
|---|---|---|---|---|---|
| 1 | 2 | 4 | 5 | 10 | |
| Реакционный буфер TdT (компонент A) | 94 мкл | 188 мкл | 376 мкл | 470 мкл | 940 мкл |
| EdUTP (компонент B) | 2 мкл | 4 мкл | 8 мкл | 10 мкл | 20 мкл |
| TdT * (компонент C) | 4 мкл | 8 мкл | 16 мкл | 20 мкл | 40 мкл |
| Общий объем | 100 мкл | 200 мкл | 400 мкл | 500 мкл | 1 мл |
4. Реакция Click-iT
- Приготовьте буферную добавку для реакции Click-iT (компонент E), добавив 625 мкл деионизированной воды во флакон с компонентом E.После использования сделайте аликвоту и храните оставшийся раствор при = –20 ° C. При хранении по назначению основной раствор стабилен до 1 года.
- Приготовьте реакционный коктейль Click-iT в соответствии с таблицей 5 и хорошо перемешайте встряхиванием. Примечание. Используйте реакционный коктейль Click-iT в течение 15 минут после приготовления.
- Немедленно добавьте 100 мкл реакционной смеси Click-iT (приготовленной на шаге 2) в каждое покровное стекло и дайте раствору полностью распределиться по поверхности.
- Инкубируйте покровные стекла в течение 30 минут при комнатной температуре в защищенном от света месте.
- Удалите реакционный коктейль Click-iT и промойте каждое покровное стекло 3% BSA в 1X PBS в течение 5 минут.
- Для окрашивания антител перейдите к разделу 5 или для окрашивания ДНК перейдите к разделу 6. Если дополнительное окрашивание не требуется, перейдите к разделу «Визуализация и анализ».
Таблица 5. Реакционные коктейли Click-iT.
| Компоненты реакции | Количество покровных стекол | ||||
|---|---|---|---|---|---|
| 1 | 2 | 4 | 5 | 10 | |
| Буфер реакции Click-iT (компонент D) | 97,5 мкл | 195 мкл | 390 мкл | 487.5 мкл | 975 мкл |
| Добавка реакционного буфера Click-iT (приготовленная на этапе 4.2) | 2,5 мкл | 5 мкл | 10 мкл | 12,5 мкл | 25 мкл |
| Общий объем | 100 мкл | 200 мкл | 400 мкл | 500 мкл | 1 мл |
5. Обнаружение антител (необязательно)
- При необходимости закройте покровные стекла или лунки 3% BSA в 1X PBS в течение рекомендованного времени в защищенном от света месте.Удалите блокирующий раствор.
- Приготовьте и добавьте раствор первичных антител в соответствии с рекомендациями производителя.
- Инкубируйте в течение рекомендованного времени и при температуре в защищенном от света месте. Удалите раствор первичных антител.
- Вымойте каждое покровное стекло или лунку дважды 3% BSA в PBS. Удалите промывочный раствор.
- Приготовьте и добавьте раствор вторичных антител в соответствии с рекомендациями производителя.
- Инкубируйте в течение рекомендованного времени и при температуре в защищенном от света месте.Удалите вторичный раствор антител.
- Вымойте каждое покровное стекло или лунку дважды 3% BSA в PBS. Удалите промывочный раствор.
Для окрашивания ДНК перейдите к разделу 6. Если дополнительное окрашивание не требуется, перейдите к разделу «Визуализация и анализ».
6. Окрашивание ДНК
- Разведите Hoechst 33342 (компонент F) 1: 5000 в PBS, чтобы получить 1X раствор Hoechst 33342.
- Добавьте 100 мкл раствора 1X Hoechst 33342 на покровное стекло или лунку и инкубируйте 15 минут при комнатной температуре в защищенном от света месте.Удалите раствор Hoechst 33342.
- Вымойте каждое покровное стекло или лунку дважды с помощью PBS. Удалите промывочный раствор.
Визуализация и анализ
Клетки, окрашенные Click-iT TUNEL, совместимы со всеми методами подготовки слайдов, включая влажную основу или подготовленную среду для фиксации. В таблице 6 приведены приблизительные максимумы возбуждения / испускания флуоресценции красителей Alexa Fluor и Hoechst 33342, связанных с ДНК.
Таблица 6. Приблизительные максимумы возбуждения / испускания флуоресценции.
| Флуорофор | Возбуждение (нм) | Излучение (нм) |
| Алекса Флуор 488 | 495 | 519 |
| Алекса Флуор 594 | 590 | 615 |
| Алекса Флуор 647 | 650 | 670 |
| Hoechst 33342 связан с ДНК | 350 | 460 |
Протокол для клеток в 96-луночных планшетах
Следующий протокол был разработан с использованием клеток HeLa, обработанных 0.5 мкМ стауроспорина в течение 4 часов, чтобы вызвать апоптоз. Тип клеток и лечение могут влиять на количество обнаруженных апоптотических клеток.
7. Фиксация клеток и пермеабилизация
Этот протокол оптимизирован с помощью этапа фиксации с использованием 4% параформальдегида в PBS, за которым следует этап пермеабилизации с 0,25% Triton X-100, но его можно использовать с другими реагентами для фиксации и повышения проницаемости, такими как 70 % спирт этиловый.
- Удалите среду и промойте лунки один раз PBS. Примечание. Если существует вероятность потери клеток на этом этапе промывки, переходите непосредственно к фиксации (этап 2), не выполняя этап промывки.
- Добавьте 100 мкл фиксатора (4% параформальдегида), чтобы полностью покрыть каждую лунку.
- Инкубируйте планшеты в течение 15 минут при комнатной температуре.
- Удалить фиксатор.
- Добавьте 100 мкл реагента для повышения проницаемости (0,25% Triton X-100 в PBS), чтобы полностью покрыть каждую лунку.
- Инкубируйте планшеты в течение 20 минут при комнатной температуре.
- Дважды промыть деионизированной водой.
8.Подготовка положительного контроля (необязательно)
ДНКаза I генерирует разрывы цепи в ДНК, обеспечивая положительную реакцию TUNEL. ДНКазы I достаточно для выполнения ~ 18 положительных контролей.
- Вымойте лунки деионизированной водой или водой, пригодной для молекулярной биологии.
- Приготовьте раствор ДНКазы I в соответствии с таблицей 7 и хорошо перемешайте. Примечание. Не перемешивайте раствор ДНКазы I на вортексе, поскольку ДНКаза I денатурирует при интенсивном перемешивании.
- Добавьте 100 мкл раствора ДНКазы I (приготовленного на шаге 2) в каждое покровное стекло и инкубируйте 30 минут при комнатной температуре.
- Промыть покровные стекла один раз деионизированной водой, перейти к реакции TdT.
Таблица 7.Решение DNase I.
| Компоненты реакции | Кол-во скважин | ||||
|---|---|---|---|---|---|
| 1 | 2 | 4 | 5 | 8 | |
| Деионизированная вода | 89 мкл | 178 мкл | 356 мкл | 445 мкл | 712 мкл |
| Буфер ДНКазы I (компонент H) | 10 мкл | 20 мкл | 40 мкл | 50 мкл | 80 мкл |
| DNase I (компонент G) | 1 мкл | 2 мкл | 4 мкл | 5 мкл | 8 мкл |
| Общий объем | 100 мкл | 200 мкл | 400 мкл | 500 мкл | 800 мкл |
9. Реакция TdT
В этом протоколе используется 50 мкл реакционной смеси TdT на лунку. Важно уравновесить клетки, чтобы максимизировать эффективность реакции TdT.
- Добавьте 50 мкл реакционного буфера TdT (компонент A) в каждую лунку и дайте раствору полностью растекаться по поверхности.
- Инкубируйте планшеты в течение 10 минут при комнатной температуре.
- Удалите реакционный буфер TdT.
- Приготовьте реакционный коктейль TdT в соответствии с таблицей 8.
- Добавьте 50 мкл реакционной смеси TdT (приготовленной на шаге 4) в каждую лунку и дайте раствору полностью растекаться по лунке.
- Инкубируйте планшеты в течение 60 минут при 37 ° C. Удалите реакционный коктейль.
- Дважды промойте лунки 3% BSA в PBS по 2 минуты каждая.
Таблица 8. Реакционные коктейли TdT.
| Компоненты реакции | Кол-во скважин | ||||
|---|---|---|---|---|---|
| 1 | 8 | 12 | 100 | ||
| Реакционный буфер TdT (компонент A) | 47 мкл | 376 мкл | 564 мкл | 4.7 мл | |
| EdUTP (компонент B) | 1 мкл | 8 мкл | 12 мкл | 100 мкл | |
| TdT * (компонент C) | 2 мкл | 16 мкл | 24 мкл | 200 мкл | |
| Общий объем | 50 мкл | 400 мкл | 600 мкл | 5 мл | |
10. Реакция Click-iT
- Приготовьте буферную добавку для реакции Click-iT (компонент E), добавив 625 мкл деионизированной воды во флакон с компонентом E. После использования сделайте аликвоту и храните оставшийся раствор при = –20 ° C. При хранении по назначению основной раствор стабилен до 1 года.
- Приготовьте реакционный коктейль Click-iT в соответствии с таблицей 9 и хорошо перемешайте встряхиванием. Примечание. Используйте реакционный коктейль Click-iT в течение 15 минут после приготовления.
- Немедленно добавьте 50 мкл реакционной смеси Invitrogen Click-iT (приготовленной на шаге 10.2) в каждую лунку и дайте раствору полностью растекаться по поверхности.
- Инкубируйте планшеты в течение 30 минут при комнатной температуре в защищенном от света месте. Удалить реакционный коктейль
- Вымойте каждое покровное стекло 3% BSA в 1X PBS в течение 5 минут.
- Дополнительно: окрашивание антителами (раздел 5) или другими красителями, такими как окрашивание ДНК для окрашивания ядер с помощью Hoechst 33342 (раздел 6).
- Пластина для изображения с использованием фильтров, подходящих для красителя Alexa Fluor, включенного в анализ изображений Click-iT TUNEL (таблица 6), и любых других используемых флуорофоров.
Таблица 9. Реакционные коктейли Click-iT.
| Компоненты реакции | Количество покровных стекол | ||||
|---|---|---|---|---|---|
| 1 | 8 | 12 | 100 | ||
| Буфер реакции Click-iT (компонент D) | 97.5 мкл | 780 мкл | 1,17 мл | 9,75 мл | |
| Добавка реакционного буфера Click-iT (приготовленная на этапе 10.1) | 2,5 мкл | 20 мкл | 30 мкл | 250 мкл | |
| Общий объем | 100 мкл | 800 мкл | 1,2 мл | 10 мл | |
1. J. Cell Biol. 119, 493 (1992).
2. J Surg Res 139, 143 (2007)
3. ChemBioChem 4, 1147 (2003)
4. J Am Chem Soc 125, 3192 (2003)
5. Angew Chem Int Ed Engl 41, 2596 (2002)
6. Angew Chem Int Ed Engl 40, 2004 (2001).
MP10245 14 ноября 2008 г.
нуклеотидов для применения в апоптозе (анализ TUNEL)
Апоптоз — это процесс программы внутриклеточной смерти, ведущий к характерным биохимическим и морфологическим изменениям внутри клетки, которые, как следствие, приводят к гибели клетки [1] . Неспособность клеток подвергнуться апоптозу является общей чертой многих видов рака [2], поэтому исследование механизмов, индуцирующих апоптоз, имеет особое значение для исследований рака и требует подходящих методов обнаружения.
Отличительной чертой позднего апоптоза является обширная фрагментация геномной ДНК, которая генерирует множество двухцепочечных разрывов ДНК (DSB) с доступными 3′-гидроксильными (3′-OH) группами. Эта характеристика лежит в основе хорошо зарекомендовавшего себя метода обнаружения апоптоза : T Эрминальная дезоксинуклеотидилтрансфераза d U TP N ick E nd L abeling (TUNEL) assay .
TUNEL-анализы идентифицируют апоптотические клетки по опосредованному терминальной дезоксинуклеотидилтрансферазой (TdT) добавлению меченых (X) дезоксиуридинтрифосфатных нуклеотидов (X-dUTP) к 3′-OH-концу разрывов цепи ДНК , которые впоследствии визуализируются в зависимости от введенная этикетка (рис.1), таким образом, служа параметром для процента апоптотических клеток в анализируемой клеточной популяции.
Чувствительность анализа сильно зависит от эффективности включения модифицированного dUTP, на которую влияет размер / объемность прикрепленной метки. Ряд флуоресцентно меченных dUTPs → Probes & Epigenetics, биотинилированные dUTPs → Probes & Epigenetics или дигоксигенилированные dUTPs → Probes & Epigenetics, как правило, являются подходящими субстратами для TdT, но dUTP, меченный более мелкими метками, такими как бром (BrdUTP) или алкиновая группа (EdUTP) продемонстрировали более высокую эффективность включения и, следовательно, более высокую чувствительность в анализах TUNEL, вероятно, из-за минимальных стерических препятствий [3,4,5] .
В то время как включение BrdUTP обнаруживается специфическими флуорофором или антителами, меченными репортерным ферментом (рис. 1A), обнаружение EdUTP достигается ковалентной конъюгацией азидсодержащего флуорофора → Click Chemistry через алкин, катализируемый Cu (I) химия -азид щелчка (CuAAC) (рис. 1B).
Рисунок 1: Принцип анализа TUNEL основан на опосредованном терминальной дезоксинуклеотидилтрансферазе (TdT) добавлении модифицированного dUTP (X-dUTP) к 3′-OH-концам фрагментов ДНК, которые образуются в результате индукция апоптоза.





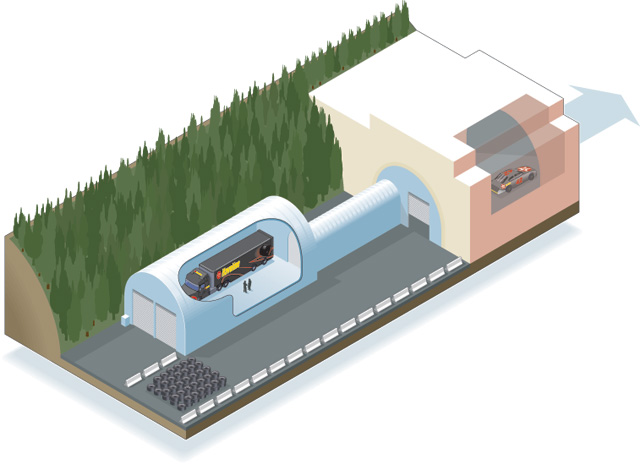


 Щербакова, д. 11
Щербакова, д. 11 , д. 3, корп. 2
, д. 3, корп. 2 Гастелло, д. 22
Гастелло, д. 22 7, корп. 2
7, корп. 2 28
28 18
18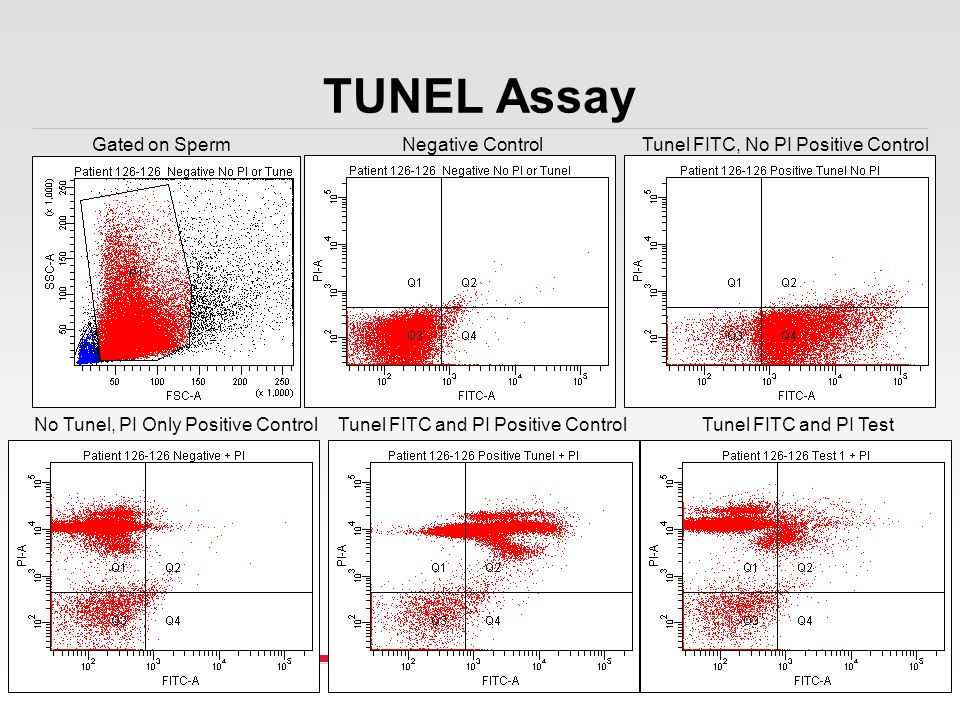 11, корп. 1
11, корп. 1 Коллонтай, д. 4
Коллонтай, д. 4 13, корп. 1
13, корп. 1 39, лит. А
39, лит. А 51, корп. 1
51, корп. 1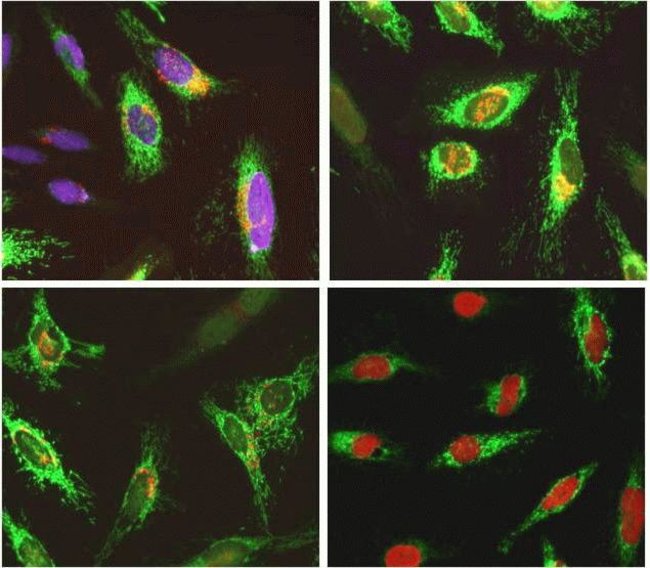 49, корп. 1
49, корп. 1 4
4 1
1