Гормоны щитовидной железы | Dopinglinkki
Вы здесь
Главная » Инфобанк » Гормоны щитовидной железы
С поправками от 16.09.2019
Свойства и механизм действия
В щитовидной железе образуются два метаболических активных гормона: тетрайодтиронин (тироксин, T4) и трийодтиронин (T3). Тироксин превращается в T3 (преимущественно в печени и почках), который обладает более выраженными эффектами.
Гормоны щитовидной железы играют важную роль в регуляции нормального роста, развития, обмена веществ, температуры тела и кровотока. Они влияют на метаболизм жиров, белков и углеводов, регуляцию температуры тела и поддержание водного и электролитного баланса.
Недостаточность гормонов щитовидной железы (например, недостаточная активность щитовидной железы или гипотиреоз) приводит к замедлению обмена веществ, роста и развития. T4 (левотироксин) является рецептурным препаратом, который применяется для лечения гипотиреоза. Доза подбирается индивидуально.
Избыточный уровень гормонов щитовидной железы приводит к ускорению обмена веществ (уменьшению массы тела), возбуждению, психической неуравновешенности и иногда к аритмиям сердца. Например, избыточный эффект может проявиться в том случае, если здоровый человек будет принимать препарат, содержащий гормон щитовидной железы, или если доза препарата у пациента с гипотиреозом будет увеличена слишком быстро.
Медицинское применение и дозировка
Тироксин в основном используется для лечения гипотиреоза, то есть недостаточной работы щитовидной железы. Типичная поддерживающая доза для взрослых составляет 0,1 мг/сут. перорально. Однако лечение следует начинать с более низкой дозы (0,025–0,05 мг/сут). Доза постепенно увеличивается до необходимой поддерживающей дозы [1].
Применение в качестве допинга
Гормон щитовидной железы имеет ряд механизмов, которые могут быть полезны для улучшения физической работоспособности, и являться мотивом использовать гормон щитовидной железы в качестве допинг-агента. К ним относятся усиление основного обмена и повышенная чувствительность тканей к катехоламинам (адреналин, норэпинефрин, дофамин), что приводит, в частности, к увеличению частоты сердечных сокращений. Гормон щитовидной железы также оказывает синергетическое действие на гормон роста, усиливая его действие [2].
К ним относятся усиление основного обмена и повышенная чувствительность тканей к катехоламинам (адреналин, норэпинефрин, дофамин), что приводит, в частности, к увеличению частоты сердечных сокращений. Гормон щитовидной железы также оказывает синергетическое действие на гормон роста, усиливая его действие [2].
Имеются данные о применении гормонов щитовидной железы у профессиональных бодибилдеров и бодибилдеров-любителей. Они направлены на изменение состава тела за счет ускорения обмена веществ и сжигания жира в организме [3, 4, 5]. В 2019 году гормон щитовидной железы еще не включен в Запрещенный список WADA (Всемирного антидопингового агентства) [6]. Однако случаи злоупотребления происходят, и различные стороны, в том числе Антидопинговое агентство Нидерландов, настаивают на добавлении гормона щитовидной железы в запрещенный список [7]. Уголовный кодекс Финляндии также не классифицирует гормон щитовидной железы как допинговый препарат.
Побочные эффекты
У пациентов с гипотиреозом препараты гормонов щитовидной железы обладают преимущественно положительным влиянием, если доза не увеличивается слишком быстро и не является чрезмерной. Избыточные дозы препаратов могут приводить к симптомам, которые напоминают симптомы гипертиреоза, включая сердцебиение, аритмии, диарею, истощение, снижение переносимости колебаний температур, бессонницу, возбуждение и даже психозы [8, 9].
Избыточные дозы препаратов могут приводить к симптомам, которые напоминают симптомы гипертиреоза, включая сердцебиение, аритмии, диарею, истощение, снижение переносимости колебаний температур, бессонницу, возбуждение и даже психозы [8, 9].
Для людей со скрытыми заболеваниями сердца побочное действие препаратов на сердце (аритмии, инфаркт миокарда) может быть крайне опасным [10]. Перед началом терапии препаратами щитовидной железы врач должен тщательно оценить состояние здоровья пациента, включая оценку функции сердца. Таким образом, можно определить риски, связанные с данной терапией.
Длительная передозировка тироксином приводит к повышению риска остеопороза. У 0,1–0,5 % пациентов развивается опасное осложнение – агранулоцитоз (снижение уровня лейкоцитов) [11]. Острая передозировка тироксином приводит к развитию тиреотоксикоза, симптомами которого является повышение температуры тела, нарушение работы сердца и кома [12]. Передозировка гормонами щитовидной железы может приводить к смерти.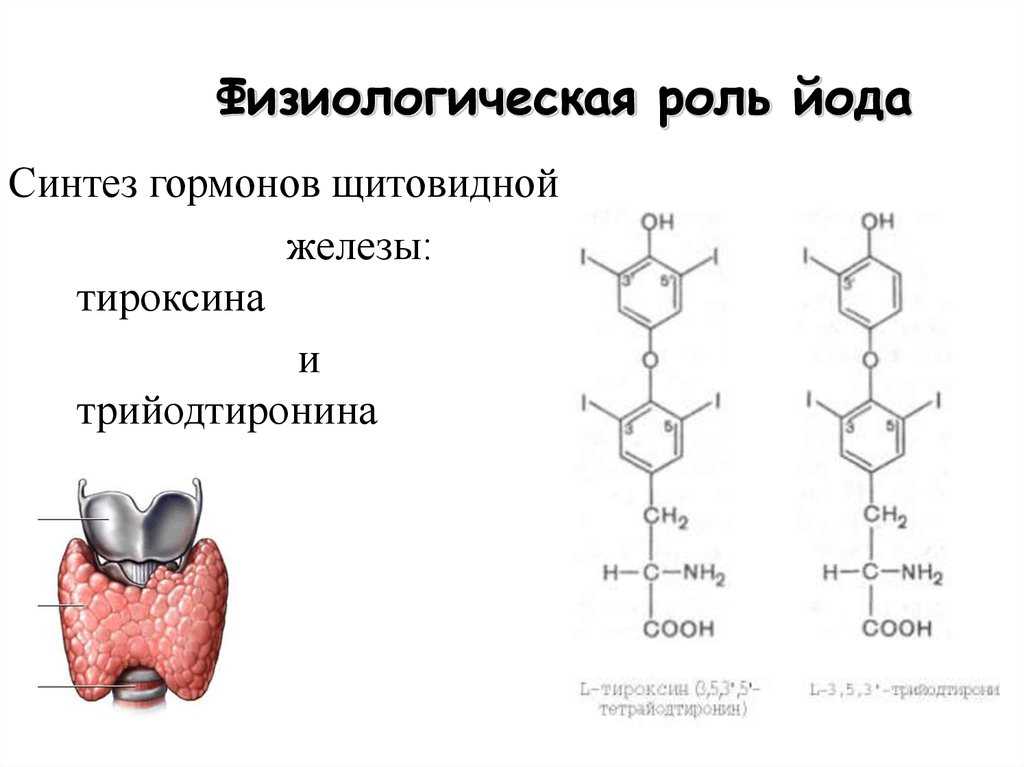 В этих случаях гормон щитовидной железы как правило употреблялся вместе с другими допинговыми препаратами [13].
В этих случаях гормон щитовидной железы как правило употреблялся вместе с другими допинговыми препаратами [13].
Наиболее распространенные торговые наименования (9/2014): Unithroid, L-Thyroxin, Levo-T, Levolet, Levoxyl, Novothyrox.
Timo Seppälä (Тимо Сеппяля)
Руководитель медицинского учреждения
Финский антидопинговый комитет FINADA (ныне SUEK ry)
Поправки внесены: Dopinglinkki
Источники
[1] Huupponen R, Savontaus E. 2018. Kilpirauhashormonit. Lääketieteellinen farmakologia ja toksikologia. Duodecim lääketietokanta
[2] Hackney AC, Saeidi A. The thyroid axis, prolactin and exercise in humans. Curr Opin Endocr Metab Res. 2019; 9:45–50
[3] McKillop. Drug abuse in body builders in the West of Scotland. Scottish Medical Journal 1987; 32(2): 39–41
[4] Augé WK, Augé SM. Naturalistic observation of athletic drug-use patterns and behavior in professional-caliber bodybuilders. Subst Use Misuse.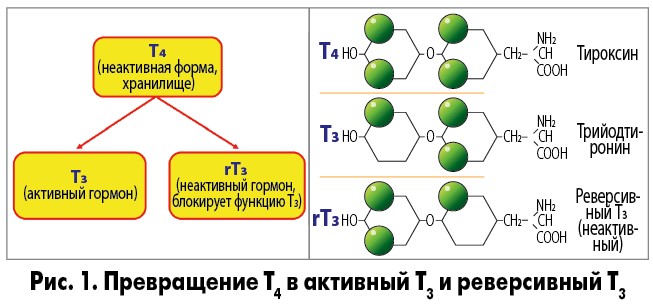 1999;34(2):217–49
1999;34(2):217–49
[5] Baker J, Graham M, Davies B. Steroid and prescription medicine abuse in the health and fitness community: A regional study. Eur J Int Med. 2006;17(7):497–484
[6] World Anti-Doping Agency. The world anti-doping code. International standard. Prohibited list, January 2019
[7] Doping autoriteit. 2018. 2019 WADA Prohibited List stakeholder consultation: review Dutch stakeholders
[8] Barczyński, Thor, Słowiaczek, Pitala. The role of the autonomic nervous system on malfunction of gastric motor and myoelectric activity in patients with hyperthyroidism. Folia Medica Cracoviensia. 2000; 41(3–4): 87–112
[9] Hepp. Psychiatric and neurologic disturbances in thyroid disorders. Wiener Klinische Wochenschrift Suppl. 1978; 94: 14–6
[10] Nagele, Hörmann, Nagele. First case study of periodic hypokalemic thyreotoxic paresis with partial respiratory insufficiency and concomitant sinus bradycardia. Wiener Medizinische Wochenschrift. 2009; 159(5–6): 156–9
[11] Bartalena, Bogazzi & Martino. Adverse effects of thyroid hormone preparations and antithyroid drugs. Drug Safety. 1996; 15(1): 53–63
Adverse effects of thyroid hormone preparations and antithyroid drugs. Drug Safety. 1996; 15(1): 53–63
[12] de Luis, Abad, Aller, González-Sagrado, Dueñas. Levothyroxine poisoning: clinical manifestations and therapeutic management. Anales de Medicina Interna. 2004; 21(1): 39–41
[13] Li C, Adhikari B, Gao L, Zhang S, Liu Q, Wang Y, Sun J. Performance-enhancing drugs abuse caused cardiomyopathy and acute hepatic injury in a young bodybuilder. Am J Mens Health. 2018;12(5):1700–1704
было эту статью полезной?
Всего голосов: 2134
Результаты заместительного лечения взрослых больных с множественной недостаточностью гормонов гипофиза препаратом рекомбинантного гормона роста человека | Лашас
Соматотропный гормон (СТГ, гормон роста — ГР) необходим для нормального функционирования организма в течение всей жизни человека. Пульсовая секреция СТГ достигает максимума во время полового созревания, а затем постоянно снижается до старости. В детском и подростковом возрасте действие СТГ проявляется ростом и развитием организма.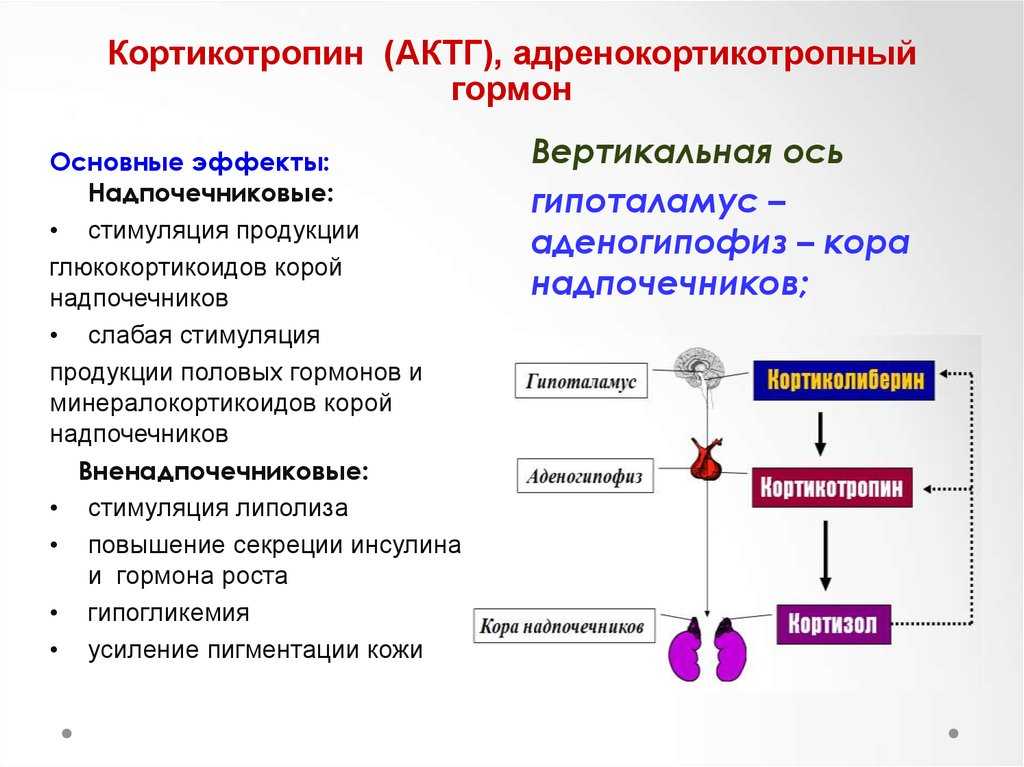
У здоровых взрослых СТГ поддерживает нормальную композицию тела, стимулирует липолиз, увеличивает тощую массу тела, влияет на обмен костной ткани, гомеостаз глюкозы. СТГ поддерживает также субъективное психологическое самочувствие, положительно влияет на функцию почек, кардиоваскулярную систему, иммунные функции.
Соматотропная недостаточность как клинический синдром у взрослых привлекла внимание исследователей лишь в последнее десятилетие. Для взрослых пациентов с соматотропной недостаточностью характерны меньшая тощая масса тела, плохо развитые мышцы, повышенная жировая масса тела, часто ожирение, меньшая физическая активность, повышенное количество холестерола в крови [2], повышенный риск смерти от кардиоваскулярных болезней [10], плохое психологическое самочувствие и качество жизни, что проявляется депрессией, усталостью, снижением энергии и витальности, социальной изоляцией [6].
Клиническая картина гипофизарной недостаточности (гипопитуитаризма) зависит от причины, времени начала (в детстве или взрослом возрасте) заболевания.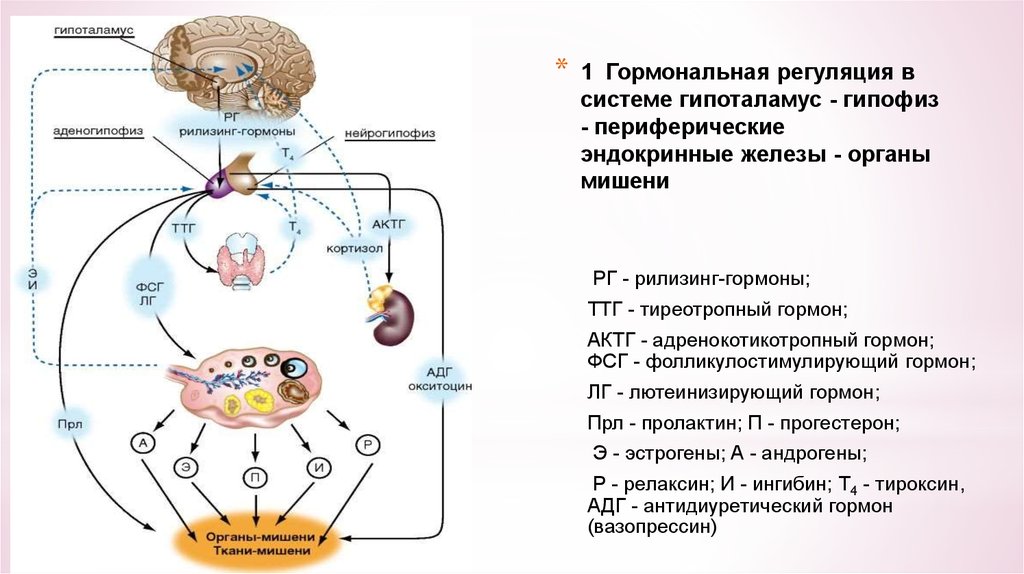 Болезнь может проявиться изолированной или множественной недостаточностью гормонов гипофиза.
Болезнь может проявиться изолированной или множественной недостаточностью гормонов гипофиза.
Множественная недостаточность гормонов гипофиза у взрослых может проявиться гипотиреозом, гипогонадизмом, надпочечниковой недостаточностью, нарушениями обмена веществ, резистентностью к инсулину, ожирением, снижением минеральной плотности костей [7].
Если соматотропная недостаточность у детей рано проявляется малой скоростью роста и может быть рано установлена, то у взрослых изолированный дефицит ГР распознается труднее и чаще всего подозревается только тогда, когда выявляется недостаточность и других гормонов гипофиза [1, 5].
Данные нескольких плацебо-контролируемых исследований показали, что лечение взрослых больных с изолированной соматотропной недостаточностью препаратами ГР улучшает композицию тела, распределение жира, увеличивает минеральную плотность костей, улучшает самочувствие. Цель заместительной терапии ГР и другими недостающими гормонами — корригировать и по возможности восстановить нарушенную деятельность эндокринной системы пациентов, тем самым улучшить качество жизни [1, 7].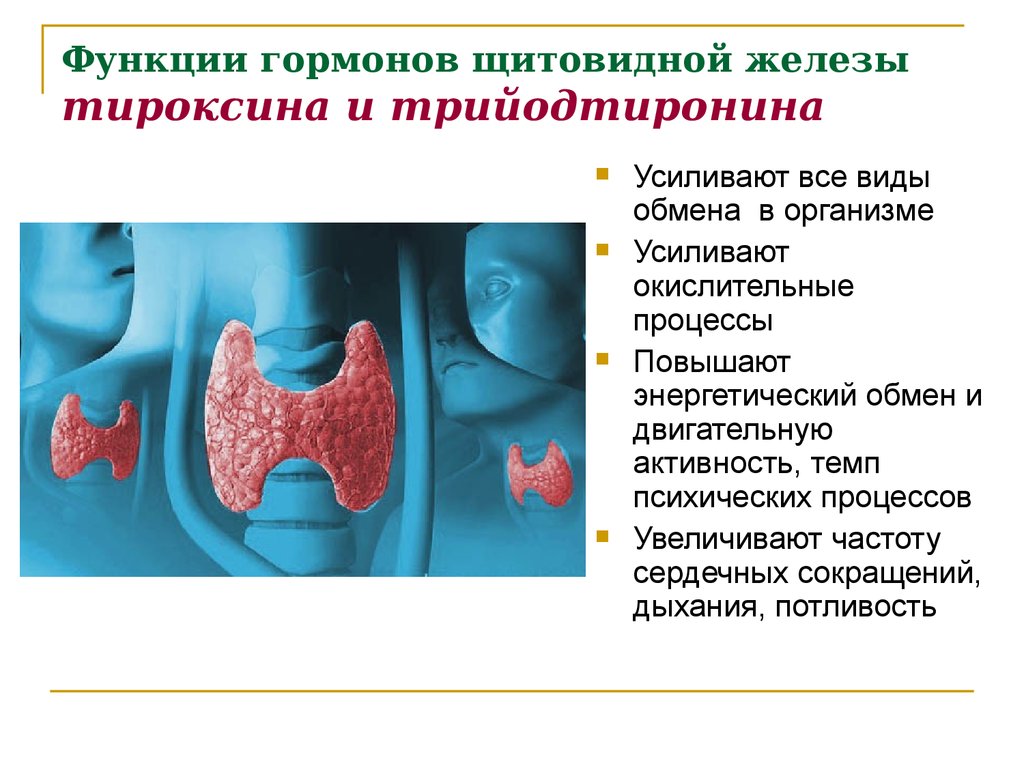
Целью данного исследования являлась оценка влияния заместительной терапии малыми дозами препарата рекомбинантного ГР человека Биосома у взрослых больных гипопитуитаризмом с множественным дефицитом гормонов аденогипофиза на антропометрические показатели, композицию тела, основной обмен, уровень гормонов в крови.
Материалы и методы
Проведено исследование открытого типа, без контрольной группы, его продолжительность составила 12 мес. Клинический и гормональный статус обследованных представлен в табл. 1.
В исследование было включено 18 взрослых больных гипопитуитаризмом с множественной недостаточностью гормонов аденогипофиза (9 женщин и 9 мужчин) в возрасте от 21 года до 40 лет (в среднем 28,9 ± 5,7 года).
Изучаемую группу составили 17 больных с идиопатической недостаточностьтю СТГ с детства и 1 — после удаления краниофарингиомы в детстве. Гипопитуитаризм проявлялся недостаточностью следующих гормонов: СТГ, ТТГ, АКТГ, ПРЛ, ЛГ, ФСГ — у 1 пациента, СТГ, ТТГ, АКТГ, ЛГ, ФСГ — у 5, СТГ, ТТГ, ЛГ, ФСГ — у 5, СТГ, ПРЛ, ЛГ, ФСГ — у 2, СТГ, ЛГ, ФСГ — у 3, СТГ, АКТГ, ПРЛ, ЛГ, ФСГ — у 2.
Таблица 1. Клинический и гормональный статус больных гипопитуитаризмом с множественной недостаточностью гормонов аденогипофиза до лечения
Показатель | Значение показателя (М ± SD) |
Число пациентов | 18 |
Пол (м/ж) | 9/9 |
Возраст, годы | 28,9 ± 5,7 |
Костные зоны роста (открытые/закрытые) | 5/13 |
Рост, см | 150,3 ± 10,7 (м.: 142,5-168; ж.: |
Рост, SDS | 130-147,5) -4,6 ± 1,7 (от -6,8 до -3,2) |
Масса тела, кг | 54,6 ± 11,1 |
ИМТ, кг/м2 | 24,1 ± 3,07 (м.: 19,7-28,2; ж.: |
Соотношение ОТ/ОБ | 18,8-29,4) 0,85 ± 0,08 (0,75-0,88) |
Пик СТГ в крови во время инсулиновой пробы, нг/мл | 0,6 ± 0,47 (0,02-1,5) |
ИРФ-1 в крови, нг/мл | 41,6 ± 27,0 (25,7-133,5) |
Примечание. SDS — коэффициент стандартного отклонения; м. — мужчины; ж. — женщины. В скобках — пределы колебаний.
SDS — коэффициент стандартного отклонения; м. — мужчины; ж. — женщины. В скобках — пределы колебаний.
У обследованных наблюдалось выраженное отставание в росте (рост в среднем составлял ± 10,7 см), средний показатель SDS роста составлял —4,6 ± 1,7. Показатель массы тела (в среднем 54,6 ± 11,1 кг) и индекс массы тела — ИМТ (в среднем 24,1 ±3,0 кг/м2) были повышены у 6 пациентов. У 3 женщин и 3 мужчин ИМТ был выше 25 кг/м2. Костные зоны роста не были полностью закрыты у 5 пациентов (у 3 мужчин и 2 женщин). Половое развитие у всех пациентов отставало. У всех пациентов была повторно подтверждена недостаточная секреция СТГ с помощью инсулиновой пробы с пиком выброса СТГ в среднем 0,6 ± 0,47 нг/мл, а также с низким уровнем инсулиноподобного ростового фактора 1 (ИРФ-1), количество которого в крови составляло в среднем 41,6 ± 27,0 нг/мл. 14 больных гипопитуитаризмом в детстве получали лечение препаратами ГР и необходимую заместительную терапию другими гормонами.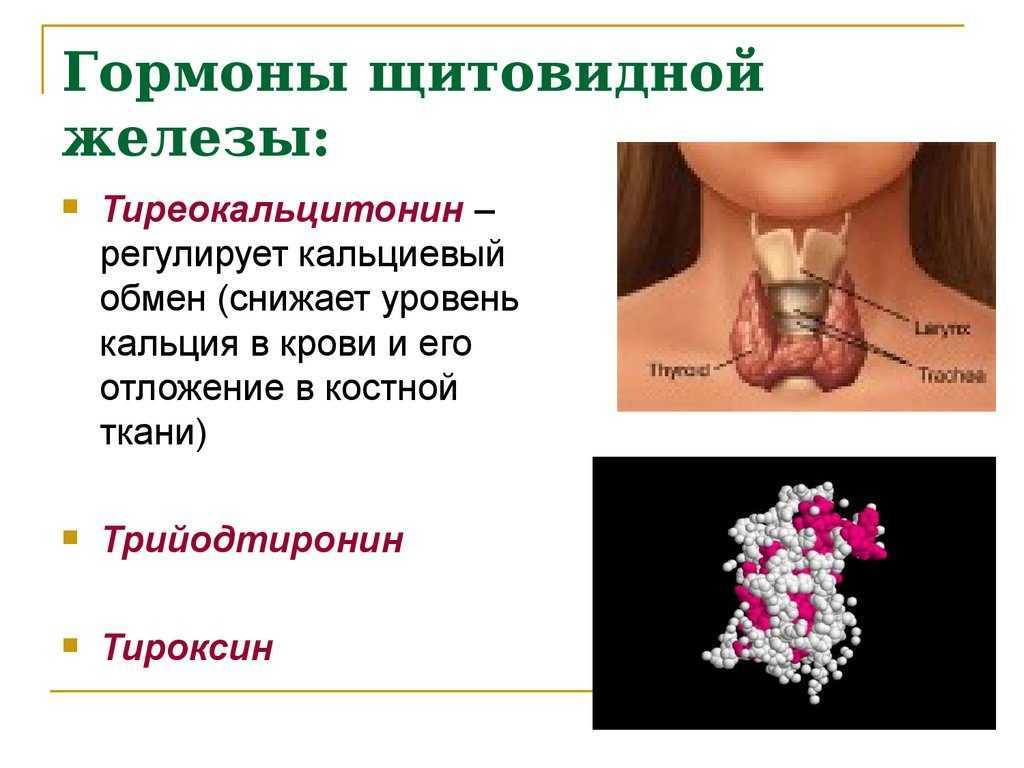 Перед включением в исследование больные не принимали препаратов ГР несколько лет.
Перед включением в исследование больные не принимали препаратов ГР несколько лет.
В ходе исследования перед лечением ГР, через 6 и 12 мес определяли следующие антропометрические показатели: рост (стадиометром международного стандарта «Holtain Limited Crymych, Dyfed»), массу тела (электронными весами «Soehnle»), ИМТ, соотношение окружности талии и окружности бедер (ОТ/ОБ). На аппарате «Bodystat 1500» (Великобритания) исследовали композицию тела обследуемых, определяя тощую, жировую, водяную массу (в кг), основной обмен (в ккал/сут).
Радиоиммунным методом с помощью коммерческих наборов «Polatom» (Польша) и «Immunotech» (Чехия) в сыворотке крови определяли содержание следующих гормонов: ГР (СТГ), трийодти- ронина (Т3), свободного тироксина (Т4), ТТГ, ИРФ-1, кортизола, Л Г, ФСГ, тестостерона, эстрадиола, прогестерона.
После получения информированного согласия на участие в исследовании определяли все указанные показатели и пациентам назначали препарат рекомбинантного ГР Биосома («Биофа», Литва) по 12 ME в неделю (по 2 ME 6 раз в неделю подкожно в бедро с чередованием мест инъекций, в вечернее время перед сном). Антропометрические показатели, композицию тела, количество гормонов в сыворотке крови определяли до начала лечения и через 6 и 12 мес лечения.
Антропометрические показатели, композицию тела, количество гормонов в сыворотке крови определяли до начала лечения и через 6 и 12 мес лечения.
Анализ полученных данных проводили с использованием статистической программы «Statis- tica» (StatSoft Inc., США). Данные представлены в виде средних арифметических и ошибки среднего (М ± SD). Критический уровень значимости различий принимали равным 0,05.
Результаты и их обсуждение
В период лечения ГР биосома достоверно увеличился рост больных за 12 мес в среднем со
- ± 10,7 до 152,5 ± 10,7 см (р < 0,05). Показатели прибавки роста за 12 мес лечения составили 0,4—8,6 см (табл. 2). Прибавка роста у 5 больных в возрасте от 21 года до 36 лет при еще открытых зонах роста за 12 мес лечения ГР составила 2—8,6 см (2,0, 4,0, 4,0, 4,2, 8,6 см).
За время лечения достоверно увеличились как масса тела — с 54,9 до 56,6 ±11,8 кг за 6 мес (р < 0,01) и до 58,2 ± 12,6 кг (р < 0,01) за 12 мес, так и ИМТ — с 24,1 ± 3,0 до 24,7 ± 3,3 кг/м2 за 6 мес (р < 0,05) и до 24,8 ± 3,6 кг/м2 (р < 0,05) за 12 мес (см. табл. 2). В то же время соотношение ОТ/ОБ уменьшилось с 0,85 ± 0,08 до 0,80 ± 0,06 за 6 мес (р < 0,001) и оставалось таким же через 12 мес (р < 0,01) (см. табл. 2).
табл. 2). В то же время соотношение ОТ/ОБ уменьшилось с 0,85 ± 0,08 до 0,80 ± 0,06 за 6 мес (р < 0,001) и оставалось таким же через 12 мес (р < 0,01) (см. табл. 2).
Жировая масса тела в течение года лечения ГР биосома достоверно не менялась. Однако очень важно, что во время лечения ГР достоверно увеличивалась тощая и водяная масса тела. Тощая масса тела за 12 мес лечения увеличилась с 39,8 ± 12,6 до
- ± 10,4 кг (р < 0,05). Водяная масса тела увеличилась от 28,2 ± 5,6 до 30,1 ± 5,6 кг (р < 0,05) уже за 6 мес и до 31,1 ± 6,2 кг (р < 0,01) за 12 мес лечения (см. табл. 2).
Важно, что во время лечения ГР биосома постоянно увеличивался основной обмен — от
- ± 239,9 ккал/сут перед лечением до
- ± 241,0 ккал/сут за 6 мес лечения (р < 0,05) и до 1401,0 ± 256,9 ккал/сутки (р < 0,01) за 12 мес лечения гормоном роста. Основной обмен достоверно увеличивался и в течение 2-го полугодия лечения (р = 0,01) (см. табл. 2).
В итоге, лечение ГР биосома привело к увеличению роста (при еще открытых зонах роста), массы тела, ИМТ, тощей и водяной массы тела, основного обмена, уменьшению соотношения ОТ/ОБ. Изменения в большинстве случаев были более выражены за первые 6 мес лечения. Исключение составляет основной обмен, постоянно увеличивавшийся до 12-го месяца.
Изменения в большинстве случаев были более выражены за первые 6 мес лечения. Исключение составляет основной обмен, постоянно увеличивавшийся до 12-го месяца.
Таблица 2. Изменение антропометрических показателей и композиции тела на фоне лечения ГР биосома (ЛГ ± SD)
Показатель | Перед лечением | Через 6 | мес лечения | Через 12 мес лечения | Достоверность различий | |||||||
Рост, СМ | 150,3 | + | 10,7 | 151,2 | + | 10,6 | 152,5 | + | 10,7 | Р2 | < | 0,05 |
Рз | < | 0,05 | ||||||||||
Рост, SDS | -4,6 | ± | 1,7 | -4,6 | ± | 1,9 | -4,5 | + | 1,8 | нд | ||
Масса тела, кг | 54,9 | ± | 10,8 | 56,6 | + | 11,8 | 58,2 | + | 12,6 | Р\ | < | 0,01 |
Р1 | < | 0,01 | ||||||||||
ИМТ, кг/м2 | 24,1 | + | 3,0 | 24,7 | + | 3,3 | 24,8 | ± | 3,6 | Р\ | < | 0,05 |
Р1 | < | 0,05 | ||||||||||
Соотношение ОТ/ОБ | 0,85 | ± | 0,08 | 0,80 | + | 0,06 | 0,80 | + | 0,07 | Р\ | < | 0,001 |
Р1 | < | 0,01 | ||||||||||
Жировая масса тела, кг | 16,4 | + | 3,9 | 16,7 | + | 5,7 | 15,9 | + | 3,6 | нд | ||
Тощая масса тела, кг | 39,8 | + | 12,6 | 40,7 | + | 11,8 | 40,3 | + | 10,4 | Р1 | < | 0,05 |
Водяная масса тела, кг | 28,2 | + | 5,6 | 30,1 | ± | 5,6 | 31,1 | ± | 6,2 | Р\ | < | 0,05 |
Рз | < | 0,01 | ||||||||||
Основной обмен, ккал/сут | 1327,6 | + | 239,9 | 1355,7 | ± | 241,0 | 1401,8 | + | 256,9 | Р\ | < | 0,05 |
Р1 | < | 0,01 | ||||||||||
Рз | = | 0,01 | ||||||||||
Примечание. Здесь и в табл. 3: р{ — достоверные различия между 0-м и 6-м месяцем лечения; р2 — между 0-м и 12-м месяцем; р3 — между 6-м и 12 месяцем; нд — недостоверно.
Здесь и в табл. 3: р{ — достоверные различия между 0-м и 6-м месяцем лечения; р2 — между 0-м и 12-м месяцем; р3 — между 6-м и 12 месяцем; нд — недостоверно.
В нескольких исследованиях было установлен- но, что взрослые с соматотропной недостаточностью обладают чаще всего обладают субнормальным основным обменом, зависящим от функции щитовидной железы, активности симпатической системы, количества тощей массы тела. Лечение же препаратами ГР увеличивает основной обмен как у больных с соматотропной недостаточностью, ожирением, так и у здоровых испытуемых [11, 14].
По данным большинства авторов, лечение препаратами ГР взрослых с соматотропной недостаточностью, действуя липолитически, значительно снижает жировую массу тела, а также увеличивает тощую массу тела. Установленные изменения были наиболее значительными до 6-го месяца лечения ГР [2, 5, 7].
ГР — важный фактор, регулирующий жировую массу в течение всей жизни. У больных с соматотропной недостаточностью количество подкожного жира (при исследовании с помощью компьютерной томографии) составляет примерно 75%, а количество интраабдоминального жира — на 84% больше, чем у здоровых лиц. Большинство больных с соматотропной недостаточностью отличают тучность, меньшее количество тощей массы тела, низкая масса скелетных мышц, меньшее количество экстрацеллюлярной жидкости. Характерна меньшая физическая сила, пониженная минеральная плотность костей. В нескольких плацебо-контро- лируемых исследованиях было установлено, что лечение больных с соматотропной недостаточностью препаратами ГР (0,5—3,6 ME на 1 м2 поверхности тела в сутки) нормализовало композицию тела: за 4—6 мес на 10% увеличивало тощую массу тела, массу мышц ног, снижало общее количество жировой массы тела (около 5 кг), количество подкожного и висцерального жира, влияло на гомеостаз водяной массы тела. Наибольшие изменения обычно отмечались во время первых месяцев лечения ГР [3].
Большинство больных с соматотропной недостаточностью отличают тучность, меньшее количество тощей массы тела, низкая масса скелетных мышц, меньшее количество экстрацеллюлярной жидкости. Характерна меньшая физическая сила, пониженная минеральная плотность костей. В нескольких плацебо-контро- лируемых исследованиях было установлено, что лечение больных с соматотропной недостаточностью препаратами ГР (0,5—3,6 ME на 1 м2 поверхности тела в сутки) нормализовало композицию тела: за 4—6 мес на 10% увеличивало тощую массу тела, массу мышц ног, снижало общее количество жировой массы тела (около 5 кг), количество подкожного и висцерального жира, влияло на гомеостаз водяной массы тела. Наибольшие изменения обычно отмечались во время первых месяцев лечения ГР [3].
По нашим данным на 1 количество жировой массы за 12 мес лечения ГР биосома у 3 обследуемых уменьшилось на 2—3 кг, а у некоторых оно даже увеличилось. Среднее количество жировой массы тела в группе обследованных не менялось возможно, из-за небольшой дозы ГР.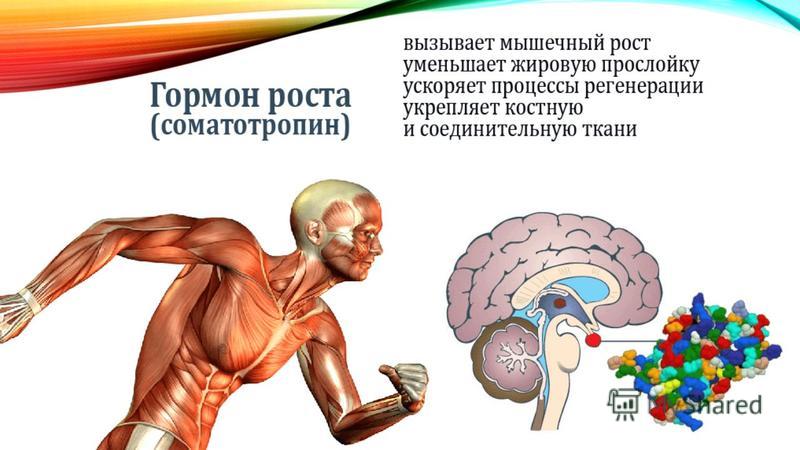
Таблица 3. Динамика уровня гормонов в крови на фоне лечения ГР биосома (ЛГ ± SD)
Гормон | Норма | Перед лечением | Через 6 мес лечения | Через 12 мес лечения | Достоверность различий |
СТГ, нг/мл | 2,55 ± 2,55 | 0,3 ± 0,2 | 0,3 ± 0,3 | 1,0 ± 1,5 | нд |
ИРФ-1, нг/мл | 410 ± 140 | 41,6 ± 27,0 | 90,9 ± 51,7 | 113,9 ± 73,3 | Pl = 0,0001 р2 = 0,001 Р3 = нд |
ТТГ, мМЕ/л | 3,0 ± 2,7 | 1,0 ± 1,3 | 0,8 ± 0,8 | 0,7 ± 0,8 | нд |
Свободный Т4, пмоль/л | 16,4 ± 5,2 | 13,7 ± 3,3 | 11,4 ± 4,8 | 13,6 ± 2,0 | р, < 0,01 Л = НД р3 = 0,01 |
Т3, нмоль/л | 1,3 ± 0,7 | 0,8 ± 0,3 | 1,2 ± 0,5 | 1,9 ± 0,4 | Pi < 0,01 р2 < 0,001 р3 < 0,001 |
Кортизол, нмоль/л | утром 435 ± 247 | 229,3 ± 156,9 | 199,5 ± 146,8 | 209,9 ± 207,0 | нд |
В ходе лечения ГР биосома оценивали динамику количества СТГ, ТТГ, свободного Т4, Т3, кортизола в крови. До лечения была выявлена недостаточность секреции соматотропной оси — сниженный ответ СТГ на стимуляцию инсулином, низкий уровень медиатора СТГ (ИРФ-1) — в среднем 41,6 ± 27 нг/мл (нормальный уровень у лиц старше 20 лет 92—423 нг/мл). Во время лечения ГР биосома количество СТГ в крови не менялось, уровень же ИРФ-1 постоянно повышался — за 6 мес до 90,9 ±51,7 нг/мл (р = 0,0001), за 12 мес — до 113,9 ± 73,3 нг/мл (р = 0,001) (табл. 3). Увеличение уровня ИРФ-1 в крови указывает на эффективность лечения препаратом Биосома, а также отражает биологические эффекты экзогенного СТГ на уровне органов-мишеней. Определение количества ИРФ-1 помогает мониторингу дозы ГР [5, 6].
До лечения была выявлена недостаточность секреции соматотропной оси — сниженный ответ СТГ на стимуляцию инсулином, низкий уровень медиатора СТГ (ИРФ-1) — в среднем 41,6 ± 27 нг/мл (нормальный уровень у лиц старше 20 лет 92—423 нг/мл). Во время лечения ГР биосома количество СТГ в крови не менялось, уровень же ИРФ-1 постоянно повышался — за 6 мес до 90,9 ±51,7 нг/мл (р = 0,0001), за 12 мес — до 113,9 ± 73,3 нг/мл (р = 0,001) (табл. 3). Увеличение уровня ИРФ-1 в крови указывает на эффективность лечения препаратом Биосома, а также отражает биологические эффекты экзогенного СТГ на уровне органов-мишеней. Определение количества ИРФ-1 помогает мониторингу дозы ГР [5, 6].
До лечения были выявлены низкие уровни гонадотропинов, а также половых гормонов в крови, которые в ходе лечения не менялись. Уровень кортизола в крови утром до лечения был нормальным и составлял в среднем 229,3 ± 156,9 нмоль/л, а в ходе лечения достоверно не менялся (см. табл. 3, рисунок). Во время инсулиновой пробы ответная секреция кортизола была нормальной — пик в среднем до 475,2 ± 170,4 нмоль/л. Однако у 4 больных базальный уровень и ответная секреция кортизола на стимуляцию инсулином были снижены.
Однако у 4 больных базальный уровень и ответная секреция кортизола на стимуляцию инсулином были снижены.
До лечения определяли функциональную активность гипофизарно-щитовидной оси: средние уровни ТТГ и свободного Т4 в крови были нормальными и составляли 1,0 ± 1,3 мМЕ/л и 13,7 ± 3,3 пмоль/л соответственно, в то же время средний уровень Т3 в крови был ниже нормы и составил 0,8 ± 0,3 нмоль/л (см. табл. 3). У части обследованных был выявлен центральный гипотиреоз, и они получали заместительную терапию Т4. На фоне лечения ГР биосома средний уровень ТТГ не менялся, средний уровень свободного Т4 в крови достоверно снижался в границах нормы в среднем до
- ± 4,8 пмоль/л (р < 0,01) за 6 мес лечения ГР биосома и повышался в среднем до нормального уровня (13,6 ± 2,0 пмоль/л; р = 0,01) за 12 мес лечения. В то же время средний уровень Т3 в крови в ходе лечения постоянно повышался до нормы — за 6 мес до 1,2 ± 0,5 нмоль/л (р < 0,01), за 12 мес до 1,9 ± 0,4 нмоль/л (р < 0,001).
 Уровень Т3 в крови достоверно повышался и между 6-м и 12-м месяцем лечения (р < 0,001) (см. табл. 3, рисунок). Определена достоверная положительная корреляция уровня ИРФ-1 в крови и уровня Т3 на фоне лечения препаратом Биосома (г = 0,63; р < 0,01). Это позволяет полагать, что экзогенно вводимый ГР, увеличивая количество медиатора ИРФ-1 в крови, повышает также и уровень Т3 в крови.
Уровень Т3 в крови достоверно повышался и между 6-м и 12-м месяцем лечения (р < 0,001) (см. табл. 3, рисунок). Определена достоверная положительная корреляция уровня ИРФ-1 в крови и уровня Т3 на фоне лечения препаратом Биосома (г = 0,63; р < 0,01). Это позволяет полагать, что экзогенно вводимый ГР, увеличивая количество медиатора ИРФ-1 в крови, повышает также и уровень Т3 в крови.
На такие же изменения указывают и другие авторы. В нескольких исследованиях было установление, что экзогенный ГР увеличивает периферическую конверсию общего и свободного Т4 в Т3 как у здоровых лиц, так и у больных с соматотропной недостаточностью и центральным гипотиреозом. Авторы предполагают, что существует тесная связь между осью ГР—ИРФ-1 и тиреоидными гормонами [5, 6].
Похожие изменения были выявлены у здоровых молодых людей при кратковременном введении им ГР (0,1 МЕ/кг в течение 10 дней) [13] и у женщин с ожирением (0,09 МЕ/кг идеальной массы 5 нед) [7].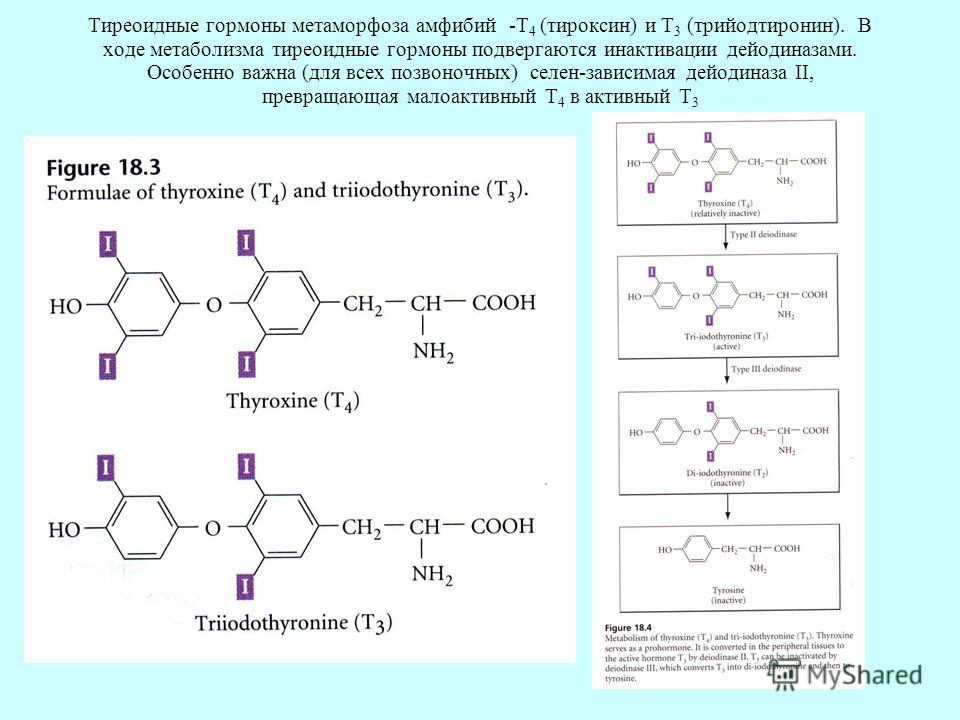 Количество Т3 в крови увеличилось на 15 и 24% соответственно. У женщин на 20% увеличилось также потребление энергии.
Количество Т3 в крови увеличилось на 15 и 24% соответственно. У женщин на 20% увеличилось также потребление энергии.
ГР и гормоны щитовидной железы оказывают многогранное действие на обмен веществ. Эти 2 гормональные системы взаимодействуют между собой: Т3 стимулирует транскрипцию гена ГР, секрецию ГР и уровень мРНК, увеличивает количество рецепторов ИРФ-1, экспресию мРНК ИРФ-1. Как ГР, так и Т3 похоже действуют на кардиоваскулярную систему, обмен жиров, расходование энергии, однако обладают различными специфическими свойствами [3, 12].
Лечение ГР стимулирует периферическую конверсию Т4 в Т3. Снижение количества Т4 во время лечения ГР больных с гипопитуитаризмом указывает на проявление бывшего до лечения субклинического центрального гипотиреоза. Авторы предполагают, что нормальная соматотропная функция является существенным фактором нормального метаболизма йодтиронинов [10].
В начале лечения ГР биосома у некоторых больных гипопитуитаризмом наблюдалась отечность век и ног. Данные явления были преходящими и существенно не отражались на общем состоянии пациентов.
Данные явления были преходящими и существенно не отражались на общем состоянии пациентов.
Таким образом, по данным нашего исследования, лечение взрослых больных гипопитуитаризмом с множественной недостаточностью гормонов аденогипофиза (в том числе и с соматотропной недостаточностью) малыми дозами (2 МЕ/сут) препарата рекомбинантного ГР Биосома увеличивало рост (при открытых зонах роста), основной обмен, массу тела, ИМТ, уменьшало соотношение ОТ/ОБ, положительно меняло композицию тела (увеличивало тощую и водяную массу), гормональные показатели, улучшало общее самочувствие, внешность, мышечную силу, психологическое самочувствие.
Выводы
- Лечение взрослых больных гипопитуитаризмом с соматотропной недостаточностью малыми дозами (2 МЕ/сут) препарата рекомбинантного ГР Биосома увеличивает рост пациентов с еще незакрытыми зонами роста.
- На фоне лечения увеличились масса тела, ИМТ и уменьшилось соотношение ОТ/ОБ за 6 и 12 мес. Во 2-м полугодии показатели не менялись.

- Во время лечения менялась композиция тела — достоверно увеличилась тощая и водяная масса тела за 6 и 12 мес по сравнению с базальной. Жировая масса тела на фоне лечения не менялась.
- Во время всего лечения ГР биосома постоянно увеличивался основной обмен.
- На фоне лечения не менялся уровень ГР, ТТГ, гонадотропинов, половых гормонов, кортизола в крови.
- В течение всего периода лечения до 12-го месяца достоверно увеличивался уровень ИРФ-1 и Т3 в крови. Выявлена положительная корреляция между уровнем ИРФ-1 и Т3 в крови во время лечения. Уровень свободного Т4 в крови за 6 мес лечения ГР достоверно снизился в пределах нормы и повысился до базального уровня за 12 мес.
Взаимосвязь гормонов щитовидной железы и гормонов роста: влияние рилизинг-гормона гормона роста у самцов крыс с гипо- и гипертиреозом
Сохранить цитату в файл
Формат:
Резюме (текст)PubMedPMIDAbstract (текст)CSV
Добавить в коллекции
- Создать новую коллекцию
- Добавить в существующую коллекцию
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Не удалось загрузить вашу коллекцию из-за ошибки
Повторите попытку
Добавить в мою библиографию
- Моя библиография
Не удалось загрузить делегатов из-за ошибки
Повторите попытку
Ваш сохраненный поиск
Название сохраненного поиска:
Условия поиска:
Тестовые условия поиска
Электронная почта:
(изменить)
Который день?
Первое воскресеньеПервый понедельникПервый вторникПервая средаПервый четвергПервая пятницаПервая субботаПервый деньПервый рабочий день
Который день?
ВоскресеньеПонедельникВторникСредаЧетвергПятницаСуббота
Формат отчета:
SummarySummary (text)AbstractAbstract (text)PubMed
Отправить максимум:
1 шт.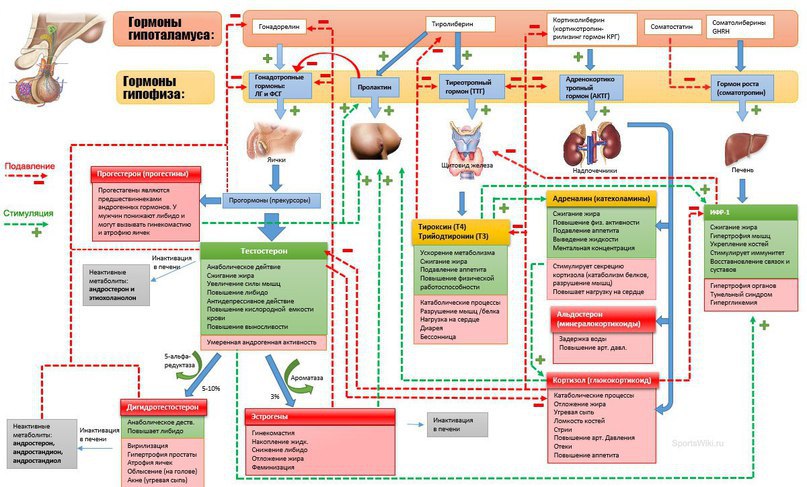 5 шт. 10 шт. 20 шт. 50 шт. 100 шт. 200 шт.
5 шт. 10 шт. 20 шт. 50 шт. 100 шт. 200 шт.
Отправить, даже если нет новых результатов
Необязательный текст в электронном письме:
Создайте файл для внешнего программного обеспечения для управления цитированием
. 1986; 279:367-75.
doi: 10.1530/acta.0.112s367.
AW Root, D Shulman, J Root, F Diamond
PMID:
3096042
DOI:
10.1530/акт.0.112с367
А. В. Рут и др.
Acta Endocrinol Suppl (Копенг).
1986.
. 1986; 279:367-75.
1986; 279:367-75.
doi: 10.1530/acta.0.112s367.
Авторы
AW Root, D Shulman, J Root, F Diamond
PMID:
3096042
DOI:
10.1530/акт.0.112с367
Абстрактный
Гормон роста (GH) и гормоны щитовидной железы взаимодействуют в гипоталамусе, гипофизе и периферических тканях. Гормон щитовидной железы оказывает разрешающее действие на анаболические и метаболические эффекты ГР и увеличивает синтез этого белкового гормона в гипофизе. GH угнетает секрецию тиреотропина и гормонов щитовидной железы и увеличивает периферическое превращение тироксина в трийодтиронин. У взрослых самцов крыс экспериментальный гипотиреоз, вызванный приемом внутрь пропилтиоурацила, угнетает секреторную реакцию ГР на СТГ-рилизинг-гормон in vivo и in vitro, отражая пониженные запасы ГР в гипофизе в состоянии гипотиреоза. Кратковременное введение больших количеств тироксина с индукцией гипертиреоидного состояния не влияет на секреторную реакцию ГР in vivo на ГР-рилизинг-гормон у этого животного.
Кратковременное введение больших количеств тироксина с индукцией гипертиреоидного состояния не влияет на секреторную реакцию ГР in vivo на ГР-рилизинг-гормон у этого животного.
Похожие статьи
Модуляция гормонами щитовидной железы гипоталамического гормона роста (GH) — высвобождающий фактор гипофиза оси GH у крыс.
Мики Н, Оно М, Хидзука Н, Аоки Т, Демура Х.
Мики Н и др.
Джей Клин Инвест. 1992 г., июль; 90 (1): 113–20. DOI: 10.1172/JCI115823.
Джей Клин Инвест. 1992.PMID: 1634603
Бесплатная статья ЧВК.Реакции гормона роста на фактор, высвобождающий гормон роста (1-29), у крыс с эутиреозом, гипотиреозом и гипертиреозом.
Диегес С., Джордан В., Харрис П., Фурд С., Родригес-Арнао М.Д., Гомес-Пан А.
 , Холл Р., Скэнлон М.Ф.
, Холл Р., Скэнлон М.Ф.
Диегес С. и др.
J Эндокринол. 1986 г., апрель; 109 (1): 53-6. doi: 10.1677/joe.0.10.
J Эндокринол. 1986 год.PMID: 2871123
Влияние неонатального гипо- и гипертиреоза на содержание гормона роста гипофиза у крыс.
Куломб П., Руэль Дж., Дюссо Дж. Х.
Куломб П. и соавт.
Эндокринология. 1980 декабрь; 107(6):2027-33. doi: 10.1210/endo-107-6-2027.
Эндокринология. 1980.PMID: 7428704
Влияние гормонов щитовидной железы на регуляцию секреции гормона роста.
Джустина А., Веренберг В.Б.
Джустина А. и др.
Евр Дж Эндокринол. 1995 декабрь; 133 (6): 646-53. doi: 10.1530/eje.0.1330646.
Евр Дж Эндокринол. 1995.PMID: 8548047
Обзор.
Взаимосвязь гормонов щитовидной железы и пролактина.

Гладкова А.И.
Гладкова АИ.
Пробл Эндокринол (Моск). 1984 г., май-июнь; 30(3):79-89.
Пробл Эндокринол (Моск). 1984.PMID: 6429661
Обзор.
Русский.
Аннотация недоступна.
Посмотреть все похожие статьи
Цитируется
Воспалительное опосредование дефицита роста, вызванного тепловым стрессом, у домашнего скота и его потенциальная роль в качестве цели для пищевых вмешательств: обзор.
Мост МС, Йейтс ДТ.
Большинство MS и др.
Животные (Базель). 2021 13 декабря; 11 (12): 3539. дои: 10.3390/ani11123539.
Животные (Базель). 2021.PMID: 34944316
Бесплатная статья ЧВК.Обзор.
Полные химические структуры митохондриальных тРНК человека.

Сузуки Т., Яширо Ю., Кикути И., Исигами Ю., Сайто Х., Мацузава И., Окада С., Мито М., Ивасаки С., Ма Д., Чжао Х., Асано К., Лин Х., Кирино Ю., Сакагути Ю., Судзуки Т.
Сузуки Т. и др.
Нац коммун. 2020 28 августа; 11 (1): 4269. doi: 10.1038/s41467-020-18068-6.
Нац коммун. 2020.PMID: 32859890
Бесплатная статья ЧВК.Геномная основа фенотипов конвергентных островов у удавов.
Card DC, Adams RH, Schield DR, Perry BW, Corbin AB, Pasquesi GIM, Row K, Van Kleeck MJ, Daza JM, Booth W, Montgomery CE, Boback SM, Castoe TA.
Кард Д.С. и др.
Геном Биол Эвол. 2019 1 ноября; 11 (11): 3123-3143. DOI: 10.1093/gbe/evz226.
Геном Биол Эвол. 2019.PMID: 31642474
Бесплатная статья ЧВК.Диосгенин и его биологическая матрица на основе пажитника влияют на резистентность к инсулину и анаболические гормоны в модели резистентности к инсулину на крысах.

Кисс Р., Пести-Асбут Г., Сарваш М.М., Штюндл Л., Чиаки З., Хегедуш С., Ковач Д., Бадале А., Мате Э., Силваши З., Ременьик Дж.
Кисс Р. и др.
Биомед Рез Инт. 2019 4 апреля; 2019: 7213913. дои: 10.1155/2019/7213913. Электронная коллекция 2019.
Биомед Рез Инт. 2019.PMID: 31080828
Бесплатная статья ЧВК.Модуляция гормонами щитовидной железы гипоталамического гормона роста (GH) — высвобождающий фактор гипофиза оси GH у крыс.
Мики Н, Оно М, Хидзука Н, Аоки Т, Демура Х.
Мики Н и др.
Джей Клин Инвест. 1992 г., июль; 90 (1): 113–20. DOI: 10.1172/JCI115823.
Джей Клин Инвест. 1992.PMID: 1634603
Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
термины MeSH
вещества
Процитируйте
Формат:
ААД
АПА
МДА
НЛМ
Отправить по телефону
Изменения гормона щитовидной железы, связанные с терапией гормоном роста у пациентов с дефицитом гормона роста
1. Lippe B.M., Van Herle A.J., LaFranchi S.H., Uller R.P., Lavin N., Kaplan S.A. детей с дефицитом гормона роста. Дж. Клин. Эндокринол. Метаб. 1975;40:612–618. doi: 10.1210/jcem-40-4-612. [PubMed] [CrossRef] [Google Scholar]
Lippe B.M., Van Herle A.J., LaFranchi S.H., Uller R.P., Lavin N., Kaplan S.A. детей с дефицитом гормона роста. Дж. Клин. Эндокринол. Метаб. 1975;40:612–618. doi: 10.1210/jcem-40-4-612. [PubMed] [CrossRef] [Google Scholar]
2. Porter B.A., Refetoff S., Rosenfield R.L., De Groot L.J., Fang V.S., Stark V. Аномальный метаболизм тироксина при гипосоматотрофической карликовости и подавление реакции на ТРГ во время терапии ГР. Педиатрия. 1973; 51: 668–674. [PubMed] [Google Scholar]
3. Каччари Э., Чиконьяни А., Пираццоли П., Бернарди Ф., Заппулла Ф., Саларди С., Мадзанти Л., Биазини А., Валенти Э. Влияние длительного краткосрочное введение ГР на гипофизарно-тиреоидную функцию при идиопатическом гипопитуитаризме. Акта Педиатр. Сканд. 1979;68:405–409. doi: 10.1111/j.1651-2227.1979.tb05028.x. [PubMed] [CrossRef] [Google Scholar]
4. Demura R., Yamaguchi H., Wakabayashi I., Demura H., Shizume K. Влияние гормона роста на гипоталамо-гипофизарно-щитовидную функцию у пациентов с гипофизарным нанизмом.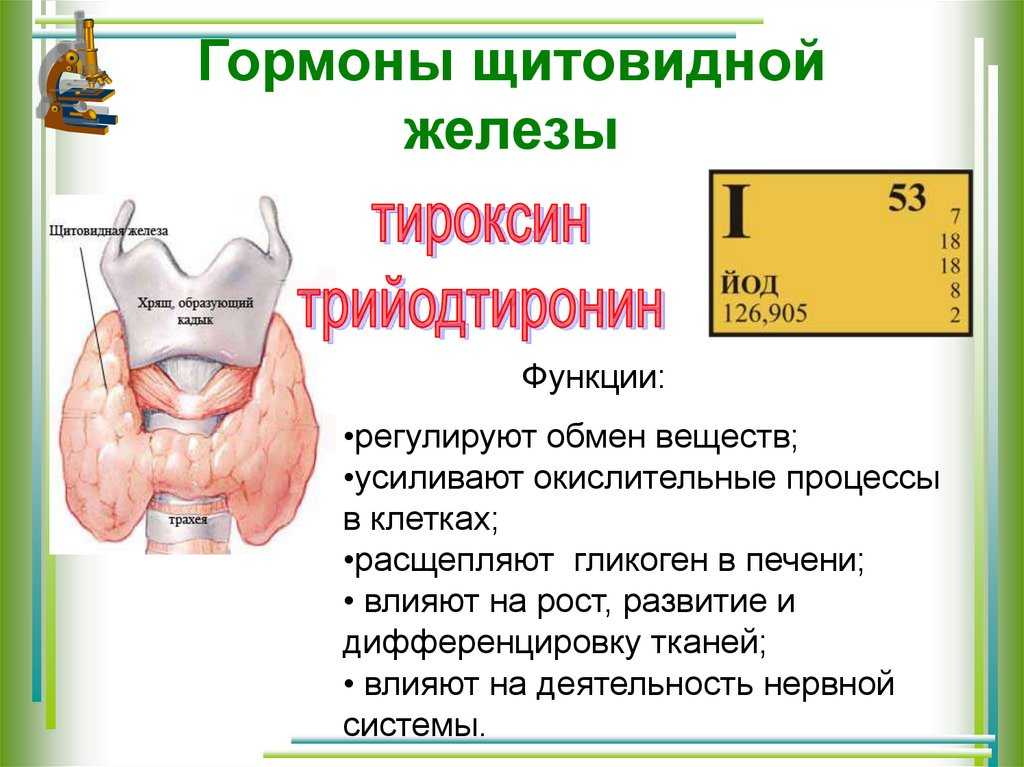 Акта Эндокринол. 1980; 93:13–19. doi: 10.1530/acta.0.0930013. [PubMed] [CrossRef] [Google Scholar]
Акта Эндокринол. 1980; 93:13–19. doi: 10.1530/acta.0.0930013. [PubMed] [CrossRef] [Google Scholar]
5. Jørgensen J.O., Pedersen S.A., Laurberg P., Weeke J., Skakkebaek N.E., Christiansen J.S. Влияние терапии гормоном роста на функцию щитовидной железы у взрослых с дефицитом гормона роста с сопутствующим тироксин-замещенным центральным гипотиреозом и без него. Дж. Клин. Эндокринол. Метаб. 1989;69:1127–1132. doi: 10.1210/jcem-69-6-1127. [PubMed] [CrossRef] [Google Scholar]
6. Пираццоли П., Каччари Э., Мандини М., Сганга Т., Капелли М., Чиконьяни А., Гуаланди С. Рост и функция щитовидной железы у детей, получавших лечение роста гормон. Дж. Педиатр. 1992; 121: 210–213. doi: 10.1016/S0022-3476(05)81190-4. [PubMed] [CrossRef] [Google Scholar]
7. Резвани И., ДиДжордж А.М., Доушен С.А., Бурдони С.Дж. Действие гормона роста человека (hGH) на экстратиреоидную конверсию тироксина (T9).0207 4 ) в трийодтиронин (T 3 ) у детей с гипопитуитаризмом. Педиатр.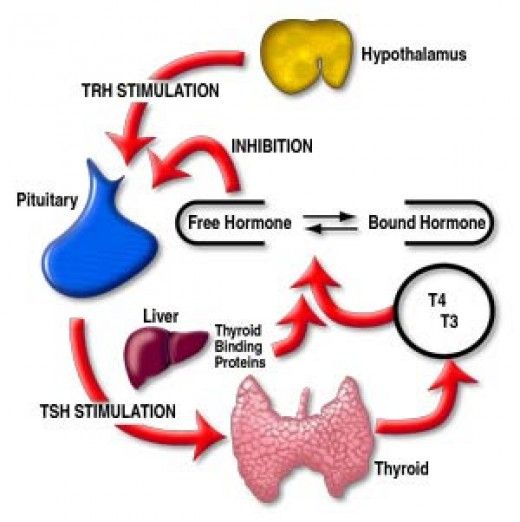 Рез. 1981; 15: 6–9. doi: 10.1203/00006450-198101000-00002. [PubMed] [CrossRef] [Google Scholar]
Рез. 1981; 15: 6–9. doi: 10.1203/00006450-198101000-00002. [PubMed] [CrossRef] [Google Scholar]
8. Jørgensen J.O., Møller J., Laursen T., Orskov H., Christiansen J.S, Weeke J. Введение гормона роста стимулирует расход энергии и экстратиреоидную конверсию тироксина в трийодтиронин в дозозависимым образом и подавляет циркадные уровни тиреотрофина: исследования у взрослых с дефицитом ГР. клин. Эндокринол. 1994;41:609–614. doi: 10.1111/j.1365-2265.1994.tb01826.x. [PubMed] [CrossRef] [Google Scholar]
9. Monson J.P., Weaver J.U., Noonan K., Burrin J.M. Влияние гормона роста на концентрацию гормона щитовидной железы в сыворотке и потребность в десмопрессине у взрослых с гипопитуитаризмом и центральным несахарным диабетом: предварительный отчет . Эндокринол. Метаб. 1994; 1 ((Приложение А)): 51–55. [Google Scholar]
10. Сато Т., Судзукуи Ю., Такэтани Т., Исигуро К., Масуяма Т., Таката И., Сано М., Кавасима Х., Коидзуми С., Накадзима Х. Расширенное преобразование периферийных устройств тироксина в трийодтиронин во время терапии гормоном роста у детей с дефицитом гормона роста. Дж. Клин. Эндокринол. Метаб. 1977;45:324–329. doi: 10.1210/jcem-45-2-324. [PubMed] [CrossRef] [Google Scholar]
Дж. Клин. Эндокринол. Метаб. 1977;45:324–329. doi: 10.1210/jcem-45-2-324. [PubMed] [CrossRef] [Google Scholar]
11. Wyatt D.T., Gesundheit N., Sherman B. Изменения уровня гормона щитовидной железы во время терапии гормоном роста у изначально эутиреоидных пациентов: отсутствие необходимости в добавках тироксина. Дж. Клин. Эндокринол. Метаб. 1998; 83: 3493–3497. doi: 10.1210/jc.83.10.3493. [PubMed] [CrossRef] [Google Scholar]
12. Portes E.S., Oliveira J.H., MacCagnan P., Abucham J. Изменения уровня гормонов щитовидной железы в сыворотке и их механизмы во время длительной заместительной терапии гормоном роста (GH) при дефиците GH дети. клин. Эндокринол. 2000; 53: 183–189.. doi: 10.1046/j.1365-2265.2000.01071.x. [PubMed] [CrossRef] [Google Scholar]
13. Porretti S., Giavoli C., Ronchi C., Lombardi G., Zaccaria M., Valle D., Arosio M., Beck-Peccoz P. Рекомбинантный ГР человека заместительная терапия и функция щитовидной железы у большой группы взрослых пациентов с дефицитом гормона роста: когда терапия L-T(4) становится обязательной? Дж.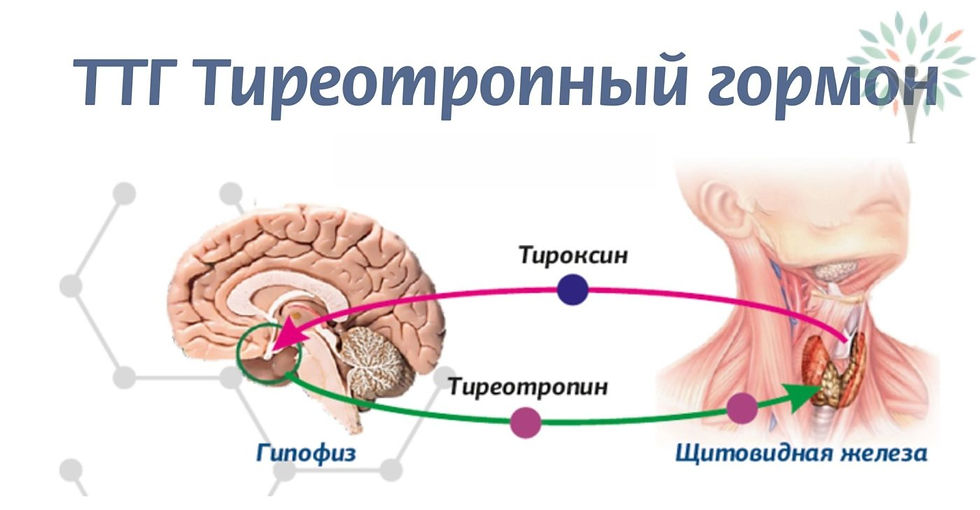 Клин. Эндокринол. Метаб. 2002;87:2042–2045. doi: 10.1210/jcem.87.5.8479. [PubMed] [CrossRef] [Google Scholar]
Клин. Эндокринол. Метаб. 2002;87:2042–2045. doi: 10.1210/jcem.87.5.8479. [PubMed] [CrossRef] [Google Scholar]
14. Giavoli C., Porretti S., Ferrante E., Cappiello V., Ronchi C.L., Travaglini P., Epaminonda P., Arosio M., Beck-Peccoz P. Заместительная терапия рекомбинантным гормоном роста и гипоталамо-гипофизарно-тиреоидная ось у детей с дефицитом гормона роста: когда следует опасаться возникновения центрального гипотиреоза? клин. Эндокринол. 2003;59: 806–810. doi: 10.1046/j.1365-2265.2003.01892.x. [PubMed] [CrossRef] [Google Scholar]
15. Калина-Фаска Б., Калина М., Келер Б. Влияние терапии рекомбинантным гормоном роста на концентрацию гормонов щитовидной железы. Междунар. Дж. Клин. Фармакол. тер. 2004; 42:30–34. doi: 10.5414/CPP42030. [PubMed] [CrossRef] [Google Scholar]
16. Hubina E., Mersebach H., Rasmussen A.K., Juul A., Sneppen S.B., Góth M.I., Feldt-Rasmussen U. Влияние заместительной терапии гормоном роста на секрецию гормона гипофиза заместительная гормональная терапия у взрослых с ДГР.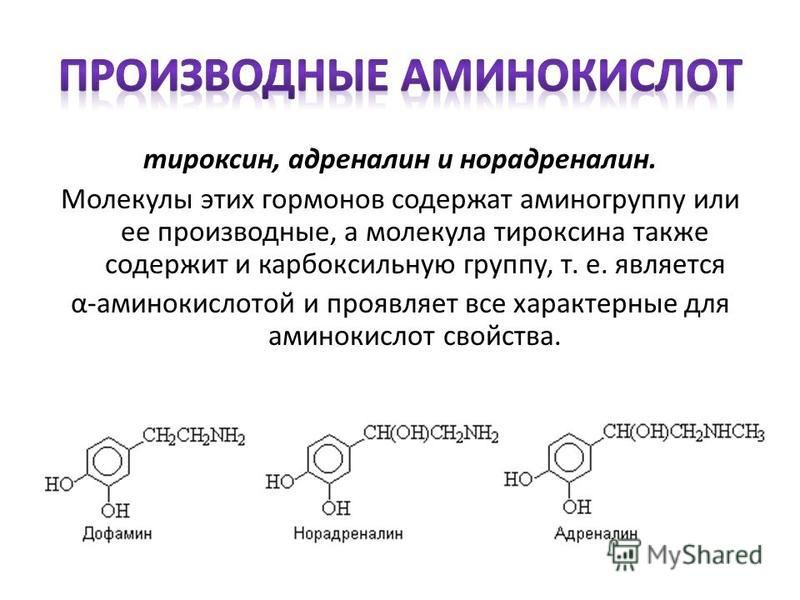 Горм. Рез. 2004; 61: 211–217. дои: 10.1159/000076538. [PubMed] [CrossRef] [Google Scholar]
Горм. Рез. 2004; 61: 211–217. дои: 10.1159/000076538. [PubMed] [CrossRef] [Google Scholar]
17. Семинара С., Стаги С., Кандура Л., Скривано М., Лензи Л., Нанни Л., Пальяи Ф., Кьярелли Ф. Изменения функции щитовидной железы во время длительная терапия чГР у детей с ВГД. Возможная связь с догоняющим ростом? Горм. Метаб. Рез. 2005; 37: 751–756. doi: 10.1055/s-2005-921104. [PubMed] [CrossRef] [Google Scholar]
18. Мартинс М.Р.А., Доин Ф.К., Комацу В.Р., Баррос-Нето Т.Л., Мойзес В.А., Абучам Дж. Замена гормона роста улучшает биологические эффекты тироксина: последствия для лечения центрального гипотиреоза. Дж. Клин. Эндокринол. Метаб. 2007;92:4144–4153. doi: 10.1210/jc.2007-0941. [PubMed] [CrossRef] [Google Scholar]
19. Agha A., Walker D., Perry L., Drake W.M., Chew S.L., Jenkins P.J., Grossman A.B., Monson J.P. Разоблачение центрального гипотиреоза после замены гормона роста у взрослых гипофизарные больные. клин. Эндокринол. 2007; 66: 72–77. doi: 10.1111/j.1365-2265.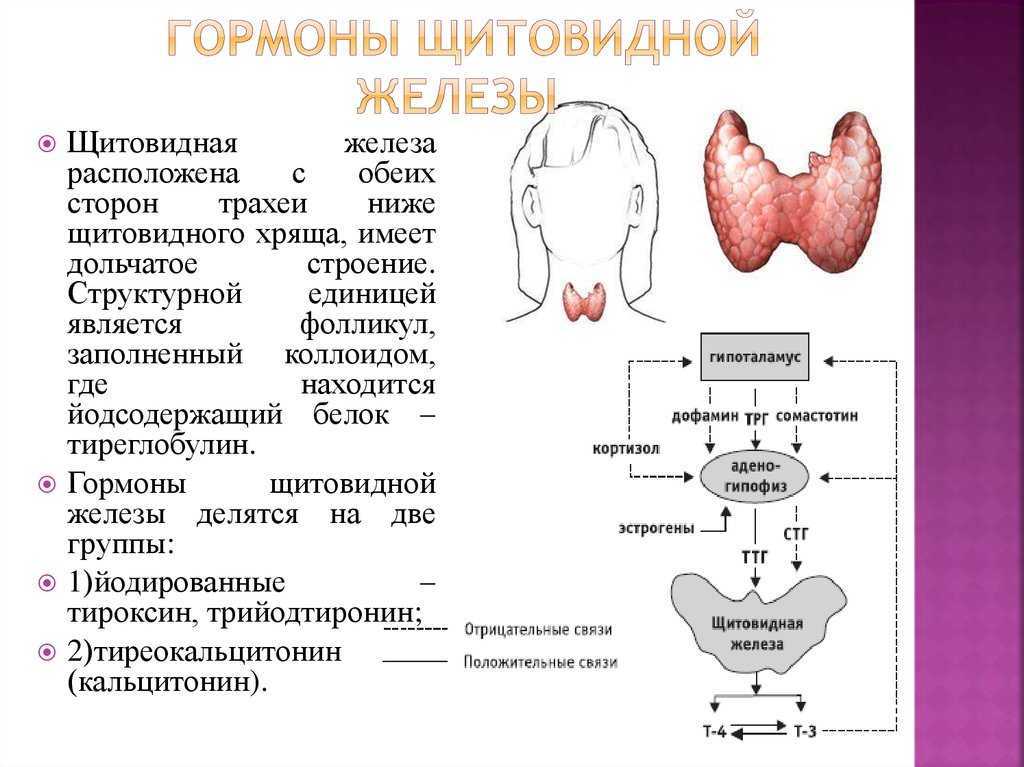 2006.02688.x. [PubMed] [CrossRef] [Google Scholar]
2006.02688.x. [PubMed] [CrossRef] [Google Scholar]
20. Моайери Х., Хемати А., Бидад К., Далили Х. Влияние заместительной терапии гормоном роста на тесты функции щитовидной железы у детей с дефицитом гормона роста. Акта Мед. Иран. 2008; 46: 473–476. [Академия Google]
21. Losa M., Scavini M., Gatti E., Rossini A., Madaschi S., Formenti I., Caumo A., Stidley C.A., Lanzi R. Долгосрочные эффекты замены гормона роста на функцию щитовидной железы у взрослых с дефицитом гормона роста. Щитовидная железа. 2008;18:1249–1254. doi: 10.1089/thy.2008.0266. [PubMed] [CrossRef] [Google Scholar]
22. Smyczyńska J., Hilczer M., Stawerska R., Lewiński A. Функция щитовидной железы у детей с дефицитом гормона роста (GH) в начальной фазе заместительной терапии GH — клиническое исследование. подразумеваемое. Щитовидная железа. Рез. 2010;3:2. doi: 10.1186/1756-6614-3-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Ciresi A., Guarnotta V., Amato M.C., Giordano C.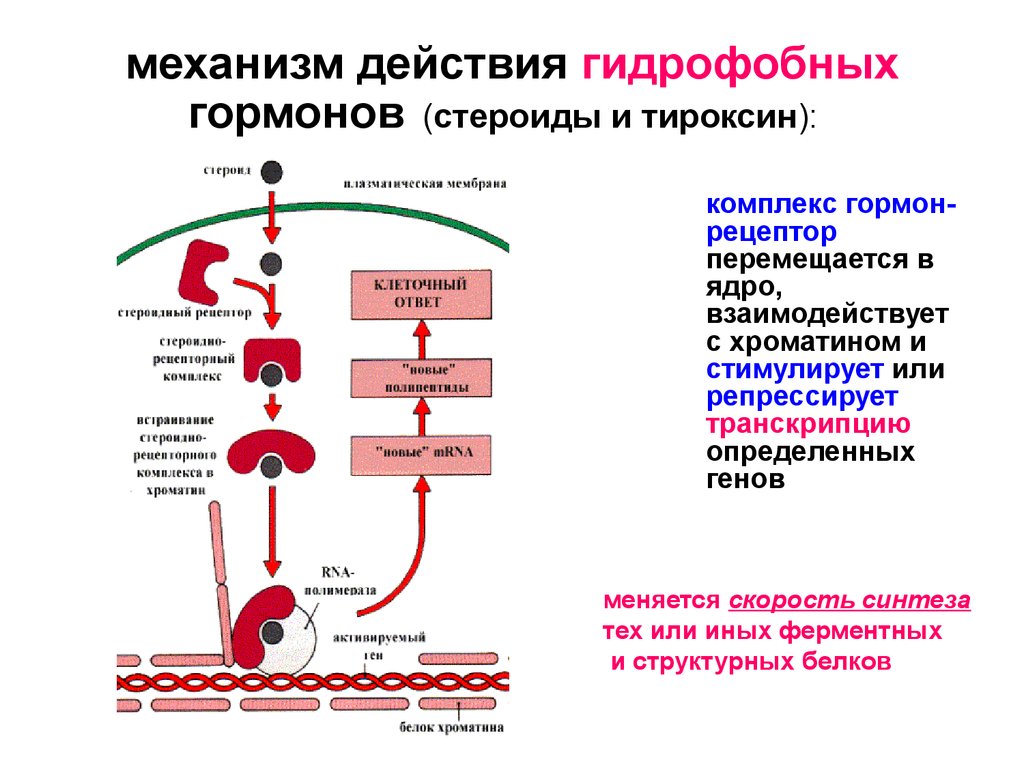 Корреляция между тяжестью дефицита гормона роста и метаболизмом щитовидной железы и эффектами длительного лечения гормоном роста на функцию щитовидной железы у детей с идиопатическим дефицитом гормона роста. Горм. Рез. Педиатр. 2014; 81: 379–385. doi: 10.1159/000356907. [PubMed] [CrossRef] [Google Scholar]
Корреляция между тяжестью дефицита гормона роста и метаболизмом щитовидной железы и эффектами длительного лечения гормоном роста на функцию щитовидной железы у детей с идиопатическим дефицитом гормона роста. Горм. Рез. Педиатр. 2014; 81: 379–385. doi: 10.1159/000356907. [PubMed] [CrossRef] [Google Scholar]
24. Глинн Н., Кенни Х., Салим Т., Халсолл Д.Дж., Смит Д., Тун Т.К., Макдермотт Дж.Х., Торми В., Томпсон С.Дж., МакАдам Б., и другие. Изменения уровня гормонов щитовидной железы после замены гормона роста вызывают сложные биологические эффекты. Эндокр. Практика. 2018;24:342–350. doi: 10.4158/EP-2017-0223. [PubMed] [CrossRef] [Академия Google]
25. Кескин М., Байрамоглу Э., Айкан З. Влияние заместительной терапии гормоном роста в течение 1 года на объем и функцию щитовидной железы у детей и подростков с идиопатическим дефицитом гормона роста. Дж. Педиатр. Эндокринол Метаб. 2017;30:1187–1190. doi: 10.1515/jpem-2017-0210. [PubMed] [CrossRef] [Google Scholar]
26. Витковска-Сендек Э., Боровец А., Майхер А., Соболь М., Руминьска М., Пыржак Б. Функция щитовидной железы у детей с дефицитом гормона роста при длительном заместительная терапия гормоном роста. цент. Евро. Дж. Иммунол. 2018;43:255–261. doi: 10.5114/ceji.2018.80043. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Витковска-Сендек Э., Боровец А., Майхер А., Соболь М., Руминьска М., Пыржак Б. Функция щитовидной железы у детей с дефицитом гормона роста при длительном заместительная терапия гормоном роста. цент. Евро. Дж. Иммунол. 2018;43:255–261. doi: 10.5114/ceji.2018.80043. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Ван Ирсел Л., Сантен Х.М., Зандвейкен Г.Р.Дж., Звавелинг-Сунавала Н., Хоккен-Колега А.С.С., Троценбург А.С.П. Низкие концентрации FT4 в начале лечения рекомбинантным гормоном роста человека: предиктор врожденных структурных гипоталамо-гипофизарных аномалий? Горм. Рез. Педиатр. 2018;89:98–107. doi: 10.1159/000486033. [PubMed] [CrossRef] [Google Scholar]
28. Ямаути И., Сакане Ю., Ямасита Т., Хирота К., Уэда Ю., Канаи Ю., Ямасита Ю., Кондо Ф., Фуджи Т., Таура Д. и др. Действие гормона роста на функцию щитовидной железы опосредовано йодтирониндейодиназой 2 типа у человека. Эндокринный. 2018;59: 353–363. doi: 10.1007/s12020-017-1495-y. [PubMed] [CrossRef] [Google Scholar]
29. Эбучи Ю., Кубо Т., Фуруджо М., Хигучи Ю., Фуджинага С., Цучия Х., Урата Н., Очи М., Намба Т., Хара Н. и др. Влияние терапии гормоном роста на функцию щитовидной железы у изолированных детей с дефицитом гормона роста и детей с низким гестационным возрастом: двухлетнее исследование, в том числе по оценке полезности теста стимуляции тиреотропин-рилизинг-гормона (ТРГ). Дж. Педиатр. Эндокринол. Метаб. 2020;33:1417–1423. doi: 10.1515/jpem-2020-0151. [PubMed] [CrossRef] [Академия Google]
Эбучи Ю., Кубо Т., Фуруджо М., Хигучи Ю., Фуджинага С., Цучия Х., Урата Н., Очи М., Намба Т., Хара Н. и др. Влияние терапии гормоном роста на функцию щитовидной железы у изолированных детей с дефицитом гормона роста и детей с низким гестационным возрастом: двухлетнее исследование, в том числе по оценке полезности теста стимуляции тиреотропин-рилизинг-гормона (ТРГ). Дж. Педиатр. Эндокринол. Метаб. 2020;33:1417–1423. doi: 10.1515/jpem-2020-0151. [PubMed] [CrossRef] [Академия Google]
30. Yao Q., Zheng D., Liang Y., Hou L., Ying Y.Q., Luo X.P., Wu W. Влияние терапии рекомбинантным гормоном роста человека на функцию щитовидной железы у педиатрических пациентов с дефицитом гормона роста. Перевод Педиатр. 2021; 10: 851–859. doi: 10.21037/tp-20-401. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
31. Møller J., Jørgensen J.O., Møller N., Christiansen J.S., Weeke J. Влияние введения гормона роста на окисление топлива и функцию щитовидной железы у здорового человека. . Метаболизм. 1992;41:728–731. doi: 10.1016/0026-0495(92)
1992;41:728–731. doi: 10.1016/0026-0495(92)
-X. [PubMed] [CrossRef] [Google Scholar]
32. Леонг Г.М., Роуз С.Р., Барнс К.М., Катлер Г.Б. Функция щитовидной железы у низкорослых детей без дефицита ГР во время плацебо-контролируемого двойного слепого исследования терапии ГР. Педиатр. Рез. 1993; 5:33–41. [Google Scholar]
33. Роуз С.Р., Леонг Г.М., Яновский Дж.А., Блюм Д., Хивнер Г., Бартнес К.М., Чипман Дж.Дж., Дичек Х.Л., Якобсен Дж., Ортнер К.Е. и др. Функция щитовидной железы у низкорослых детей без дефицита гормона роста во время плацебо-контролируемого двойного слепого исследования терапии рекомбинантным гормоном роста. Дж. Клин. Эндокринол. Метаб. 1995;80:320–324. [PubMed] [Google Scholar]
34. de Kort S.W., Willemsen R.H., van der Kaay D.C., van Dijk M., Visser T.J., Hokken-Koelega A.C. Функция щитовидной железы у низкорослых детей, родившихся маловесными для гестационного возраста (SGA) до и во время лечения ГР. клин. Эндокринол. 2008; 69: 318–322. doi: 10.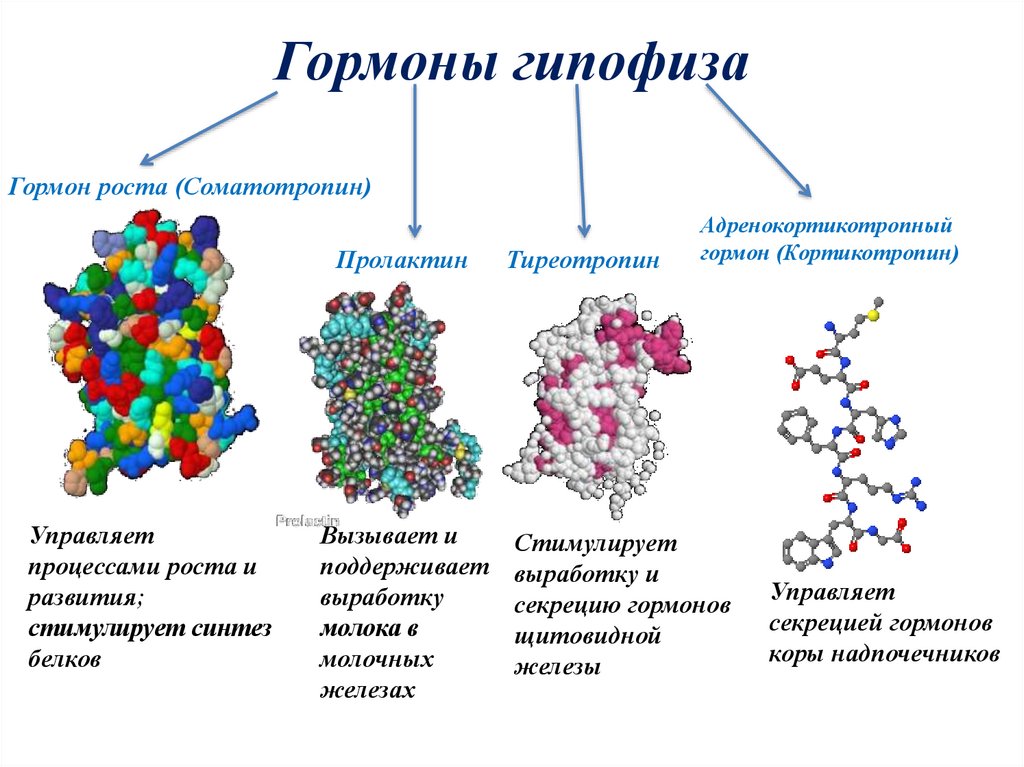 1111/j.1365-2265.2008.03195.x. [PubMed] [CrossRef] [Google Scholar]
1111/j.1365-2265.2008.03195.x. [PubMed] [CrossRef] [Google Scholar]
35. Susperreguy S., Miras M.B., Montesinos M.M., Mascanfroni I.D., Muñoz L., Sobrero G., Silvano L., Masini-Repiso A.M., Coleoni A.H., Targovnik H.M., и другие. Лечение гормоном роста (GH) снижает действие периферических гормонов щитовидной железы у девочек с синдромом Тернера. клин. Эндокринол. 2007;67:629–636. doi: 10.1111/j.1365-2265.2007.02936.x. [PubMed] [CrossRef] [Google Scholar]
36. Grunfeld C., Sherman B.M., Cavalieri R.R. Острые эффекты введения гормона роста человека на функцию щитовидной железы у здоровых мужчин. Дж. Клин. Эндокринол. Метаб. 1988; 67: 1111–1114. doi: 10.1210/jcem-67-5-1111. [PubMed] [CrossRef] [Google Scholar]
37. Sgrò P., Sansone M., Parisi A., Sartorio A., Sansone A., Romanelli F., Lenzi A., Di Luigi L. Супрафизиологический rhGH Администрация вызывает гендерные различия в оси гипоталамус-гипофиз-щитовидная железа (HPT) у здоровых людей. Дж. Эндокринол. расследование 2016;39: 1383–1390. doi: 10.1007/s40618-016-0489-6. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1007/s40618-016-0489-6. [PubMed] [CrossRef] [Google Scholar]
38. Lania A., Giavoli C., Ferrante E., Beck-Peccoz P. Центральный гипотиреоз и лечение гормоном роста: клиническая помощь. Дж. Эндокринол. расследование 2008; 31: 66–70. [PubMed] [Google Scholar]
39. Домбровска А.М., Тарач Ю.С., Куровска М., Новаковски А. Заболевания щитовидной железы у больных акромегалией. Арка Мед. науч. 2014; 29: 837–845. doi: 10.5114/aoms.2013.36924. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Начев Е., Вандева С., Ковачева Р., Кирилов Г., Калинов К., Захариева С. Изменения щитовидной железы у больных акромегалией. Арка Эндокринол. Метаб. 2020; 64: 269–275. [PubMed] [Google Scholar]
41. Дагделен С., Чинар Н., Эрбас Т. Повышенный риск рака щитовидной железы при акромегалии. гипофиз. 2014; 17: 299–306. doi: 10.1007/s11102-013-0501-5. [PubMed] [CrossRef] [Google Scholar]
42. Волински К., Стангерский А., Дырда К., Новицкая К., Пелка М. , Икбал А., Цар А., Лазизи М., Беднарек Н., Чарнивойтек А. и соавт. Риск злокачественных новообразований при акромегалии: исследование случай-контроль. Дж. Эндокринол. расследование 2017;40:319–322. doi: 10.1007/s40618-016-0565-y. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Икбал А., Цар А., Лазизи М., Беднарек Н., Чарнивойтек А. и соавт. Риск злокачественных новообразований при акромегалии: исследование случай-контроль. Дж. Эндокринол. расследование 2017;40:319–322. doi: 10.1007/s40618-016-0565-y. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Danilowicz K., Sosa S., Gonzalez Pernas M.S., Bamberger E., Dies S.M., Fainstein-Day P., Furioso A., Glerean M. ., Гительман М., Кац Д. и соавт. Акромегалия и рак щитовидной железы: анализ эволюции ряда пациентов. клин. Диабет Эндокринол. 2020;6:24. doi: 10.1186/s40842-020-00113-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Снижение и нерегулярность секреции тиреотропина с сохранением суточного ритма у больных с активной акромегалией. Дж. Клин. Эндокринол. Метаб. 2009 г.;94:1945–1950. doi: 10.1210/jc.2009-0174. [PubMed] [CrossRef] [Google Scholar]
45. Флиерс Э., Унмехопа Ю.А., Алкемаде А. Функциональная нейроанатомия обратной связи гормонов щитовидной железы в гипоталамусе и гипофизе человека.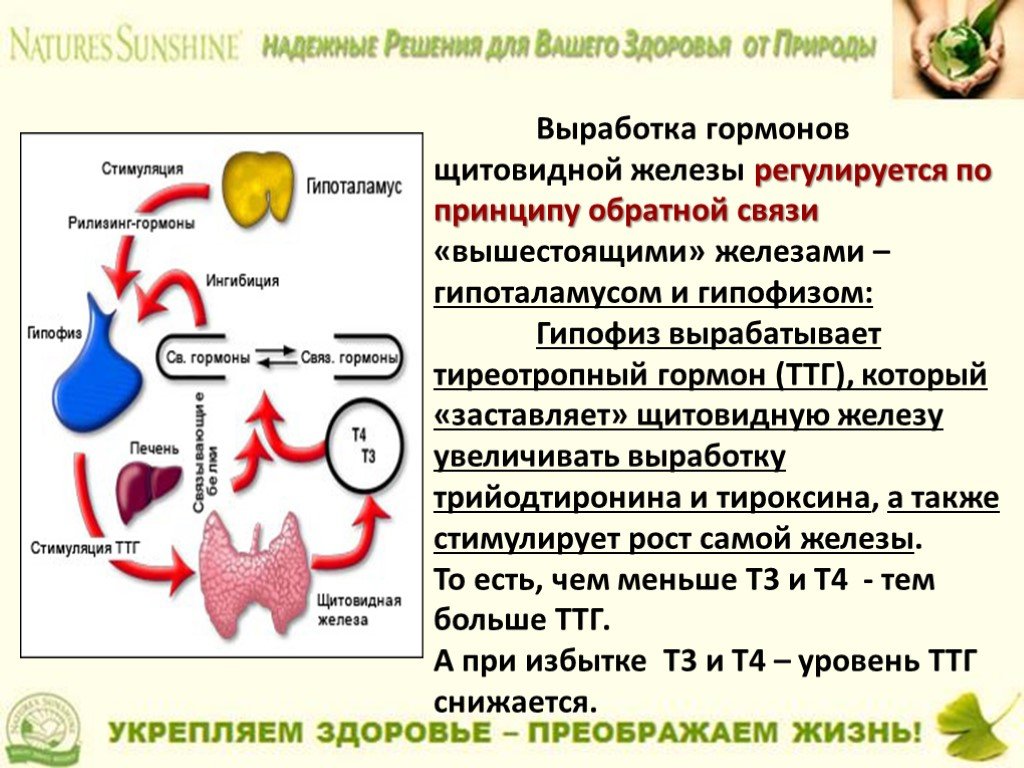 Мол. Клеточный эндокринол. 2006; 251:1–8. doi: 10.1016/j.mce.2006.03.042. [PubMed] [CrossRef] [Google Scholar]
Мол. Клеточный эндокринол. 2006; 251:1–8. doi: 10.1016/j.mce.2006.03.042. [PubMed] [CrossRef] [Google Scholar]
46. Мунички Г., Малозовски С., Нисула Б.К., Кристиано А., Роуз С.Р. Ночной всплеск тиреотропина у детей с дефицитом гормона роста. Дж. Педиатр. 1992;121:214–220. doi: 10.1016/S0022-3476(05)81191-6. [PubMed] [CrossRef] [Google Scholar]
47. Эден Энгстрем Б., Бурман П., Холдсток С., Карлссон Ф.А. Влияние гормона роста (ГР) на грелин, лептин и адипонектин у пациентов с дефицитом ГР. Дж. Клин. Эндокринол. Метаб. 2003; 88: 5193–5198. doi: 10.1210/jc.2003-030713. [PubMed] [CrossRef] [Google Scholar]
48. Лопес-Сигуэро Х.П., Лопес-Канти Л.Ф., Эспино Р., Каро Э., Фернандес-Гарсия Х.М., Гутьеррес-Масиас А., Риал Х.М., Лечуга Х.Л., Масиас Ф., Мартинес-Аэдо М.Дж. и др. Влияние рекомбинантного гормона роста на уровни лептина, адипонектина, резистина, интерлейкина-6, фактора некроза опухоли-α и грелина у детей с дефицитом гормона роста. Дж. Эндокринол. расследование 2011; 34:300–306. дои: 10.1007/BF03347090. [PubMed] [CrossRef] [Google Scholar]
дои: 10.1007/BF03347090. [PubMed] [CrossRef] [Google Scholar]
49. Matsuoka H., Fors H., Bosaeus I., Rosberg S., Albertsson-Wikland K., Bjarnason R. Изменения состава тела и уровня лептина в процессе роста Гормональная терапия (GH) у низкорослых детей с различной секреторной способностью GH. Евро. Дж. Эндокринол. 1999; 140:35–42. doi: 10.1530/eje.0.1400035. [PubMed] [CrossRef] [Google Scholar]
50. Glynn N., Kenny H., Quisenberry L., Halsall D.J., Cook P., Kyaw Tun T. Влияние замены гормона роста на ось щитовидной железы у пациентов с гипопитуитаризм: исследования in vivo и ex vivo. клин. Эндокринол. 2017; 86: 747–754. doi: 10.1111/cen.13272. [PubMed] [CrossRef] [Академия Google]
51. Hocquette J.F., Postel-Vinay M.C., Kayser C., De Hemptinne B., Amar-Costeses A. Рецептор гормона роста печени человека. Эндокринология. 1989; 125: 2167–2174. doi: 10.1210/endo-125-4-2167. [PubMed] [CrossRef] [Google Scholar]
52. MacLatchy D.L., Kawauchi H., Eales J.G. Стимуляция активности тироксин-5′-дейодиназы печени у радужной форели (Oncorhynchus mykiss) гормоном роста тихоокеанского лосося. Комп. Биохим. Физиол. Комп. Физиол. 1992; 101: 689–691. дои: 10.1016/0300-9629(92)90344-П. [PubMed] [CrossRef] [Google Scholar]
Комп. Биохим. Физиол. Комп. Физиол. 1992; 101: 689–691. дои: 10.1016/0300-9629(92)90344-П. [PubMed] [CrossRef] [Google Scholar]
53. Darras V.M., Rudas P., Visser T.J., Hall T.R., Huybrechts L.M., Vanderpooten A., Berghman L.R., Decuypere E., Kuhn E.R. Эндогенный гормон роста контролирует высокие уровни в плазме крови. 3,3′,5-трийодтиронина (Т3) у растущих цыплят за счет снижения активности дейодиназы III типа, разлагающей Т3. Дом. Аним. Эндокринол. 1993; 10:55–65. doi: 10.1016/0739-7240(93)
- -Y. [PubMed] [CrossRef] [Google Scholar]
54. Сальваторе Д., Ту Х., Харни Дж. В., Ларсен П. Р. Йодтирониндейодиназа типа 2 в высокой степени экспрессируется в щитовидной железе человека. Дж. Клин. расследование 1996;98:962–968. doi: 10.1172/JCI118880. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
55. Hussain M.A., Schmitz O., Jorgensen J.O., Christiansen J.S., Weeke J., Schmid C., Froesch E.R. Инсулиноподобный фактор роста I изменяет периферические Метаболизм гормонов щитовидной железы у людей: сравнение с гормоном роста. Евро. Дж. Эндокринол. 1996; 134: 563–567. doi: 10.1530/eje.0.1340563. [PubMed] [CrossRef] [Google Scholar]
Евро. Дж. Эндокринол. 1996; 134: 563–567. doi: 10.1530/eje.0.1340563. [PubMed] [CrossRef] [Google Scholar]
56. Клингер Б., Ионеско А., Анин С., Ларон З. Влияние инсулиноподобного фактора роста I на ось щитовидной железы у пациентов с карликовостью типа Ларона и здоровых предметы. Акта Эндокринол. 1992;127:515–519. doi: 10.1530/acta.0.1270515. [PubMed] [CrossRef] [Google Scholar]
57. Ван дер Лан Б.Ф., Фриман Дж.Л., Аса С.Л. Экспрессия факторов роста и рецепторов факторов роста в нормальных и опухолевых тканях щитовидной железы человека. Щитовидная железа. 1995; 5: 67–73. doi: 10.1089/thy.1995.5.67. [PubMed] [CrossRef] [Google Scholar]
58. Malaguarnera R., Frasca F., Garozzo A., Gianı F., Pandini G., Vella V., Vigneri R., Belfiore A. Изоформы рецепторов инсулина и инсулин -подобный рецептор фактора роста в предшественниках фолликулярных клеток человека из папиллярного рака щитовидной железы и нормальной щитовидной железы. Дж. Клин. Эндокринол. Метаб. 2011;96: 766–774.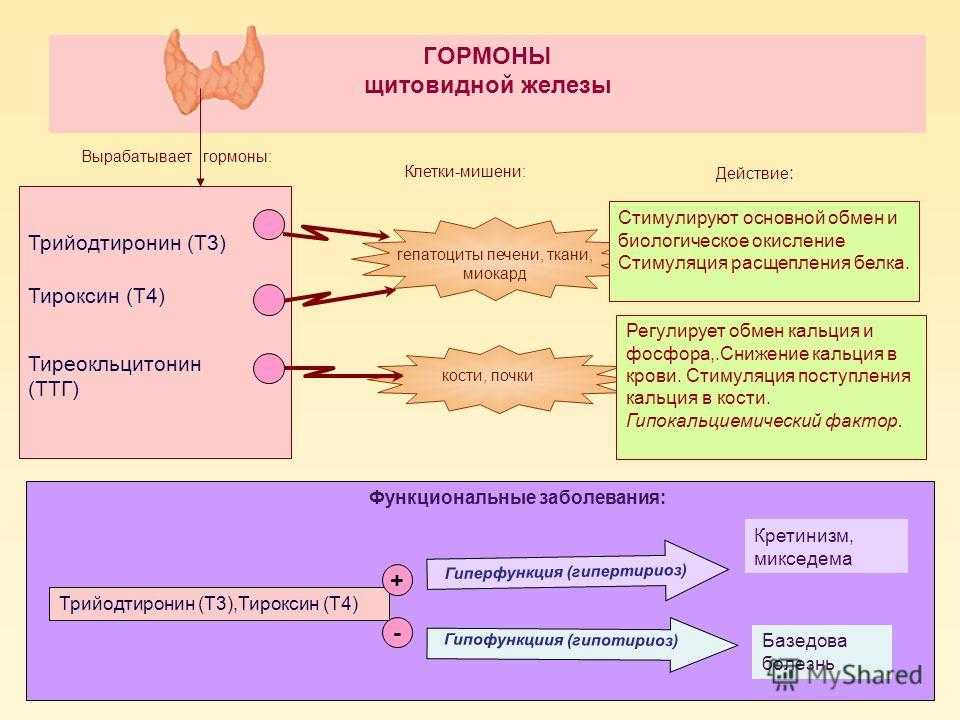 doi: 10.1210/jc.2010-1255. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1210/jc.2010-1255. [PubMed] [CrossRef] [Google Scholar]
59. Kimura T., van Keymeulen A., Golstein J., Fusco A., Dumont J.E., Roger P.P. Регуляция пролиферации клеток щитовидной железы с помощью ТТГ и других факторов: критическая оценка моделей in vitro. Эндокр. 2001; 22:631–656. doi: 10.1210/edrv.22.5.0444. [PubMed] [CrossRef] [Google Scholar]
60. Шао Ю.Ю., Ван Л., Баллок Р.Т. Гормон щитовидной железы и зона роста. Преподобный Эндокр. Метаб. Беспорядок. 2006; 7: 265–271. doi: 10.1007/s11154-006-9012-2. [PubMed] [CrossRef] [Google Scholar]
61. Susperreguy S., Muñoz L., Tkalenko N.Y., Mascanfroni I., Alamino V.A., Montesinos M., Masini-Repiso A.M., Miras M., Pellizas C. Гормон роста лечение детей с идиопатической низкорослостью: корреляция реакции роста с действием периферических гормонов щитовидной железы. клин. Эндокринол. 2011;74:346–353. doi: 10.1111/j.1365-2265.2010.03924.x. [PubMed] [CrossRef] [Google Scholar]
62. Wang W., Jiang S., Cui Z.

 Уровень Т3 в крови достоверно повышался и между 6-м и 12-м месяцем лечения (р < 0,001) (см. табл. 3, рисунок). Определена достоверная положительная корреляция уровня ИРФ-1 в крови и уровня Т3 на фоне лечения препаратом Биосома (г = 0,63; р < 0,01). Это позволяет полагать, что экзогенно вводимый ГР, увеличивая количество медиатора ИРФ-1 в крови, повышает также и уровень Т3 в крови.
Уровень Т3 в крови достоверно повышался и между 6-м и 12-м месяцем лечения (р < 0,001) (см. табл. 3, рисунок). Определена достоверная положительная корреляция уровня ИРФ-1 в крови и уровня Т3 на фоне лечения препаратом Биосома (г = 0,63; р < 0,01). Это позволяет полагать, что экзогенно вводимый ГР, увеличивая количество медиатора ИРФ-1 в крови, повышает также и уровень Т3 в крови.
 , Холл Р., Скэнлон М.Ф.
, Холл Р., Скэнлон М.Ф.

