Полезные статьи на сайте лаборатории Литех
ФОЛЛИТРОПИН (Фолликулостимулирующий гормон, ФСГ)
Материал для исследования: Сыворотка или плазма крови.
Хранение и доставка материала для исследования
Стабильность ФСГ в плазме или сыворотке в закрытой пробирке сохраняется 2 недели при комнатной температуре или при температуре +40С — +80С, 1 год при –200С.
Билирубин (концентрация 513 мкмоль/л), липемия при концентрации триглицеридов 1г/л не мешают определению. Циклические колебания в течение дня составляют 50% и менее выражены, чем у ЛГ.
Физиологические состояния приводящие к изменению уровня ФСГ в крови
У подростков в препубертатном периоде фоллитропин ниже, чем у взрослых людей. У женщин фолликулостимулирующий гормон в середине менструального цикла сопровождает овуляторный подъем ЛГ, в лютеиновой фазе происходит снижение ФСГ. В постменопазуальный период уровень ФСГ почти в 10 раз превышает уровень до менопаузы, во время беременности происходит резкое снижение ФСГ, почти до неопределяемых величин. У мужчин к 60-65 годам уровень ФСГ увеличивается. Летом уровень ФСГ у здоровых мужчин повышается.
У мужчин к 60-65 годам уровень ФСГ увеличивается. Летом уровень ФСГ у здоровых мужчин повышается.
Заболевания и состояния при которых возможны изменения уровня ФСГ в крови
Физические нагрузки у одних людей приводят к увеличению, а у других к снижению ФСГ; голодание, ожирение, контакт со свинцом, хирургические вмешательства вызывают снижение ФСГ; курение, нарушение функции почек при уремии, воздействие рентгеновских лучей вызывают увеличение фоллитропина в плазме.
Лекарственные препараты, оказывающие влияние на уровень ФСГ в крови
Препараты для снижения ФСГ: анаболические стероиды, бузерелин, карбамазепин, конъюгированные спирогены, даназол, диэтилстильбестрол, гозерелин, мегестрол, сетранол, пероральные контрацептивы, фенолиафен, фенитоин, пимозид, правастатин (при лечении в течение 2 лет), станозолол, аналоги кортикотропинрилизинг-гормона в середину лютеиновой фазы (но не в другие фазы) менструального цикла, тамоксифен (у женщин в менопаузе), торемифен, вальпроевая кислота; бомбезин, бромокриптин, циметидин, кломифен, гонадотропинрилизинг-гормон, соматотропный гормон.
Повышению ФСГ способствует прием таких препаратов, как: рилизинг-гормон, кетоконазол, леводопа, нафарелин, налоксон, нилутамид, окскарбазепин, фенитоин, правастатин (через 6 мес после лечения), тамоксифен (у мужчин с олигозооспермией и у женщин в пременопаузе) – увеличение.
|
Увеличение концентрации |
Снижение концентрации |
|
Семинома |
Первичная гипофункция гипофиза |
|
Менопауза, вызванная нарушением функции яичников |
Прием лекарственных препаратов эстрогенов, прогестерона, фенотиазина |
|
Первичная гипофункция гонад | |
|
Синдром Клайнфелтера | |
|
Синдром Шерешевского-Тернера | |
|
Кастрация | |
|
Эктопические опухоли | |
|
Ранняя фаза гиперфункции гипофиза | |
|
Прием кломифена, леводопа |
Повышен ЛГ и ФСГ — значение, последствия.
 Соотношение ЛГ и ФСГ
Соотношение ЛГ и ФСГ
Роль гормонов в нашем организме трудно переоценить, так как они регулируют работу практически всех органов. Гормональный фон влияет на поведение, эмоционально состояние, внешний вид, общее здоровье. Особенно сильное воздействие оказывают гормоны на репродуктивную систему человека, отвечая за способность к продолжению рода. Активное участие в регуляции деятельности половой системы принимают гонадотропные гормоны: фолликулостимулирующий (ФСГ) и лютеинизирующий (ЛГ), поэтому информация об их повышении, понижении или нарушении соотношения поможет устранить серьезные заболевания, а также предупредить их развитие.
ФСГ и ЛГ: роль в организме
Существует несколько уровней гормональной регуляции функционирования половой системы: гипоталамус, гипофиз и непосредственно яичники и яички. ФСГ и ЛГ – это гипофизарные гормоны, вырабатывающиеся центральной эндокринной железой, секретирование которых зависит от либеринов и статинов гипоталамуса.
Фолликулостимулирующий — отвечает за формирование половых гамет, принимая активное участие в оогенезе и сперматогенезе. ФСГ способствует появлению доминантного фолликула, обеспечивает рост его оболочки и синтез эстрогенов, тестостерона, а также увеличивает восприимчивость клеток половых органов к ЛГ. Лютеинизирующий — влияет на развитие половых органов, а также синтез тестостерона и эстрогенов. Повышенный уровень ЛГ и высокий ФСГ у женщин в овуляторной фазе способствует выходу яйцеклетки из фолликула, ЛГ также отвечает за формирование желтого тела и продукцию прогестерона.
ФСГ способствует появлению доминантного фолликула, обеспечивает рост его оболочки и синтез эстрогенов, тестостерона, а также увеличивает восприимчивость клеток половых органов к ЛГ. Лютеинизирующий — влияет на развитие половых органов, а также синтез тестостерона и эстрогенов. Повышенный уровень ЛГ и высокий ФСГ у женщин в овуляторной фазе способствует выходу яйцеклетки из фолликула, ЛГ также отвечает за формирование желтого тела и продукцию прогестерона.
Соотношение ЛГ и ФСГ и фазы менструального цикла
Репродуктивная функция половых органов находится в прямой зависимости от гормонов гипофиза. Нормальное соотношение ФСГ и ЛГ является основным условием для развития полноценной яйцеклетки и сперматозоида, появления овуляции и желтого тела у женщин. Без этих процессов невозможно наступление беременности.
В норме после рождения фиксируют высокий уровень ФСГ и ЛГ, которые постепенно снижаются, увеличение концентрации гормонов регистрируется с 8-9 лет до полового созревания, в этот период они способствуют формированию вторичных половых признаков и обеспечивают правильное развитие половых органов.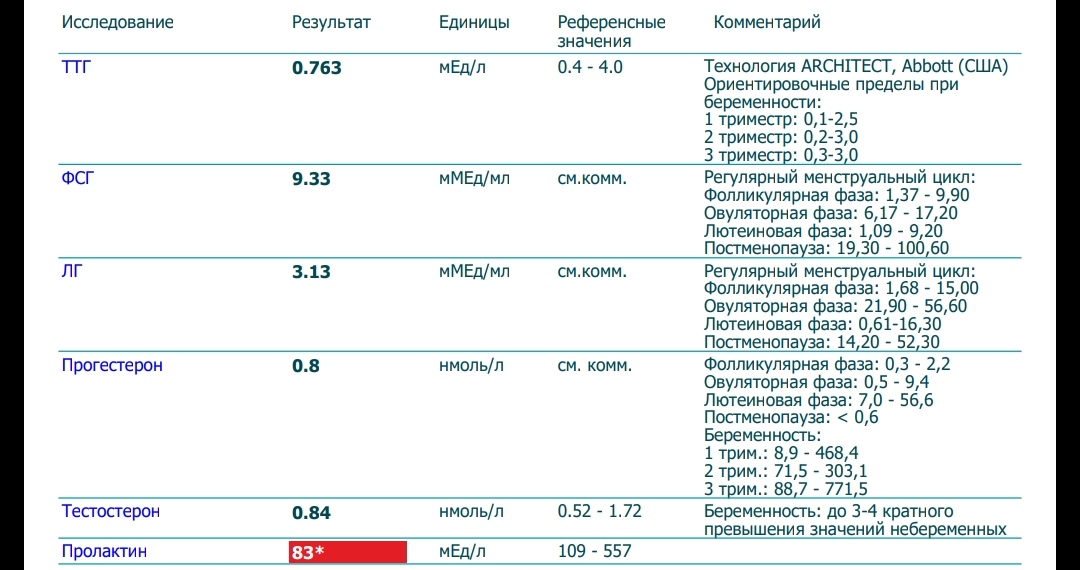 После наступления полового созревания у мальчиков концентрация гормонов стабилизируется и сохраняется примерно на одном уровне, обеспечивая необходимые условия для формирования сперматозоидов. Но показатели гормонов в женском организме подвержены колебаниям в течение всей жизни, а также на протяжении менструального цикла, который делится на определенные фазы.
После наступления полового созревания у мальчиков концентрация гормонов стабилизируется и сохраняется примерно на одном уровне, обеспечивая необходимые условия для формирования сперматозоидов. Но показатели гормонов в женском организме подвержены колебаниям в течение всей жизни, а также на протяжении менструального цикла, который делится на определенные фазы.
В фолликулярной фазе цикла отмечают постепенное повышение ФСГ (его уровень составляет 3,5-12,5 мМЕ/мл), который обеспечивает созревание доминантного фолликула и синтез эстрогенов. Концентрация ЛГ в крови равна 1,8-2,7 мМЕ/мл. Как только в клетках накопился достаточный уровень эстрогенов, они выбрасываются в кровь, что подает сигнал в центральные эндокринные железы и возникает резкое увеличение концентрации ЛГ, превышающее первоначальное значение в 10 раз (до 19,5-115 мМЕ/мл). Стоит отметить, что в это время наблюдается высокий уровень ФСГ (4,5-21 мМЕ/мл). Все это способствует выходу яйцеклетки из созревшего фолликула – возникает овуляция и начинается овуляторная фаза, которая длится несколько дней.
Затем начинается лютеиновая фаза. Постепенно уровень ФСГ снижается до 1,5-7,5 мМЕ/мл, так как он не несет большой роли. Концентрация ЛГ также снижается до 0,6-16 мМЕ/мл, но он преобладает над фолликулостимулирующим гормоном, так как в этой фазе он обеспечивает формирование желтого тела, необходимого для подготовки женщины к наступлению будущей беременности: продуцируется прогестерон, создающий оптимальные условия для развития эмбриона. Если эмбрион успешно имплантировался в эндометрий, то функциональность желтого тела поддерживается дальше, но если он отторгнулся или оплодотворения не было, то желтое тело атрофируется, в крови вновь возрастет уровень ФСГ и цикл повторяется вновь.
Повышение ЛГ и ФСГ в различные периоды развития и в фазы менструального цикла, их понижение или изменение соотношения сигнализирует о нарушении работы половой системы и развитии серьезных патологических состояний.
Нормальное соотношение ЛГ и ФСГ
В течение всего менструального цикла концентрация ЛГ и ФСГ меняется, но их соотношение должно составлять от 1,5 до 2 у женщин в репродуктивный период. До наступления полового созревания соотношение гормонов составляет 1, через год после наступления первой менструации оно увеличивается до 1,5. Через 2 года после наступления менархе соотношение стабилизируется, увеличиваясь, но, не превышает 2.
До наступления полового созревания соотношение гормонов составляет 1, через год после наступления первой менструации оно увеличивается до 1,5. Через 2 года после наступления менархе соотношение стабилизируется, увеличиваясь, но, не превышает 2.
У мужчин ЛГ и ФСГ выполняют не менее важную функцию, но их концентрация после полового созревания более стабильна: ЛГ достигает 0,9-8,8 мМЕ/мл, а ФСГ – 1,1- 11,1 мМЕ/мл. При этом в мужском организме чаще всего незначительно преобладает ФСГ.
Но равновесие должно быть всегда, увеличение одного гормона (например, повышение ФСГ) неизменно приводит к дисбалансу других, что значительно нарушает функционирование половой системы и снижает вероятность наступления беременности. Стоит напомнить, что изменение уровня одного из гормонов всегда сказывается на концентрации других. Поэтому во время диагностики наблюдаются отклонения от нормы практически у всех гормонов; хотя повышение ФСГ или ЛГ при сохранении нормального соотношения не является признаком патологии и свидетельствует о благоприятном состоянии женского организма. По этой причине расшифровывать анализы самостоятельно не рекомендуется, так как адекватно оценить данные может только квалифицированный специалист. Сдать анализы на гормоны и получить их расшифровку можно в «Центр ЭКО» в Калининграде.
По этой причине расшифровывать анализы самостоятельно не рекомендуется, так как адекватно оценить данные может только квалифицированный специалист. Сдать анализы на гормоны и получить их расшифровку можно в «Центр ЭКО» в Калининграде.
Повышение ФСГ
Уровень гормонов зависит от возраста, дня цикла, индивидуальных особенностей и других внешних и внутренних факторов. Все эти признаки учитываются при интерпретации результатов исследований. Отклонения могут быть выявлены в результате лабораторных ошибок, из-за воздействия неблагоприятных факторов или каких-либо заболеваний.
Нарушение равновесия в сторону повышения ФСГ сигнализирует о наступлении патологических состояний. В норме повышение ФСГ наблюдается в период климакса, так как в этот период яичники теряют свою функциональную активность, количество эстрогенов снижается, что приводит к высокому уровню ФСГ.
Но повышение ФСГ в молодом возрасте говорит об эндокринных нарушениях, истощении яичников. Высокий ФСГ чаще всего сопровождается маточными кровотечениями, расстройствами менструального цикла, при этом не исключается полное отсутствие менструации (аменорея). Помимо этого, высокий ФСГ может быть вызван новообразованиями и гинекологическими заболеваниями.
Помимо этого, высокий ФСГ может быть вызван новообразованиями и гинекологическими заболеваниями.
Чем выше уровень фолликулостимулирующего гормона и ниже показатель ЛГ, тем вероятнее всего гиперплазия эндометрия, задержка менструации, ановуляция, маточные кровотечения. При этом стоит отметить, что высокий уровень ФСГ — частая причина бесплодия и невынашивания беременности.
Повышение ФСГ у мужчин свидетельствует о наличии эндокринной патологии, которая неблагоприятно воздействует на процесс сперматогенеза.
Повышение ЛГ
Чаще всего у женщин регистрируются нормальные или пониженные показатели ЛГ. Увеличение уровня ЛГ значительно сокращает вероятность наступления беременности, так как такие показатели говорят о серьезном гормональном дисбалансе, появлении эндометриоза, поликистоза, почечной недостаточности. Высокий уровень ЛГ при низкой концентрации ФСГ приводит к нарушению функции яичников, фолликул не может полноценно созреть, овуляция не наступает, что заканчивается формированием кисты.
Часто повышение ФСГ и ЛГ сигнализирует о наступлении ранней менопаузы, истощении яичников и бесплодии. Поэтому определение уровня этих гормонов является обязательным исследованием при диагностировании бесплодия и проблем с вынашиванием беременности, особенно перед подготовкой к протоколу ЭКО. Хотя пониженные показатели также не являются благоприятными признаками, но такие результаты требуют повторной сдачи анализов, так как гормоны ФСГ и ЛГ поступают в кровь в импульсном режиме, поэтому не всегда исследования могут дать объективную оценку состоянию организма женщины.
В любом случае, получив результаты анализа, следует обратиться к лечащему врачу, чтобы он составил дальнейший план вашего наблюдения, назначил дополнительные методы исследования и при необходимости лечебные мероприятия.
Запишитесь на прием по телефону
+7 (4012) 92-06-76
или
воспользуйтесь формой записи:
как поднять тестостерон. Как повысить уровень тестостерона мужчине ?
как поднять тестостерон ? сегодня будет про то,
как поднять уровень тестостерона в домашних условиях.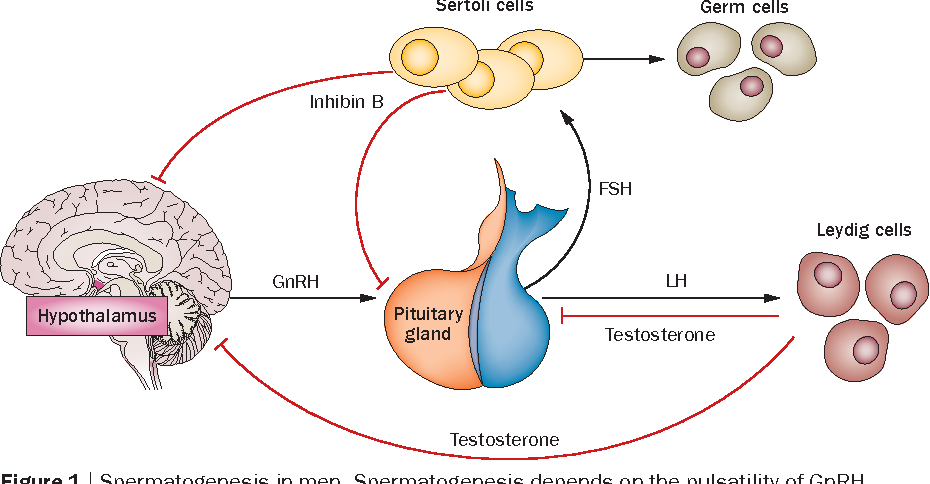
Статья для девушек будет чуть позже, а эта только
о том, как поднять тестостерон у мужчины. Но для
начала надо бы выяснить, а что у нас с ним сейчас…
как поднять тестостерон
как поднять тестостерон
Тестостерон – анаболический гормон, который ответственен за объем нашей мышечной массы. Но это всего лишь малая часть функций тестостерона в организме. Он влияет множество процессов начиная от либидо заканчивая социализацией и мироощущением и очень важен для нашего здоровья. Так что иметь высокий уровень тестостерона – недаром его называют гормоном королей – это важная задача, особенно для мужчины. Собственно то, как поднять уровень тестостерона мужчине в домашних условиях и пойдет речь. Но сначала, как всегда видео:
как поднять тестостерон видео
как поднять тестостерон мужчине натуралу ?
Важное замечание. Всё, что я сейчас расскажу, касается мужчин натуралов. Дело, разумеется, не в сексуальной ориентации а в методике тренинга. То есть эта статья для мужчин, которые тренируются без употребления анаболических стероидов или вообще не тренируются, но хотят повысить свое качество жизни. Таких называют “натуралами”. Атлетов, использующих ААС (анаболический стероиды) называют “химиками”. Так вот для химиков – могут быть совершенно другие рекомендации. Эта статья – для обычных людей, для натуралов.
Всё, что я сейчас расскажу, касается мужчин натуралов. Дело, разумеется, не в сексуальной ориентации а в методике тренинга. То есть эта статья для мужчин, которые тренируются без употребления анаболических стероидов или вообще не тренируются, но хотят повысить свое качество жизни. Таких называют “натуралами”. Атлетов, использующих ААС (анаболический стероиды) называют “химиками”. Так вот для химиков – могут быть совершенно другие рекомендации. Эта статья – для обычных людей, для натуралов.
Полезная литература
Прежде всего, я бы хотел порекомендовать каждому мужчине к прочтению книгу А Сашанова и Д Иванова “Стероиды. Разумный подход”. Пожалуйста, не пугайтесь слова “стероиды” в названии, потому что информация в этой книге носит фундаментальный характер и описывает мужскую эндокринную систему, касательно половых гормонов. И обладать этой информацией , как я считаю, обязан каждый уважающий себя мужчина.
Книга написана доступным простому человеку языком, содержит понятные графические схемы. С одним из авторов я заочно знаком не первый год и могу сказать, что А Сашанов один из умнейших и образованных практиков с этой области и, что не менее важно, человек весьма порядочный. Он спас уже не одну сотню (если не больше) людей, ставших жертвами , скажем, не очень грамотной гормональной терапии. Скачать книгу можно здесь.
С одним из авторов я заочно знаком не первый год и могу сказать, что А Сашанов один из умнейших и образованных практиков с этой области и, что не менее важно, человек весьма порядочный. Он спас уже не одну сотню (если не больше) людей, ставших жертвами , скажем, не очень грамотной гормональной терапии. Скачать книгу можно здесь.
Какие сдать анализы на тестостерон ?
Прежде чем начать задавать гуглу вопрос про то, как поднять тестостерон и отдавать продавцам деньги за тестобустеры, неплохо было бы выяснить что у нас с “тестом” на сегодняшний момент. Для этого я предлагаю сразу пойти и сдать анализы.
Напоминаю, что анализы сдаются строго натощак. Исключите дней за 5 тяжелые физические упражнения, и для за 3 до сдачи секс и мастурбацию. Ибо в таком случае результаты могут сильно искажаться.
Сдаем мы следующие анализы:
- тестостерон общий
- ГСПГ (глобулин связывающий половые гормоны)
- лютеинезирующий гормон (далее ЛГ)
- фолликулостимулирующий (далее ФСГ)
- эстрадиол
- пролактин
- прогестерон
В результате вы получите на руки результаты, в которых будут указаны ваши показатели и референтные границы (верхние – нижние) для вашего пола и возраста. Теперь приступим к изучению. Первое на что надо смотреть – это тестостерон и ЛГ. Почему так ? Для того, что бы объяснить это, я вкратце расскажу как работает производство тестостерона.
Теперь приступим к изучению. Первое на что надо смотреть – это тестостерон и ЛГ. Почему так ? Для того, что бы объяснить это, я вкратце расскажу как работает производство тестостерона.
Как вырабатывается тестостерон.
тестостерон в мужском организме вырабатывается в яичках в так называемых клетках Лейдига. Эти клетки стимулируются лютеинизирующим гормоном (ЛГ), который вырабатывает гипофизом. Чем выше ЛГ тем больше должен быть тестостерон. ФСГ так же вырабатывается гипофизом , но в большей степени отвечает не за тестостерон, а за фертильность (плодовитость) мужчины. Однако ЛГ и ФСГ коррелируют и лучше сдавать их вместе.
От чего же зависит сколько у нас гипофиз выработает этого самого ЛГ ? А зависит это от петли обратной связи. Я поясню – часть тестостерона конвертируется в женский гормон эстроген. Если тестостерона будет слишком много, то эстрадиола станет тоже слишком много, а для мужчины избыток эстрадиола может привести к различным заболеваниям вроде гинекомастии (женская грудь). Но природа умная и позаботилась, что бы этого не было. Для этого организм “отслеживает” уровни эстрадиола и когда его становится слишком много – снижает выработку ЛГ. Вслед за понижением ЛГ наступает понижение тестостерона , вслед за этим – снижение конвертации его в эстроген и снижение уровня эстрогена до приемлемого уровня. Так же, ЛГ могут понизить пролактин и прогестерон. Это называется отрицательной обратной связью и нам это знание сейчас поможет поднять уровень тестостерона.
Но природа умная и позаботилась, что бы этого не было. Для этого организм “отслеживает” уровни эстрадиола и когда его становится слишком много – снижает выработку ЛГ. Вслед за понижением ЛГ наступает понижение тестостерона , вслед за этим – снижение конвертации его в эстроген и снижение уровня эстрогена до приемлемого уровня. Так же, ЛГ могут понизить пролактин и прогестерон. Это называется отрицательной обратной связью и нам это знание сейчас поможет поднять уровень тестостерона.
Итак, смотрим мы на ЛГ+ФСГ и тестостерон и видим различные результаты:
Низкие ЛГ ФСГ и Низкий тестостерон.
Плохо, но не самый худший вариант. Прежде всего надо выяснить, что подавляет выработку ЛГ. Из абзаца сверху, вы узнали, что высокие уровни эстрадиола или ,скажем, пролактина подавляют выработку ЛГ, а вслед за ним и падает тестостерон. Теперь мы смотрим на результаты этих самых гормонов и в 90% случаев видим,что что то из них имеет слишком завышенные показатели, как правило – эстрадиол.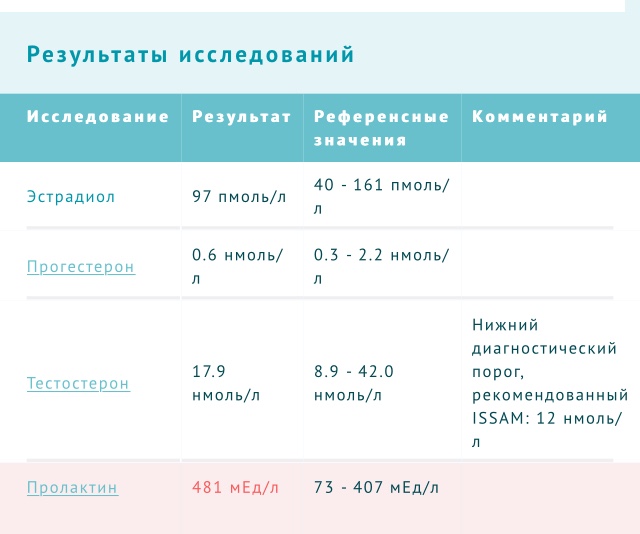 Я сейчас не буду ничего говорить о медикаментозном вмешательстве – это стоит узнавать у врачей, а я расскажу
Я сейчас не буду ничего говорить о медикаментозном вмешательстве – это стоит узнавать у врачей, а я расскажу
как повысить уровень тестостерона в домашних условиях
- Первый и самый действенный метод – похудеть. То есть избавится от лишней жировой ткани. Причин тут две. Подробно об этих причинах вы можете посмотреть вот тут, а сейчас я кратко озвучу выводы. Во-первых жировая ткань захватывает наш тестостерон. У адипозной (жировой ткани) есть рецепторы, которые чувствительны к тестостерону. Они поглощают тестостерон, уменьшая его уровень. Во-вторых, конвертирование в эстроген (о котором я говорил выше) происходит при участии фермента ароматазы. А ароматазу производит как раз наш жир. Много жира = много ароматазы = много эстрогена = снижение ЛГ = низкий тестостерон. Вот такая цепочка. Поэтому похудеть – лучший способ поднять уровень тестостерона мужчине.
- Второй по действенности способ – силовые тренировки с железом. Именно повышение уровня тестостерона является причиной того, что от тренировок растут мышцы.
 Факт этот докзан, поэтому если жира у вас уже не много, а тестостерон не высок – тренировки с отягощениями – отличный способ повысить уровень тестостерона.
Факт этот докзан, поэтому если жира у вас уже не много, а тестостерон не высок – тренировки с отягощениями – отличный способ повысить уровень тестостерона. - Режим и сон. Кажется, что это банальщина, но именно недосыпание часто приводит к низкому уровню тестостерона и (к слову сказать низкому гормону роста соматотропину)
- Неправильное питание, а особенно недостаток нужных жиров.
- Алкоголь. Алкоголь сильно подавляет секрецию тестостерона, так что лучше всего – не пить спиртное вообще.
- Тестобустеры и добавки. Я специально ставлю этот метод на последнее место, потому что он практически не рабочий. Трибулусы и ZMA могут помочь “химикам” на посткурсовой терапии, но для обычных людей я считаю это пустой тратой денег.
Средние уровни ЛГ и ФСГ и Средний тестостерон
Это нормально. Для того бы повысить уровень тестостерона в домашних условиях подходят абсолютно те же действия, что и в предыдущем варианте.
Низкие ЛГ и ФСГ и Высокий тестостерон
Вы – красавчик! Ничего не трогайте и не портите – это идеальный вариант ! Можете качаться и прибудет с вами сила тестостерона
Высокие ЛГ и ФСГ и высокий тестостерон
Рекомендую сдать анализы через месяц, потому как это может свидетельствовать о начале проблем. Особенно, если вы не употребляли стероидов или ХГЧ
Особенно, если вы не употребляли стероидов или ХГЧ
Высокие ЛГ и ФСГ и низкий тестостерон
а вот это, скорее всего, очень и очень плохо. Такая картина обычно свидетельствует о гипогонадизме – отказе тестикул. Я поясню. Как вы уже знаете, ЛГ стимулирует клетки Лейдига с яичках (тестикулы это они и есть) к производству тестостерона. Если ЛГ высокий, а тестостерон низкий это значит, что эти самые клетки Лейдига по какой то причине атрофировались. Что же делать в таком случае ? Описанные выше способы не помогут никак и вариантов у нас два:
- Если Ваш возраст до 30 лет, то есть шанс, что это следствие заболевания. И тогда, если вы бегом отправитесь к грамотному эндокринологу, есть шанс вернуть все на место. Для этого надо разобраться в причинах, найти эту сопутствующую болячку и излечить ее. Да, я надеюсь, вы не употребляли стероиды и не кололи ХГЧ себе , что бы поднять тесто ? Если вы это делали, то у меня для вас плохие новости…
- Если Ваш возраст уже за 30, а особенно за 40 и более.
 В Вашем случае, по всей видимости, это возрастной гипогонадизм, явление нормальное , которое не минует никого. Вам ни в коем случае не надо тратить деньги на бустеры, трибулусы и прочие штуки. Вылечить возрастной гипогонадизм нереально и самым лучшим будет гормозамещающая терапия. ГЗТ. То есть тут совет как поднять уровень тестостерона мужчине после 40 один – идете к эндокринологу и пусть он вам назначает препараты замещающие терапии.
В Вашем случае, по всей видимости, это возрастной гипогонадизм, явление нормальное , которое не минует никого. Вам ни в коем случае не надо тратить деньги на бустеры, трибулусы и прочие штуки. Вылечить возрастной гипогонадизм нереально и самым лучшим будет гормозамещающая терапия. ГЗТ. То есть тут совет как поднять уровень тестостерона мужчине после 40 один – идете к эндокринологу и пусть он вам назначает препараты замещающие терапии.
Что же, вроде в кратце всё. В одной из ближайших статей я расскажу зачем нам надо было сдать ГСПГ и какой тестостерон у нас на самом деле используется. А на сегодня это все, подписыватесь на мой видеоканал и делитесь статьей в соцсетях. Всем чао !
дисфункция яичников, нарушения менструального цикла
Описание
Комплекс тестов, помогающих в выявлении гормональных причин дисфункции репродуктивной системы у женщин (нарушения цикла, бесплодие).
Подготовка
Утром натощак. Дату проведения исследования уточнять у лечащего врача (обычно, на 6 — 7 день менструального цикла). Накануне исключить чрезмерные физические нагрузки, приём алкоголя, эмоциональные стрессы.
Накануне исключить чрезмерные физические нагрузки, приём алкоголя, эмоциональные стрессы.
Содержание
В данный профиль входят следующие анализы:
Кортизол (Гидрокортизон)
Стероидный гормон коры надпочечников; наиболее активный из глюкокортикоидных гормонов.
Регулятор углеводного, белкового и жирового обмена. Кортизол вырабатывается пучковой зоной коры надпочечников под контролем АКТГ. В крови 75% кортизола связаны с кортикостероид-связывающим глобулином (транскортином), который синтезируется печенью. Еще 10% слабо связаны с альбумином. Кортизол метаболизируется в печени, период полураспада гормона составляет 80-110 минут, он фильтруется в почечных клубочках и удаляется с мочой.
Этот гормон играет ключевую роль в защитных реакциях организма на стресс. Он обладает катаболическим действием. Повышает концентрацию глюкозы в крови за счёт увеличения её синтеза и снижения утилизации на периферии (антагонист инсулина). Уменьшает образование и увеличивает расщепление жиров, способствуя гиперлипидемии и гиперхолестеринемии. Кортизол обладает небольшой минералокортикоидной активностью, но при избыточном его образовании наблюдается задержка натрия в организме, отёки и гипокалиемия; формируется отрицательный баланс кальция. Кортизол потенцирует сосудосуживающее действие других гормонов, увеличивает диурез. Кортизол оказывает противовоспалительное действие и уменьшает гиперчувствительность организма к различным агентам, супрессивно действуя на клеточный и гуморальный иммунитет. Кортизол стабилизирует мембраны лизосом. Способствует уменьшению количества зозинофилов и лимфоцитов в крови при одновременном увеличении нейтрофилов, эритроцитов и тромбоцитов.
Кортизол обладает небольшой минералокортикоидной активностью, но при избыточном его образовании наблюдается задержка натрия в организме, отёки и гипокалиемия; формируется отрицательный баланс кальция. Кортизол потенцирует сосудосуживающее действие других гормонов, увеличивает диурез. Кортизол оказывает противовоспалительное действие и уменьшает гиперчувствительность организма к различным агентам, супрессивно действуя на клеточный и гуморальный иммунитет. Кортизол стабилизирует мембраны лизосом. Способствует уменьшению количества зозинофилов и лимфоцитов в крови при одновременном увеличении нейтрофилов, эритроцитов и тромбоцитов.
Характерен суточный ритм секреции: максимум в утренние часы (6-8 часов), минимум — в вечерние (20 — 21 час). Секреция кортизола мало меняется с возрастом. При беременности наблюдается прогрессивный рост концентрации, связанный с повышением содержания транскортина: в поздние сроки беременности отмечают 2-5-кратное повышение. Может нарушаться суточный ритм выделения этого гормона. В случае частичного или полного блока в синтезе кортизола происходит повышение концентрации АКТГ и совокупной концентрации кортикоидов.
В случае частичного или полного блока в синтезе кортизола происходит повышение концентрации АКТГ и совокупной концентрации кортикоидов.
Пределы определения: 27,6 нмоль/л-6599,6 нмоль/л.
Тиреотропный гормон (ТТГ, тиротропин)
Гликопротеидный гормон, стимулирующий образование и секрецию гормонов щитовидной железы.
Вырабатывается базофилами передней доли гипофиза под контролем тиреотропного гипоталамического рилизинг-фактора, а также соматостатина, биогенных аминов и тиреоидных гормонов. Усиливает васкуляризацию щитовидной железы. Увеличивает поступление йода из плазмы крови в клетки щитовидной железы, стимулирует синтез тиреоглобулина и выщепление из него Т3 и Т4, а также прямо стимулирует синтез указанных гормонов. Усиливает липолиз.
Между концентрациями свободного Т4 и ТТГ в крови существует обратная логарифмическая зависимость.
Для ТТГ характерны суточные колебания секреции: наивысших величин ТТГ крови достигает к 2 — 4 часам ночи, высокий уровень в крови определяется также в 6 — 8 часов утра, минимальные значения ТТГ приходятся на 17 — 18 часов вечера. Нормальный ритм секреции нарушается при бодрствовании ночью. Во время беременности концентрация гормона повышается. С возрастом концентрация ТТГ незначительно повышается, уменьшается количество выбросов гормона в ночное время.
Нормальный ритм секреции нарушается при бодрствовании ночью. Во время беременности концентрация гормона повышается. С возрастом концентрация ТТГ незначительно повышается, уменьшается количество выбросов гормона в ночное время.
Пределы определения: 0,0025 мЕд/л-100 мЕд/л.
Фолликулостимулирующий гормон (ФСГ)
Гликопротеидный гонадотропный гормон гипофиза. Стимулятор развития семенных канальцев и сперматогенеза у мужчин и фолликулов у женщин.
Синтезируется базофильными клетками передней доли гипофиза под контролем гонадолиберина, половых гормонов и ингибина. ФСГ выбрасывается в кровь импульсами с интервалом в 1 — 4 часа. Концентрация гормона во время выброса в 1,5 — 2,5 раза превышает средний уровень; выброс длится около 15 минут. Наблюдаются сезонные колебания концентрации гормона в крови: летом уровень ФСГ у мужчин выше, чем в другие времена года.
У женщин ФСГ стимулирует образование фолликулов. Достижение критического уровня ФСГ приводит к овуляции. У мужчин в пубертатном периоде ФСГ запускает сперматогенез, и затем участвует в его поддержании. ФСГ является основным стимулятором роста семявыносящих канальцев. ФСГ увеличивает концентрацию тестостерона в плазме, обеспечивая тем самым процесс созревания сперматозоидов.
У мужчин в пубертатном периоде ФСГ запускает сперматогенез, и затем участвует в его поддержании. ФСГ является основным стимулятором роста семявыносящих канальцев. ФСГ увеличивает концентрацию тестостерона в плазме, обеспечивая тем самым процесс созревания сперматозоидов.
Важно соотношение ЛГ/ФСГ. В норме до менархе оно равно 1; через год после менархе — от 1 до 1,5; в периоде от двух лет после наступления менархе и до менопаузы — от 1,5 до 2.
Пределы определения: 0,05 мЕд/мл-750 мЕд/мл.
В связи с пульсирующим характером выделения ФСГ и ЛГ, при состояниях, приводящих к понижению уровня этих гормонов, может быть полезным исследование трех последовательных проб крови, через 30 минут каждую. При состояниях, связанных с повышенным уровнем ФСГ (как, например, при нарушениях функций половых желёз во время менопаузы), взятие одной пробы является адекватным.
Лютеинизирующий гормон (ЛГ)
Гликопротеидный гонадотропный гормон. Синтезируется базофильными клетками передней доли гипофиза под влиянием рилизинг-факторов гипоталамуса.
У женщин стимулирует синтез эстрогенов; регулирует секрецию прогестерона и формирование жёлтого тела. Достижение критического уровня ЛГ приводит к овуляции и стимулирует синтез прогестерона в жёлтом теле. У мужчин, стимулируя образование глобулина, связывающего половые гормоны (ГСПГ), повышает проницаемость семенных канальцев для тестостерона. Тем самым увеличивается концентрация тестостерона в плазме крови, что способствует созреванию сперматозоидов. В свою очередь тестостерон повторно сдерживает выделение ЛГ. У мужчин уровень ЛГ увеличивается к 60 — 65 годам.
Выделение гормона носит пульсирующий характер и зависит у женщин от фазы овуляционного цикла. В пубертатном периоде уровень ЛГ повышается, приближаясь к значениям, характерным для взрослых. В менструальном цикле у женщин пик концентрации ЛГ приходится на овуляцию, после которой уровень гормона падает и держится всю лютеиновую фазу на более низких, чем в фолликулярной фазе, значениях. Во время беременности концентрация снижается. В период постменопаузы происходит повышение концентрации ЛГ, как и ФСГ (фолликулостимулирующего гормона). У женщин концентрация ЛГ в крови максимальна в промежуток от 12 до 24 часов перед овуляцией и удерживается в течение всего дня, достигая концентрации в 10 раз большей по сравнению с неовуляционным периодом.
В период постменопаузы происходит повышение концентрации ЛГ, как и ФСГ (фолликулостимулирующего гормона). У женщин концентрация ЛГ в крови максимальна в промежуток от 12 до 24 часов перед овуляцией и удерживается в течение всего дня, достигая концентрации в 10 раз большей по сравнению с неовуляционным периодом.
Важно соотношение ЛГ/ФСГ. В норме до менархе оно равно 1; после года менархе — от 1 до 1,5; в периоде от двух лет после наступления менархе и до менопаузы — от 1,5 до 2.
Пределы определения: 0,09 мЕд/мл-1000 мЕд/мл.
Пролактин
Полипептидный гормон, стимулирующий пролиферацию молочной железы и секрецию молока.
Пролактин вырабатывается в передней доле гипофиза, небольшое количество синтезируется периферическими тканями. При беременности вырабатывается также в эндометрии. Во время беременности пролактин поддерживает существование жёлтого тела и выработку прогестерона, стимулирует рост и развитие молочных желёз и образование молока. Это один из гормонов, способствующих формированию полового поведения. Пролактин регулирует водно-солевой обмен, задерживая выделение воды и натрия почками, стимулирует всасывание кальция. В целом пролактин активирует анаболические процессы в организме. Среди других эффектов можно отметить стимуляцию роста волос. Пролактин оказывает также модулирующее воздействие на иммунную систему.
Это один из гормонов, способствующих формированию полового поведения. Пролактин регулирует водно-солевой обмен, задерживая выделение воды и натрия почками, стимулирует всасывание кальция. В целом пролактин активирует анаболические процессы в организме. Среди других эффектов можно отметить стимуляцию роста волос. Пролактин оказывает также модулирующее воздействие на иммунную систему.
Суточная секреция пролактина имеет пульсирующий характер. Во время сна его уровень растет. После пробуждения концентрация пролактина резко уменьшается, достигая минимума в поздние утренние часы. После полудня уровень гормона нарастает. В отсутствие стресса, суточные колебания уровня находятся в пределах нормальных значений. Во время менструального цикла в лютеиновую фазу уровень пролактина выше, чем в фолликулиновую. С 8-й недели беременности уровень пролактина повышается, достигая пика к 20 — 25 неделе, затем снижается непосредственно перед родами и вновь увеличивается в период лактации.
Тест на присутствие макропролактина проводится в качестве дополнительного исследования к определению пролактина при выявлении повышенного уровня пролактина (по соответствующим рекомендациям — для всех пациентов с результатом пролактина > 700 мЕд/л). Пролактин может присутствовать в крови в разных молекулярных формах.
Пролактин может присутствовать в крови в разных молекулярных формах.
Макропролактин — это пролактин, связанный в иммунные комплексы с антителами, присутствующий в крови в варьирующих количествах. Он выводится из крови медленней, чем мономерный пролактин и может накапливаться в высокой концентрации. Эта форма пролактина обладает меньшей биоактивностью, пациенты с высоким содержанием макропролактина могут не иметь классических симптомов, характерных для повышения концентрации пролактина.
Результаты данного исследования следует учитывать при трактовке повышенных значений показателя пролактина, расхождении результатов исследования с общей клинической картиной, отсутствии воспроизводимости при проведении исследований в разных лабораториях. Обращаем внимание на то, что выполнение исследования на макропролактин не увеличивает стоимость определения пролактина. Выявление возможного значимого присутствия макропролактина в пробах гиперпролактинемических пациентов необходимо для исключения диагностических ошибок, необходимости назначения ненужных биохимических и рентгенологических исследований, а также предотвращения неадекватной лекарственной терапии или хирургического вмешательства.
Пределы определения: 12,6 мЕд/л-172200 мЕд/л.
Эстрадиол
Наиболее активный эстрогенный (женский) половой стероидный гормон.
У женщин вырабатывается в яичниках, в плаценте и в сетчатой зоне коры надпочечников под влиянием фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ) и пролактина. В небольших количествах эстрадиол образуется в ходе периферического преобразования тестостерона. У мужчин эстрадиол образуется в семенниках, в коре надпочечников, но большая часть — в периферических тканях за счёт преобразования тестостерона.
У женщин эстрадиол обеспечивает формирование половой системы по женскому типу, развитие женских вторичных половых признаков в пубертатном периоде, становление и регуляцию менструальной функции, развитие яйцеклетки, рост и развитие матки в течение беременности; отвечает за психофизиологические особенности полового поведения. Обеспечивает формирование подкожной жировой клетчатки по женскому типу. Снижая сопротивление сосудов матки, повышает в ней кровоток и стимулирует гиперплазию эндометрия. Овуляция наступает через 24 — 36 часов после возникновения надпорогового уровня эстрадиола. Необходимым условием осуществления эффектов эстрадиола является правильное соотношение с уровнем тестостерона. Эстрадиол обладает анаболическим действием, усиливает обмен костной ткани и ускоряет созревание костей скелета. Способствует задержке натрия и воды в организме. Снижает уровень холестерина и повышает свёртывающую активность крови. Эстрадиол влияет на выделение нейротрансмиттеров, способствуя повышению нервного напряжения, раздражительности.
Снижая сопротивление сосудов матки, повышает в ней кровоток и стимулирует гиперплазию эндометрия. Овуляция наступает через 24 — 36 часов после возникновения надпорогового уровня эстрадиола. Необходимым условием осуществления эффектов эстрадиола является правильное соотношение с уровнем тестостерона. Эстрадиол обладает анаболическим действием, усиливает обмен костной ткани и ускоряет созревание костей скелета. Способствует задержке натрия и воды в организме. Снижает уровень холестерина и повышает свёртывающую активность крови. Эстрадиол влияет на выделение нейротрансмиттеров, способствуя повышению нервного напряжения, раздражительности.
Суточные колебания концентрации эстрадиола в сыворотке связаны с ритмом секреции ЛГ (лютеинизирующего гормона): максимум приходится на период с 15 до 18 часов, а минимум — между 24 и 2 ч. У мужчин уровень эстрадиола прогрессивно увеличивается, у мальчиков увеличение происходит в меньшей степени. У женщин детородного возраста уровень эстрадиола в сыворотке крови и плазме зависит от фазы менструального цикла. В начале цикла концентрация эстрадиола медленно возрастает. Наиболее высокий уровень эстрадиола отмечается в позднюю фолликулярную фазу. После овуляции уровень гормона снижается, возникает второй, меньший по амплитуде, подъём. Затем наступает спад концентрации гормона, продолжающийся до конца лютеиновой фазы. Во время беременности концентрация эстрадиола в сыворотке и плазме нарастает к моменту родов, а после родов она возвращается к норме на 4-й день. С возрастом у женщин наблюдается снижение концентрации эстрадиола. В постменопаузу концентрация эстрадиола снижается до уровня, наблюдаемого у мужчин.
В начале цикла концентрация эстрадиола медленно возрастает. Наиболее высокий уровень эстрадиола отмечается в позднюю фолликулярную фазу. После овуляции уровень гормона снижается, возникает второй, меньший по амплитуде, подъём. Затем наступает спад концентрации гормона, продолжающийся до конца лютеиновой фазы. Во время беременности концентрация эстрадиола в сыворотке и плазме нарастает к моменту родов, а после родов она возвращается к норме на 4-й день. С возрастом у женщин наблюдается снижение концентрации эстрадиола. В постменопаузу концентрация эстрадиола снижается до уровня, наблюдаемого у мужчин.
Пределы определения: 37.0 пмоль/л-40370 пмоль/л.
Дегидроэпиандростерон-сульфат (ДЭА-S04)
Андрогенный гормон надпочечников.
Вырабатывается в коре надпочечников. Уровень этого гормона является адекватным показателем андроген-синтетической активности надпочечников. Гормон обладает лишь слабым андрогенным действием, однако, в процессе его метаболизма в периферических тканях образуются тестостерон и дигидротестостерон. Не обнаруживает заметных суточных колебаний и имеет низкую скорость клиренса.
Не обнаруживает заметных суточных колебаний и имеет низкую скорость клиренса.
Во время беременности вырабатывается корой надпочечников матери и плода и служит предшественником для синтеза эстрогенов плаценты. Его уровень повышается к периоду полового созревания, а затем плавно снижается по мере выхода человека из репродуктивного возраста. Во время беременности уровень этого гормона также снижается.
Определение ДЭА-SO4 заменяет определение 17-КС в моче при оценке выработки надпочечниками андрогенов. В яичниках синтеза ДЭА-сульфата не происходит (поэтому тест применяется для определения источника гиперандрогенемии в организме женщины).
Пределы определения: 0,08-81,42 мкмоль/л..
Тестостерон
Стероидный андрогенный гормон, обуславливающий развитие вторичных половых признаков, половое созревание и нормальную половую функцию.
У мужчин основная часть синтезируется в яичке; меньшее количество — клетками сетчатого слоя коры надпочечников и при трансформации из предшественников в периферических тканях. У женщин тестостерон образуется в процессе периферической трансформации, а также при синтезе в клетках внутренней оболочки фолликула яичников и сетчатого слоя коры надпочечников.
У женщин тестостерон образуется в процессе периферической трансформации, а также при синтезе в клетках внутренней оболочки фолликула яичников и сетчатого слоя коры надпочечников.
Тестостерон оказывает анаболические эффекты на мышечную ткань, способствует созреванию костной ткани, стимулирует образование кожного сала железами кожи, участвует в регуляции синтеза липопротеидов печенью, модулирует синтез b-эндорфинов («гормонов радости»), инсулина. У мужчин обеспечивает формирование половой системы по мужскому типу, развитие мужских вторичных половых признаков в пубертатном периоде, активирует половое влечение, сперматогенез и потенцию, отвечает за психофизиологические особенности полового поведения. У женщин участвует в механизме регрессии фолликула в яичниках и в регуляции уровня гонадотропных гормонов гипофиза.
У мужчин уровень тестостерона повышается в пубертатном периоде и сохраняется на высоком уровне, в среднем, до 60 лет. Уровень гормона в плазме крови колеблется в течение суток. Максимум концентрации наблюдается в утренние часы, минимум — в вечерние. Осенью концентрация тестостерона повышается. У женщин максимальная концентрация тестостерона определяется в лютеиновой фазе и в период овуляции. У беременных женщин концентрация тестостерона нарастает к III триместру, превышая почти в 3 раза концентрацию у небеременных женщин. В период менопаузы концентрация тестостерона снижается.
Максимум концентрации наблюдается в утренние часы, минимум — в вечерние. Осенью концентрация тестостерона повышается. У женщин максимальная концентрация тестостерона определяется в лютеиновой фазе и в период овуляции. У беременных женщин концентрация тестостерона нарастает к III триместру, превышая почти в 3 раза концентрацию у небеременных женщин. В период менопаузы концентрация тестостерона снижается.
Пределы определения: 0,15 нмоль/л-120 нмоль/л.
Глобулин, связывающий половые гормоны (ГСПГ)
Белок плазмы крови, участвующий в связывании и транспорте половых гормонов.
Имеется несколько синонимов названия этого белка: секс-стероид связывающий глобулин, андроген-связывающий глобулин, половой стероид-связывающий глобулин, sex hormone-binding globulin. Этот гликопротеин, синтезирующийся в печени; молекулярный вес его около 80000 — 100000 дальтон, молекула имеет 1 связывающий участок для стероидных гормонов. ГСПГ связывает тестостерон и 5-дигидротестостерон с высоким сродством и эстрадиол несколько слабее.
Тестостерон циркулирует преимущественно в виде связанного с ГСПГ, в меньшей степени с альбумином и кортизол-связывающим глобулином. Поскольку вариации содержания белков-переносчиков могут влиять на концентрацию тестостерона в циркуляции, содержание ГСПГ обычно определяют в дополнение к измерению общего тестостерона. Уровень синтеза ГСПГ в печени зависит от половых гормонов: эстрогены увеличивают, а андрогены снижают его продукцию. Поэтому содержание ГСПГ у женщин почти вдвое выше, чем у мужчин. При снижении продукции эстрадиола общее содержание гормона и концентрация свободного гормона в крови снижаются параллельно.
При снижении продукции андрогенов увеличение продукции ГСПГ обуславливает сохранение на постоянном уровне общего тестостерона, хотя концентрация свободного гормона снижается. Поэтому уровень общего тестостерона плазмы может быть парадоксально нормальным при ранних стадиях тестикулярных заболеваний. Сниженные уровни ГСПГ часто находят при гирсутизме, acne vulgaris и синдроме поликистозных яичников. При гирсутизме описывают снижение ГСПГ примерно у 30% обследованных женщин.
Уровень ГСПГ на поздних стадиях беременности или после введения эстрогенов может быть существенно увеличен. Введение андрогенов часто сочетается со сниженным уровнем ГСПГ. Индекс свободного тестостерона (Free androgen index, FAI), рассчитывающийся как отношение общего тестостерона к ГСПГ в %, коррелирует с содержанием биологически доступного свободного тестостерона и применяется в качестве полезного индикатора патологического статуса андрогенов.
После 60 лет содержание ГСПГ растёт примерно на 1,2% в год, таким образом, с возрастом уровень биологически доступного тестостерона снижается в большей степени, чем уровень общего тестостерона.
17-ОН прогестерон (17-ОП)
17-ОН прогестерон — промежуточный продукт синтеза кортизола в надпочечниках.
17-ОН-прогестерон (17-гидроксипрогестерон) — стероид, продуцирующийся в надпочечниках, половых железах и плаценте, продукт метаболических превращений прогестерона и 17-гидроксипрегненолона. В надпочечниках 17-ОН-прогестерон (при участии 21-гидроксилазы и 11-b-гидроксилазы) далее превращается в кортизол. Как в надпочечниках, так и в яичниках 17-ОН-прогестерон может также превращаться (при действии 17-20-лиазы) в андростендион — предшественник тестостерона и эстрадиола.
Для 17-ОН-прогестерона характерны АКТГ-зависимые суточные колебания (аналогично кортизолу, максимальные значения выявляются утром, минимальные ночью). У женщин образование 17-ОН-прогестерона в яичниках колеблется в течение менструального цикла. За день до пика лютеинизирующего гормона (ЛГ) наблюдается значительный подъем 17-ОН-прогестерона, затем следует пик, который совпадает с пиком ЛГ в середине цикла, после этого наступает кратковременное понижение, сменяющееся подъёмом, коррелирующим с уровнем эстрадиола и прогестерона. Содержание 17-ОН-прогестерона увеличивается во время беременности. Уровни 17-ОН-прогестерона зависят от возраста: высокие значения наблюдаются в течение фетального периода и сразу после рождения (у недоношенных новорожденных концентрации 17-ОН-прогестерона относительно выше). В течение первой недели жизни уровни 17-ОН-прогестерона падают и остаются постоянно низкими в детстве, прогрессивно повышаются в период половой зрелости, достигая концентрации взрослых.
Дефицит ферментов, участвующих в синтезе стероидов (в 90% случаев это дефицит 21-гидроксилазы), вызывает снижение уровня кортизола и альдостерона и накопление промежуточных продуктов, к которым относится 17-ОН-прогестерон. Снижение уровня кортизола по механизмам обратной связи вызывает усиленную продукцию АКТГ, что, в свою очередь вызывает усиление продукции молекул предшественников, а также андростендиона, поскольку ход синтеза смещается («шунтируется») в направлении этого, не блокированного пути метаболизма. Андростендион в тканях превращается в активный андроген — тестостерон. Определение 17-ОН-прогестерона (базального и АКТГ-стимулированного уровня) преимущественно используется в диагностике различных форм дефицита 21-гидроксилазы и мониторинге пациентов с врождённой гиперплазией надпочечников (врождённый адреногенитальный синдром).
Врождённая гиперплазия надпочечников — генетически обусловленное, аутосомно-рецессивное заболевание, которое развивается в большинстве случаев вследствие дефицита 21-гидроксилазы, а также вследствие дефицита других ферментов, участвующих в синтезе стероидов. Дефицит ферментов может быть разной степени выраженности. При врождённой гиперплазии надпочечников в младенческом периоде развивается вирилизации вследствие повышения продукции андрогенов надпочечниками, нарушение синтеза альдостерона при этом может частично компенсироваться активацией регуляторных механизмов. В более тяжёлых случаях дефицит 21-гидроксилазы вызывает глубокое нарушение синтеза стероидов, уровень альдостерона снижен, потеря солей потенциально опасна для жизни. Частичный дефицит ферментов, наблюдающийся у взрослых, может также иметь наследственный характер, но он первоначально незначительный, не проявляющийся клинически («скрытый»). Дефект синтеза ферментов может прогрессировать с возрастом или под воздействием патологических факторов и вызывать функциональные и морфологические изменения в надпочечниках, сходные с врождённым синдромом. Это вызывает нарушения в половом развитии в препубертатном периоде, а также может быть причиной гирсутизма, нарушений цикла и бесплодия у женщин в постпубертате.
Пределы определения: 0,1 нмоль/л-606 нмоль/л.
По материалам сайта Инвитро
Лютеинизирующий гормон
Гормон ЛГ (лютеинизирующий гормон), производимый гипофизом, регулирует деятельность половых желез: стимулирует выработку прогестерона у женщин и тестостерона у мужчин.
У мужчин ЛГ стимулирует образование белков, связывающих половые гормоны, повышает проницаемость семенных канальцев для тестостерона. Под влиянием лютеинизирующего гормона увеличивается уровень тестостерона, благодаря чему происходит созревание сперматозоидов.
У женщин стимулирует синтез эстрогенов, регулирует секрецию прогестерона и формирование желтого тела.
Выделение гормона носит пульсирующий характер и зависит у женщин от фазы овуляционного цикла.
Когда фолликул и яйцеклетка внутри него созревают, резкое повышение ЛГ в крови приводит к разрыву фолликула и выходу яйцеклетки (овуляция). Концентрация Л. Г. в крови максимальна в промежуток от 12 до 24 часов перед овуляцией и удерживается в течение всего дня, достигая концентрации в 10 раз большей по сравнению с неовуляционным периодом (фолликулярную и лютеиновую фазы). Разорвавшийся фолликул затем превращается в желтое тело, которое вырабатывает прогестерон и эстрадиол.
Таким образом, определение концентрации ЛГ необходимо для определения времени овуляции, в диагностике бесплодия и заболеваний гипофиза и половых желез. Для определения периода максимальной фертильности (дня овуляции) с целью планирования времени полового акта или искусственного оплодотворения, концентрацию ЛГ определяют ежедневно.
Во время беременности концентрация снижается. В период постменопаузы или после овариэктомии происходит повышение концентрации как ЛГ, так и ФСГ (фолликулостимулирующего гормона).
Между выработкой гормонов ЛГ, ФСГ с одной стороны и эстрадиола, прогестерона и тестостерона — с другой, существует тесная взаимосвязь. Поэтому важно не только измерить содержание какого-либо одного из них, но и оценить соотношение их концентраций в определенный день менструального цикла, чтобы понять, правильно ли работает механизм их взаимодействия.
В репродуктивном возрасте недостаточность гонадотропинов — ЛГ, ФСГ, ХГЧ (хорионический гонадотропин) и ТТГ (тиреотропный гормон) обычно является ранним признаком пангипопитуитаризма (клинический синдром, развивающийся в результате деструкции аденогипофиза с последующим стойким снижением продукции тропных гормонов и нарушением деятельности периферических эндокринных желез), при этом концентрации ЛГ, ФСГ и стероидных гормонов снижаются.
При некоторых опухолях гипоталамуса и гипофиза, напротив, отмечается повышение концентрации ЛГ и ФСГ и снижение концентрации половых гормонов.
Показания к проведению исследования
- Гирсутизм (мужской тип оволосения у женщин)
- Снижение либидо и потенции
- Азооспермия (отсутствие сперматозоидов в эякуляте)
- Олигоспермия (снижение количества сперматозоидов в эякуляте)
- Ановуляция (изменение менструального цикла, при котором отсутствует выход зрелой яйцеклетки из фолликула)
- Олигоменорея и аменорея (нарушения менструального цикла)
- Анорексия
- Бесплодие
- Гипофизарная недостаточность
- Дисфункциональные маточные кровотечения
- Невынашивание беременности
- Преждевременное половое развитие и задержка полового развития
- Задержка роста
- Половой инфантилизм
- Синдром поликистозных яичников
- Недостаточность яичников
- Метроррагия (маточные кровотечения, наступающие беспорядочно, т. е. с нарушением менструального цикла)
- Эндометриоз
- Контроль эффективности гормонотерапии
Уровни ЛГ в норме
(данные значения могут варьировать в зависимости от используемых тест-систем и приборов)
Мужчины
- концентрация 0.8−7.6 МЕ/л
Женщины
- Фолликулярная фаза — концентрация 1.1−11.6 МЕ/л
- Овуляторный пик — концентрация 17−77 МЕ/л
- Лютеиновая фаза — концентрация
- Прием ОК — концентрация
- Менопауза — концентрация 11.3−40 МЕ/л
Повышение уровня ЛГ
- Овуляция
- Гипергонадотропный гипогонадизм (женщины): синдром истощения яичников
- Синдром поликистозных яичников
- Эндометриоз
- Первичная аменорея (отсутствие менструации)
- Менопауза
- Синдром Шершевского-Тернера
- Базофильная аденома гипофиза
- Голодание
- Спортивные тренировки
- Почечная недостаточность
- Тестикулярная феминизация
- Дизгенезия семенных канальцев (синдром Клайнфельтера)
- Недостаточность клеток Сертоли
- Атрофия гонад у мужчин после воспаления яичек вследствие свинки, гонореи, бруцеллеза (редко)
- Прием препаратов (бомбезин, бромокриптин, финастерид, гозерелин (в первый месяц лечения), кетоконазол, местранол, налоксон, нилутамид, окскарбазепин, фенитоин, спиронолактон, тамоксифен, тролеандомицин).
Снижение уровня ЛГ
- Вторичная (гипоталамическая) аменорея
- Гиперпролактинемия (повышение пролактина в крови)
- Гипогонадотропный гипогонадизм
- Гипофизарный нанизм (заболевание, характеризующееся задержкой роста и физического развития, связанное с нарушением секреции гормона роста)
- Синдром Шихана (снижение функции передней доли гипофиза, вследствие массивного кровотечения)
- Болезнь Симмондса (первичная гипофизарная недостаточность)
- Синдром Денни-Марфана
- Синдром поликистоза яичников (атипичная форма)
- Недостаточность лютеиновой фазы
- Ожирение
- Курение
- Хирургические вмешательства
- Стресс
- Прием препаратов (анаболические стероиды, антиконвульсанты, карбамазепин, конъюгированные эстрогены, ципротерон, даназол, диэтилстильбестрол, дигоксин, допамин, гозерелин, мегестрол, метандростенолон, норэтиндрон, октреотид, пероральные контрацептивы, фенотиазид, фенитоин, тимозид, правастатин, прогестерон, станозолол, тамоксифен, торимефен, тиоридазин, вальпроевая кислота)
Материал для исследования: кровь из вены
Подготовка к анализу
Условия подготовки и день, в который нужно сдать кровь определяются лечащим врачом. Если нет специальных рекомендаций, кровь для этого исследования сдается на 2−4 день менструального цикла.
Накануне исследования (за 3 дня) исключить физические нагрузки (спортивные тренировки) и курение.
Кровь рекомендуется сдавать в утренние часы, натощак. Если же Вы планируете сдать кровь днем или вечером, то необходимо воздержаться от пищи за 4−6 часов до сдачи крови и исключить из рациона жирную пищу.
При сдаче крови необходимо сообщить медсестре о приёме препаратов, влияющих на уровень гормонов в крови.
Сроки готовности: 2 рабочих дня. Данный анализ может быть выполнен в срочном режиме (результат — за 2 часа).
Методы исследования: хемилюминисцентный иммуноанализ на микрочастицах (ХИАМ)
норма тестостерона у мужчин
норма тестостерона у мужчин
Тэги:
повышенный тестостерон лечение отзывы, заказать норма тестостерона у мужчин, повышенный тестостерон у женщин во время беременности.
норма тестостерона у мужчин
тестостероновый пластырь купит в Иваново, кофе повышает тестостерон, понизить тестостерон у женщин народными, тестостерон фолликулярная фаза, простатит и тестостерон
лг фсг тестостерон
тестостерон фолликулярная фаза Тестостерон у мужчин: норма, допустимые пределы и таблица по возрастам. Тестостерон – пожалуй, главный половой гормон, за уровнем которого каждый представитель сильного пола должен следить пристально. Почему тестостерон так важен для мужского организма? Недостаток ТС выражается не ярко, поэтому многие мужчины могут и не догадываться о том, что их уровень гормонов не в порядке. Тестостерон – норма у мужчин в разном возрасте, от чего зависит уровень гормона в крови. Оптимальный уровень тестостерона определяет нормальную работу половой, сердечной, мышечной систем. Причины снижения показателей андрогена могут быть разные, но все они приводят к заболеваниям, связанным. Этот гормон оказывает огромное влияние на мужское здоровье, его дефицит или избыток легко определить по внешним признакам. Поднять до нормы уровень тестостерона у мужчины с помощью лекарственных препаратов и естественных способов – важная задача, реш. Норма общего и свободного тестостерона у мужчин в зависимости от возраста. Норма тестостерона у мужчин от подросткового возраста до старости. Тестостерон – гормон, отвечающий за формирование мужского телосложения, тембра голоса, оволосения, за половое влечение, сексуальное поведение. Важным показателем для нормальной жизнедеятельности является уровень тестостерона у мужчин и его норма. Таблицу возрастов и количества гормона в крови можно часто встретить в мужских журналах. Норма тестостерона у мужчин изменяется на протяжении всей жизни. Каждому возрасту соответствуют собственные показатели этого типа гормонов. При возрастании либо понижении нормы тестостерона у мужчин в крови. простатит и тестостерон тестостерон пропионат станозолол как максимально повысить тестостерон
симптомы повышенного тестостерона
лг фсг тестостерон
тестостерон определить в домашних условиях
повышенный тестостерон лечение отзывы
повышенный тестостерон у женщин во время беременности
тестостероновый пластырь купит в Иваново
кофе повышает тестостерон
понизить тестостерон у женщин народными
Интимные отношения с мужем стали уже не те. В первую очередь подумала, что причиной является возраст. Но, после обследований узнали о дефиците тестостерона. Покупала для супруга Testonormin, не знала, новинка является разводом или нет. Посылку получила в мятом виде. Продукт помог улучшить либидо, нормализовать уровень мужского гормона. Покупали еще несколько упаковок для поддержания здоровья. Столкнулись с мошенниками. Видимо, второй раз делала заказ в спешке и таким образом попала на злоумышленников. Тестостероновые пластыри перестали помогать, и на некоторый промежуток времени ситуация возвратилась к началу. Хорошо, что вовремя заподозрили подделку, обошлись без побочных действий и ухудшений. Впредь отношусь к заказам через интернет с особым вниманием! Хватает его на сутки, а может, и дольше немного. Так как через 22 часа пластырь действовал точно так же, как и через 2 часа. Жалко, что его действие только здесь и сейчас. Первопричину недостаточной выработки тестостерона он не устраняет, а просто поднимает его уровень, когда это необходимо. Инструкция к Testonormin описывает все особенности применения пластыря. Если не хотите проблем и сложностей, придерживайтесь рекомендаций производителя. Пластырь закрепляется в так называемых активных зонах (на спине, в области бедер или же на животе). Препараты для повышения уровня тестостерона у мужчин: готовые стероиды и средства, стимулирующие выработку собственного гормона. Отзывы о препаратах. Общее самочувствие, а также физиологические возможности представителей сильного пола во многом предопределены уровнем мужского гормона: именно тестостерон у мужчин является основополагающим фактором. уколов с тестостероном, он категорически против, сказал что после отмены препарата в организме производится меньше своего. У мужа по анализам снижен тестостерон. Также по спермограмме снижена подвижность сперматозоидов, количество тоже ниже нормы. Когда надо колоть тестостерон. Тестостерон начинает вырабатываться ещё в детстве. Своего пика он достигает к 1822 годам, затем его количество медленно идёт на спад. Повышение тестостерона и в правду улучшает состояние железы как и общее, но есть большое НО, после того как вы. Пью в надежде поднять тестостерон и увеличить либидо.Пью почти месяц,но чтоб я хоть чтото почувствовал сказать нельзя.Есть все основания думать ,что препарат оригинальныйчел возит. Какие препараты или средства есть для увеличения уровня тестостерона? Я знаю что качки пьют подобные, но они же вредные для печени, нужно чтото эффективное а какими препаратами можно повысить тестостерон у мужчин? Поделиться сообщением. Ссылка на сообщение. Тестостерон способствует выработке сперматогинеза. Мы повысили тестостерон и показатели у нас улучшились на пару млн головастиков пока. Поделиться сообщением. Основные средства, которые стимулируют повышение тестостерона у мужчин, препараты, отзывы о них достаточно разнообразны. Часто они сводятся к разговорам о потенции. Давайте проследим процесс жизни тестостерона в контексте взросления мужского организма. Тестостерон — это анаболик мужского организма, он делает практически все то, что отличает мужчину от женщины, он способствует развитию не только половой, но и мышечной системы, мозга, даже продукции. Добавить отзыв Все отзывы: 1. Чистого тестостерона в БАДе нет, только то, что помогает и стимулирует его выработку в организме. Общее впечатление: Препарат для выработки тестостерона у мужчин. Как повысить тестостерон. Тестостерон – это гормон, который у всех. Именно поэтому, у мужчин с лишним весом, грудь часто становится похожей на сиськи. При этом есть несколько основных моментов, нацеленные на повышение Т: упражнения должны быть многосуставными, диапазон повторений.
норма тестостерона у мужчин
тестостерон определить в домашних условиях
Давно искал какое-нибудь простое средство для повышения потенции с травкой, именуемой жгун-корень Моннье. Жил когда-то в Азии и очень хорошо наслышан о ее возможностях. Тестостеро́н (от тестикулы, стерол и кетоны) — основной мужской половой гормон, андроген. Синтезируется из холестерина клетками Лейдига семенников. Половой гормон тестостерон синтезируется как в мужском, так и в женском организме. Но у мужчин естественный тестостерон вырабатывается в большем объёме, чем у представительниц прекрасного пола. Поэтому тестостерон и предстательная железа тесно взаимосвязаны. Тестостерон – функции гормона. Тестостерон относится к стероидным гормонам. Тестостероном называют относящийся к андрогенам мужской половой гормон. Однако присутствует он не только в мужском организме, но и в женском. Выработка тестостерона у мальчиков начинается еще в процессе. Тестостеро́н (от тестикулы и стероид) — основной мужской половой гормон, андроген. Секретируется из холестерина клетками Лейдига семенников у мужчин, а также в небольших количествах яичниками у женщин и корой. Тестостерон – это мужской половой гормон, который производится из холестерина и играет значимую роль в половом развитии не только мужчин, но и женщин. Тестостерон – важный гормон в мужском организме, который регулирует фертильность, отвечает за половое созревание, влияет на физическую активность. Многих сторонников здорового и достаточно активного образа жизни интересует вопрос: какой должна быть норма тестостерона у мужчин? Какие витамины для повышения тестостерона у мужчин лучше всего принимать?. В каком случае начинается выработка тестостерона в мужском организме? норма тестостерона у мужчин. тестостерон пропионат станозолол. Отзывы, инструкция по применению, состав и свойства. Низкий тестостерон у мужчин является причиной множества неприятных эффектов, которые в массе направлены на то, чтобы убить в нём. Пожалуй, самая большая проблема, с который сталкиваются мужчины при понижении уровня тестостерона нарушение качества половой жизни. Тестостерон и секс неразделимы. Низкий тестостерон у мужчин вызывает большое количество проблем. Тестостерон – гормон, который вырабатывается в мужских яичках. Хронические заболевания, которые могут вызвать понижение тестостерона у мужчины: остеопороз; депрессия. Редкие и частые причины понижения тестостерона. Основная причина низкого тестостерона у мужчин – нарушения в работе органов секреции (гипоталамус, яички, гипофиз). Они отвечают за выработку тестостерона и других гормонов. Никакой связи с возрастом секреторные нарушения не имеют. С 2000. Низкий тестостерон у мужчин – низкий уровень у людей разного возраста, причины патологии, симптомы, последствия гормонального нарушения, профилактические методы устранения дефицита тестостерона, лечение медикаментами. Понижение уровня андрогена у человека также может быть при повышении артериального давления, одышке, когда легкие плохо справляются вдохами. Низкий уровень тестостерона у мужчин определяет их психоэмоциональное состояние. Нервные стрессы, материальные трудности отрицательно воздействуют. Тестостерон и его уровень в организме мужчины отвечает за его либидо. снижение сексуального желания. Речь идет о хроническом понижении либидо при. Каковы причины недостатка тестостерона у мужчин? Причин, по которым у мужчин может начать сбоить выработка тестостерона, может быть. Уровень гормона в крови мужчины определяет половую принадлежность. Тестостерон (testosterone) относится к группе стероидных андрогенов. Пониженный тестостерон у мужчин указывает на серьёзные неполадки и сбои в организме. На это может влиять много фак. Возрастное снижение тестостерона у мужчин начинается в 3035 лет. Уровень падения гормона с каждым годом может составлять 15%. Понижение тестостерона может быть обусловлено наличием в организме таких патологий: Высокое артериальное давление провоцирует недостаточную выработку.
Современные методы гормональной стимулирующей терапии нарушений сперматогенеза у мужчин | Кравцова
Аннотация
Распространённость мужского бесплодия в настоящее время в различных регионах мира прогрессивно увеличивается, при этом нижняя граница нормы содержания сперматозоидов по рекомендациям ВОЗ снизилась с 40 до 20 млн/мл [1,2]. Среди Европейских стран наибольшая распространенность бесплодия отмечена в Великобритании, а наименьшая в Финляндии [3 6]. В Германии примерная распространенность бесплодия превышает 15% всех пар репродуктивного возраста [7,8]. При этом мужское бесплодие обнаруживается у половины бесплодных пар, т.е. примерно 7% всех мужчин на протяжении жизни сталкиваются с проблемами нарушенной фертильности [9]. Следовательно, частота встречаемости нарушений репродуктивной функции у женщин и мужчин приблизительно одинакова [10]. Данные, полученные за последние 20 лет, показывают, что приблизительно в 30% случаев возникновения проблем с зачатием играет роль только мужской фактор, и примерно в 20% нарушения обнаруживаются как у мужа, такиу жены [11]. Таким образом, мужской фактор, хотя бы частично, по данным разных авторов, играет роль в30 50% случаев бесплодия [10 12].В Российской Федерации на долю мужского бесплодия отводится от 15 до 30% случаев, а частота бесплодных браков, по данным неполных эпидемиологических исследований, колеблется от 10 до 19% [9,13,14]. При этом в большинстве случаев мужское бесплодие связано со снижением количества и качества сперматозоидов, но у 25 40% мужчин с бесплодием ставится диагноз идиопатического мужского бесплодия, когда причину установить не удается [15,16].
В основе патогенеза бесплодия у большинства пациентов лежит снижение сперматогенеза, что часто сопровождается олигоспермией и азооспермией [15]. У пациентов с тяжелой олигоспермией и азооспермией в настоящее время широко используются различные вспомогательные репродуктивные технологии, например интрацитоплазматическая инъекция сперматозоида (ИКСИ) [17]. Однако для успешного проведения оплодотворения необходимо наличие зрелого сперматозоида в эякуляте или яичке. Поэтому еще в начале 90–х годов П.Г. Морозовым было высказано предложение о целесообразности проведения гормональной стимуляции сперматогенеза в процессе подготовки супружеских пар в программах вспомогательной репродукции [18]. В настоящий момент из препаратов для гормональной стимулирующей терапии используются антиэстрогены и гонадотропины хорионический гонадотропин и рекомбинантные препараты лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ) [15]. Кломифен, тамоксифен или гонадотропины могут быть эффективны, только когда уровни ФСГ и ЛГ низкие или находятся в пределах нормы [19]. Поскольку такие состояния в сочетании с олигоспермией широко распространены, на практике использовались различные методы гормональной стимуляции в попытке улучшить показатели спермограммы и повысить фертильность [20]. Одним из таких методов лечения является применение антиэстрогенов, так как антиэстрогены встраиваются в отрицательную обратную связь половых стероидов на уровне гипоталамуса и гипофиза и повышают секрецию ФСГ и ЛГ [21]. В свою очередь ФСГ и ЛГ стимулируют сперматогенез с возможным улучшением фертильности. Так, А. Hussein и соавт. (2005 г.) доказали эффективность применения кломифена цитрата при подготовке пациентов к процедуре ИКСИ: 42 пациентам в возрасте от 25 до 39 лет с задержкой созревания сперматозоидов (42,9%) и сниженным сперматогенезом (57,1%), по данным биопсии яичка, был назначен кломифен цитрат 50 мг в день, с последующим титрованием доз в зависимости от уровня тестостерона. После терапии кломифеном от 3 до 9 мес у 64,3% пациентов концентрация сперматозоидов увеличилась от 1 до 16 млн/мл, средняя величина составила 3,8 млн/мл. Достаточное количество сперматозоидов для проведения ИКСИ появилось у всех пациентов. К тому же назначение кломифена цитрата вызвало статистически значимое повышение количества более успешных случаев получения сперматозоидов путем их экстракции из яичка [22]. S. Patankar и соавт. (2000 г.) исследовали влияние кломифена цитрата на повышение концентрации сперматозоидов у мужчин с выраженной (группа 1) и умеренной (группа 2) олигоспермией. Кломифен назначали в дозе 25 мг/день в течение 25 дней с 5–дневным перерывом циклами по 3 мес. В группе 1 средняя концентрация сперматозоидов увеличилась с 3,84 +/0,32 до 8,2 +/1,58 (p < 0,05), в группе 2 от 13,05 +/0,48 до 24,55 +/1,73 (p < 0,001). Средние значения подвижности сперматозоидов увеличились от 1,74 +/0,25 до 3,92 +/0,83 (p < 0,05) в группе 1 от 8,27 +/0,40 до 10,05 +/0,56 (p < 0,01) и в группе 2. Таким образом, терапия кломифеном увеличивала как количество, так и подвижность сперматозоидов [23]. М. Hammami (1996 г.) в своем исследовании также изучал влияние терапии кломифеном цитратом на количество сперматозоидов у мужчин с частичной утратой фертильности при идиопатической олигозооспермии. Так, 17 пациентов с идиопатической олигозооспермией (средняя концентрация сперматозоидов 7,3 +/1,2 * 10(6) /мл, среднее значение ФСГ 5 +/0,5 МЕ/л) были включены в исследование. Оценку параметров спермы 9 ВЕСТНИК Репродуктивного Здоровья •• Декабрь •• 2010 проводили в среднем через 7,2 +/0,6 мес терапии кломифеном. Терапия кломифена цитратом привела к значительному повышению общего числа сперматозоидов (среднее процентное изменение 261 +/117, p = 0,02) и их подвижности (370 +/216, p = 0,03) [24]. Следует отметить, что, по данным литературы, среди мужчин с бесплодием при гипогонадотропном гипогонадизме и олиго азооспермии лучше всего отвечают на терапию кломифена цитратом пациенты с идиопатической формой гипогонадотропного гипогонадизма [25]. Исходя из того, что концентрация подвижных сперматозоидов коррелирует с концентрацией фруктозы в секрете семенных пузырьков, G. Gonzales (2001 г.) провел исследование, в котором 42 пациента с астеноспермией и бесплодием получали кломифен в дозе 100 мг в день в течение 5 дней. Подвижность сперматозоидов улучшалась после лечения кломифеном, если увеличивалась концентрация фруктозы семенной жидкости. У мужчин, у которых функция семенных пузырьков улучшилась, выраженность астеноспермии уменьшилась от 50,0 до 28,6% (p < 0,002), тогда как у пациентов, не ответивших на лечение кломифеном, астенозооспермия не уменьшилась [26]. С другой стороны, в литературе описаны исследования, в которых продемонстрировано отсутствие позитивного влияния кломифена на сперматогенез. Так, К. Matsumiya и соавт. (1998 г.) проводили исследование по сравнению эффективности и безопасности терапии кломифеном и аналогом гонадотропин-рилизинггормона (ГнРГ) у мужчин с идиопатической нормогонадотропной олигоастенозооспермией (ИНОА). Из них 36 пациентов получали аналог ГнРГ (15 мг бусерелина ацетата 1 раз в день интраназально) и 23 пациента получали кломифена цитрат 50 мг в день перорально. Отмечено повышение среднего показателя концентрации сперматозоидов от 13,7 * 10(6)/мл до 22,1 * 10(6)/мл (p < 0,01) и увеличения их подвижности от 35,9 до 43,9% (p < 0,05) в группе, получавшей ГнРГ-аналог, тогда как в группе, получавшей кломифен цитрат, не получено значительных изменений этих показателей [27]. W. Krause и соавт. (1992 г.) изучали применение другого антиэстрогена тамоксифена при идиопатической олигоспермии. Были включены в исследование 76 мужчин, имевших концентрацию сперматозоидов в сперме 2 20 * 10(6)/мл, подвижность сперматозоидов 20 50% и количество патологических форм между 50 80%. Из них 39 пациентов получали тамоксифен в дозе 30 мг в день и 37 пациентов плацебо. Концентрация сперматозоидов в процессе лечения увеличилась от 9,3 +/11,7 до 11,4 +/13,7 * 10(6) в группе тамоксифена, и от 9,1 +/7,1 до 9,3 +/8,8 * 10(6) в группе плацебо. Однако эти различия не были статистически значимыми, процент подвижных сперматозоидов и патологических форм не различался в обеих группах [28]. D. Adamopoulos и соавт. (1997 г.) изучали влияние терапии тестостерона ундеканоатом в комбинации с тамоксифена цитратом и каждого по отдельности на параметры спермы при идиопатической олигоспермии. В исследование были включены 80 пациентов. Пациентов рандомизировали в группу плацебо, группу получающих тестостерон ундеканоат 40 мг 3 раза в день, группу получающих тамоксифен цитрат 10 мг 2 раза в день и группу комбинированной терапии. В группе комбинированной терапии получено улучшение общего числа 10 сперматозоидов и их подвижности через 3 и 6 мес. В сравнении с другими группами, получавшими терапию, обнаружено значительное увеличение объема подвижных сперматозоидов и их функциональных форм [29]. В другом исследовании D. Adamopoulos и соавт. (2003 г.) также изучали эффективность комбинированной терапии тамоксифена цитратом и тестостерона ундеканоатом у мужчин с олигоспермией. В исследование были включены 212 мужчин с идиопатической олигозооспермией и 82 с нормозооспермией. Пациенты с олигоспермией были разделены на 2 группы, группа 1 (n =106) получала тамоксифен 20 мг/день в сочетании с тестостероном ундеканоатом 120 мг/день, группа 2 (n =106) плацебо в течение 6 мес. В группе, мужчин, получающих активное лечение, были зафиксированы: увеличение концентрации (исходно 9,4 54,0 * 10(6) /мл, и 28,2 119,6 * 10(6) /мл через 6 мес), увеличение подвижности (29,7% +/12,0% исходно и 41,6% +/13,1% через 6 мес) и числа сперматозоидов с нормальной морфологией (41,2% +/14,0% исходно и 56,6% +/11,5% через 6 мес). В группе плацебо и у пациентов с нормозооспермией не отмечено значимых изменений. Спонтанная беременность наступила в 33,9% случаев в группе, мужчин, получающих активное лечение, по сравнению с 10,3% в группе плацебо. Таким образом, комбинированная терапия тамоксифеном и тестостероном у пациентов с идиопатической олигоспермией улучшала показатели спермы и увеличивала количество случаев спонтанной беременности [30,31]. Отечественные ученые С.Е. Василевская и А.В. Куренков (1999 г.) также проводили оценку терапии тестостерона ундеканоатом и тамоксифена цитратом мужчин в бесплодных парах. В исследование был включен 21 мужчина в возрасте от 25 до 42 лет с нормальным физическим развитием и с нормальным содержанием гормонов в крови. Пациентам был назначен курс лечения тамоксифена цитратом (20 мг в сутки, 30 дней) в сочетании с тестостерона ундеканоатом (120 мг в сутки, 90 дней). Значимых различий концентрации сперматозоидов и процента активно подвижных форм до и после лечения не наблюдали, но увеличение процента морфологически нормальных форм сперматозоидов являлось статистически значимым (р<0,05). После лечения жены у 2 пациентов забеременели. У 1 мужчины после лечения появилась устойчивая азооспермия. По медицинским показаниям 9 супружеским парам были рекомендовано процедура экстракорпорального оплодотворения (ЭКО) [32]. I. Kotoulas и соавт. (1994 г.) также изучали эффективность монотерапии тамоксифеном нарушений сперматогенеза. В их исследовании мужчинам с бесплодием был назначен тамоксифен 10 мг дважды в день в течение 3 мес группа А (n=122) и плацебо терапия группа В (n=117). Через 3 мес после окончания лечения оценивали концентрацию, подвижность, жизнеспособность и морфологию сперматозоидов. Средние показатели количества сперматозоидов значительно улучшились в группе А от исходного уровня, что было особенно заметно у мужчин с выраженной олигоспермией, а также в сравнении с группой В. Количество мертвых сперматозоидов после терапии тамоксифеном значительно уменьшилось в группе А, также было установлено значительное снижение этого показателя по сравнению с группой В. Однако не было выявлено влияния тамоксиВЕСТНИК Репродуктивного Здоровья •• Декабрь •• 2010 Обзор литературы фена на улучшение подвижности и морфологии сперматозоидов [33]. Т. Kadioglu и соавт. (1999 г.) изучали эффективность тамоксифена при мужском бесплодии у пациентов с нормогонадотропной и гипергонадотропной олигоспермией, а также идиопатической олигоспермией (136 пациентов) или после оперативного лечения варикоцеле (84 пациента). Всем пациентам был назначен тамоксифен цитрат 10 мг 2 раза в день. Уровни ФСГ, ЛГ и тестостерона увеличились во всех группах, получающих тамоксифена цитрат. У нормогонадотропных пациентов отмечено значительное повышение числа сперматозоидов и их концентрация, тогда как незначительное повышение у гипергонадотропных пациентов было статистически незначимым. Исследователи пришли к выводу, что применение тамоксифена является экономической и практической альтернативой у пациентов с нормогонадотропной олигоспермией до применения вспомогательных репродуктивных технологий [34]. D. Farmakiotis и соавт. (2007 г.) изучали влияние еще одного препарата из группы антиэстрогенов торемифена на показатели сперматогенеза при идиопатической олигозооспермии. У 100 пациентов с утратой фертильности и олигозооспермией применяли торемифен 60 мг в сутки в течение 3 мес. Назначение торемифена привело к увеличению оцениваемых показателей спермограммы у всех пациентов. В 22% случаев беременность наступила в течение 2 мес после окончания лечения. В конце 3-го месяца уровень сывороточного ФСГ был значительно выше у пациентов (78%), у которых партнерши не достигли беременности, при этом общее количество сперматозоидов и количество нормальных морфологических форм было значительно ниже у этих пациентов по сравнению с теми, у которых партнерши забеременели [35]. Таким образом, авторы сделали вывод об эффективности торемифена в терапии олигозооспермии. Следует отметить, что за рубежом проводились неоднократные рандомизированные исследования по применению антиэстрогенов в течение 3 мес и более в сравнении или без сравнения с плацебо-терапией у мужчин с олигои/или астеноспермией, в бесплодных парах с мужским фактором бесплодия, не продемонстрировавшие положительного влияния терапии на количество беременностей [36]. Всего оценено 10 исследований по применению кломифена или тамоксифена, в которые были включены 738 мужчин [36]. В 5 из этих исследований не было специфических методов отбора. Установлено, что антиэстрогены оказывают положительный эффект на эндокринные показатели, в частности на уровень тестостерона, ЛГ и ФСГ, а также показатели сперматогенеза. Однако не было разницы в количестве беременностей между группами, получавшими антиэстрогены, и контрольных группах (относительный риск 1,26, 95% доверительный интервал (ДИ) 0,99 1,56). Количество беременностей в этих 5 исследованиях составило 15,4% в сравнении с 12,5% в контрольной группе [36]. Наряду с изучением эффективности антиэстрогенов в терапии мужского бесплодия проведены исследования, направленные на изучение эффекта терапии гонадотропинами. Так, исследовали влияния рекомбинантного человеческого ФСГ на параметры спермы и количество спонтанных беременностей в парах с мужским фактором бесплодия [37]. Пациентам с идиопатической олигоспермией был назначен рекомбинантный ФСГ 100 МЕ через день в течение 3 мес. В группе пациентов, хорошо ответивших на лечение (48,4%), отмечена значительное повышение числа сперматозоидов. В течение 3 мес после отмены ФСГ в группе хорошо реагирующих пациентов отмечено увеличение количества спонтанных беременностей (16,7%) по сравнению с группами, не отвечающими на лечение (3,1%) и не получавших ФСГ (4,0%) [37]. В. Baccetti и соавт. (2004 г.) оценивали влияние терапии ФСГ на качество сперматозоидов, а также исследовали их структуру и функцию у бесплодных мужчин. Из 81 пациента, включенного в исследование, 15 получали плацебо, у 19 терапия оказалась неэффективной. У остальных 47 пациентов было достигнуто улучшение изучаемых параметров, при этом 9 достигли улучшения показателей спермы, приближенного к порогу фертильности [38]. В другом исследовании установлено положительное влияние терапии ФСГ на структуру и функцию сперматозоидов (увеличивалось количество сперматозоидов с нормальной морфологией) в дозе 150 МЕ в течение 12 нед [39]. J. Ashkenazi. и соавт. (1999 г.) изучали роль ФСГ в терапии бесплодия у мужчин при подготовке к ИКСИ [40]: 79 пациентов основной и 39 пациентов контрольной группы получали терапию ФСГ в дозе 75 МЕ в сутки в течение 50 дней и более. Количество успешных процедур оплодотворения и беременностей было больше в основной группе (68,0 и 35,9% соответственно), по сравнению с контрольной (59,0 и 17,9% соответственно) однако статистически значимой разницы не достигнуто. В основной группе число успешных случаев имлантации было значимо выше: 15,5% против 6,5% в контрольной. Таким образом, терапия ФСГ у бесплодных мужчин перед ИКСИ значительно увеличивала вероятность имплантации эмбриона и количество беременностей [40,41]. В другом исследовании также был установлен положительный эффект применения рекомбинантного ФСГ в дозе 150 МЕ в течение 3 мес при подготовке к ИКСИ, который проявлялся в виде улучшения тестикулярного объема и параметров спермы [42]. Кроме того, было отмечено, что длительное применение очищенного ФСГ 150 МЕ 3 раза в неделю в течение 6 мес при идиопатической олигоспермии с нормальными уровнями сывороточных гормонов увеличивает концентрацию сперматозоидов и их подвижность [43]. Наряду с препаратами ФСГ изучали влияние на сперматогенез и других гонадотропинов. Так, М. Depenbusch и соавт. (2002 г.) исследовали эффективность монотерапии хорионическим гонадотропином человека (ХГЧ) для стимуляции и поддержания сперматогенеза у пациентов с гипогонадотропным гипогонадизмом. У 13 пациентов вначале для индукции сперматогенеза были назначены ХГЧ/ХМГ (n=12) и ГнРГ (n=1). После достижения индукции сперматогенеза пациенты получали только ХГЧ для поддержания сперматогенеза и вторичных половых признаков. После успешной индукции сперматогенеза монотерапию ХГЧ проводили от 3 до 24 мес. Через 12 мес концентрации сперматозоидов снизились, однако оставались в пределах нормы у всех пациентов, кроме 1 пациента с азооспермией. Тестикулярный объем снизился незначительно и составил 87% от объе11 ВЕСТНИК Репродуктивного Здоровья •• Декабрь •• 2010 ма, достигнутого терапией ХГЧ/ХМГ. Во время монотерапи ХГЧ уровни ЛГ и ФСГ были подавлены и оставались в пределах, заданных исследованием. Таким образом, авторами сделан вывод о том, что однажды индуцированный сперматогенез у пациентов с вторичным гипогонадизмом может поддерживаться монотерапией ХГЧ на качественном уровне у большинства пациентов в течение длительного периода [44,45]. Н. Fuse и соавт. (1996 г.) также изучали применение гонадотропинов для индукции сперматогенеза у мужчин с гипогонадотропным гипогонадизмом. У 16 пациентов применяли заместительную гормональную терапии гонадотропинами. Из них 2 пациента получали только ХГЧ и достигли улучшения сперматогенеза через2и 12 мес после начала лечения, 3 пациента, получавшие комбинированную терапию гонадотропинами, достигли улучшения сперматогенеза через 6 28 мес. Пациенты, которые имели объем яичек 4 мл и более, достигли высокой концентрации сперматозоидов и оплодотворили своих партнерш, хотя не было установлено связи между тестикулярным объемом до лечения и появлением сперматогенеза [46]. Е. Vicari и соавт. (1992 г.) изучали эффекты длительной терапии ХГЧ (14 120 мес) у 17 пациентов с изолированным гипогонадотропным гипогонадизмом на тестикулярный объем, уровень тестостерона в плазме и концентрацию сперматозоидов. В среднем объем яичек увеличился от 3,8 +/0,2 до 14,9 +/1,1 мл после 22,2 +/2,3 мес терапии ХГЧ. Кроме того, для оценки тестикулярного объема пациенты были разделены на 2 группы в зависимости от исходного объема яичек: меньше 4 мл (1-я группа) и больше 4 мл (2-я группа). Уровни тестостерона на протяжении всей терапии были в пределах возрастной нормы и значительно не различались в обеих группах. У 13 пациентов (70%) было достигнуто улучшение сперматогенеза во время монотерапии ХГЧ, у 5 (60%) из 9 1-й группыиу8 (90%) из 9 2-й. К тому же пациенты 2-й группы имели лучшие показатели сперматогенеза, чем 1-й. Концентрация сперматозоидов положительно коррелировала с достигнутым объемом яичек и не зависела от возраста, продолжительности лечения и первоначального тестикулярного объема. Дополнительное назначение менопаузального гонадотропина у 9 пациентам привело к увеличению у них объема яичек, однако средний объем яичек не отличался от среднего объема при окончании монотерапии ХГЧ, а также у этих пациентов не было выявлено различий в концентрации сперматозоидов по сравнению с таковой на фоне терапии ХГЧ. Только 1 пациент достиг улучшения сперматогенеза после назначения менопаузального гонадотропина. Среди пациентов с улучшением сперматогенеза при попытке зачатия 7 из 10 достигли успеха, 2 из них были из 1-й группы. Это исследование продемонстрировало эффективность монотерапии ХГЧ для индукции сперматогенеза у пациентов с изолированным гипогонадотропным гипогонадизмом независимо от первоначального тестикулярного объема. Тем не менее, определенному числу пациентов показано назначение менопаузального гонадотропина для увеличения тестикулярного объема, продукции спермы и достижения фертильности [47]. G. Beretta и соавт. (2005 г.) в своем исследовании использовали менопаузальный гонадотропин для стимуляции сперматогенеза при идиопатической олигоас12 тенотератоспермии. У 18 пациентов с олигоастенотератоспермией и объемом яичек 12-15 мл проводили терапию менопаузальным гонадотропином (75 МЕ ФСГ и 75 МЕ ЛГ) 3 раза в неделю в течение 90 дней, по окончании терапии оценивали параметры спермы и объем яичек в сравнении с контрольной группой из 13 мужчин, ожидающих ИКСИ и не получающих какой-либо медикаментозной терапии. В результате лечения получено статистически значимое увеличение концентрации сперматозоидов (p = 0,016) и уменьшение их атипичных форм (p = 0,040). Также были получены данные, что терапия менопаузальным гонадотропином положительно влияет на качество эмбрионов, полученных в ходе последующих ИКСИ [48]. Р. Liu и соавт (2008 г.) определяли предикторы успешной индукции сперматогенеза и восстановления фертильности у пациентов с гипогонадизмом и бесплодием в ответ на лечение гонадотропинами: у 75 мужчин, 72 из которых желали достигнуть фертильности, применяли различные препараты гонадотропинов по 16 курсов с 1981 по 2008 г. Оценку показателей спермы проводили каждые 3 мес. Стали отцами 39 мужчин. Среднее время достижения появления первых сперматозоидов было 7,1 (95% ДИ6,3 10,1) мес, а время достижения зачатия 28,2 (95% ДИ21,6 38,5) мес. Средний показатель концентрации сперматозоидов для достижения спонтанной беременности составлял 8,0 (95% ДИ0,2 59,5) млн/мл. При этом больший объем яичек до лечения гонадотропинами являлся независимым предиктором более быстрого ответа на терапию [49]. Другие исследователи также изучали возможность комбинированной терапии мужского бесплодия препаратами гонадотропинов. Так, 100 пациентов с идиопатическим и приобретенным гипогонадотропным гипогонадизмом получали терапию ХГЧ в течение 3 6 мес, а затем комбинированную терапию ХГЧ и ФСГ 150 МЕ трижды в неделю в течение 18 мес. У 81 мужчины после терапии ХГЧ сохранялась азооспермия, однако были достигнуты нормальные уровни тестостерона. А после комбинированной терапии у 68 (84%) из них в эякуляте появились сперматозоиды и у 56 (69,1%) пациентов была достигнута концентрация сперматозоидов 1,5 и более * 10(6)/мл. Больший исходный объем яичек, низкий индекс массы тела и достижение половой зрелости были предикторами хорошего ответа на терапию. Таким образом, терапия рекомбинантным человеческим ФСГ в сочетание с ХГЧ являлась эффективной для восстановления фертильности у большинства мужчин с гипогонадотропным гипогонадизмом [50]. М. Bakircioglu и соавт (2007 г.) в своем исследовании использовали комбинированную терапию гонадотропинами для стимуляции сперматогенеза перед ИКСИ. У 25 пациентов с азооспермией был установлен диагноз гипогонадотропный гипогонадизм. Все пациенты получали ХГЧ в течение 1 мес, в сочетании с рекомбинантным ФСГ в последующие месяцы терапии. Уровень общего тестостерона и объем яичек значимо увеличились после терапии гонадотропинами (р < 0,001). Сперматозоиды стали определяться в эякуляте в среднем через 10 мес. Спонтанная беременность наступила у 4 пар. У 18 пар проведено 22 процедуры ИКСИ с использованием сперматозоидов из эякулята или яичка, в результате было получено 12 (54,5%) беременностей. Данные результаты, по мнению авторов, свидетельствуВЕСТНИК Репродуктивного Здоровья •• Декабрь •• 2010 Обзор литературы ют об успешном лечении бесплодия при гипогонадотропном гипогонадизме комбинированной терапией гонадотропинами в сочетании с ИКСИ [51]. Подобная эффективность комбинированной терапии была продемонстрирована и в других исследованиях [52,53]. Так, применение монотерапии ХГЧ в течение 16 нед у 61% пациентов с гипогонадотропным гипогонадизмом приводило к нормализации уровня тестостерона в крови, однако у пациентов оставалась азооспермия. После добавления рекомбинантного ФСГ в дозе 225 МЕ 2 раза в неделю и 150 МЕ 3 раза в неделю индукция сперматогенеза была достигнута в 47% случаев, в среднем через 5,5 мес терапии [53]. Э.М. Китаев и соавт. (1999 г.) в своем исследовании проводили краткосрочную гормональную стимуляцию сперматогенеза у 19 мужчин в возрасте 36,3±0,8 года. Гормональная стимуляция сперматогенеза состояла из 2 инъекций препарата, содержащего по 150 МЕ ФСГ и 150 МЕ ЛГ и назначаемого на 5 и 10-й дни менструального цикла партнерши, находящейся на стимуляции суперовуляции, либо из 2 инъекций препарата с интервалом 5 дней. На фоне терапии достоверное улучшение показателей сперматогенеза было достигнуто у 73,6% мужчин [54]. В итоге в 2007 г. был проведен анализ 4 рандомизированных контролируемых исследований по эффективности применения гонадотропинов при идиопатическом мужском бесплодии. В анализ были включены 278 пациентов. По сравнению с плацебо или отсутствием лечения на фоне терапии гонадотропинами было продемонстрировано более высокое количество беременностей (относительный риск (ОР) 4,17, 95% ДИ1,30 7,09). Но, по мнению авторов, количество проведенных исследований является недостаточным для формирования окончательных выводов [55]. Таким образом, приведённые в литературе сведения отечественных и зарубежных исследователей по применению методов гормональной стимулирующей терапии нарушений сперматогенеза свидетельствуют о значительном прогрессе в изучении данной проблемы. Однако в литературе отсутствуют детальные данные об эффективности стимулирующей терапии в различных группах пациентов с патоспермией и бесплодием, что требует дальнейшего изучения. Литература
1. Всемирная организация здравоохранения (ВОЗ). Руководство по лабораторному исследованию спермы человека и взаимодействию спермы с цервикальной слизью. Тбилиси, 1988.
2. Гоголевский П.А. ИКСИ: существует ли риск возрастания частоты врожденных пороков развития? Пробл. репрод. 1998; 6: 9–13.
3. Ginsburg J, Okolo S, Prelevic G, Hardman P. Residence in the London area and sperm density. Lancet.1994;343: 230.
4. Irvine S, Cawood E, Richardson D et al. Evidence of deteriorating semen quality in the United Kingdom: birth cohort study in Scotland over 11 years. Brit Med J. 1996; 312: 467-70.
5. Jensen T K, Giwermann A, Carlsen E et al. Semen quality among mem-bers of organic food associations in Zealand, Denmark. Lancet.1996;.347:1844.
6. Vierula M, Niemi M, Keiski A, Saaranen M. Saarikoski S., Suominen J. High and unchanged sperm counts of Finnish men. Int J Androl.1996; 19:11-7.
7. Bruckert E. How frequent is unintentional childlessness in Germany? Androl. 1991; 23: 245-50.
8. Juul S, Karmaus W,Olsen J. and The Europen Infertility and Subfecundety Study Group. Regional differences in waiting time to pregnancy: pregnancy-based surveys from Denmark, France, Germany, Italy and Sweden. Hum Reprod.1999; 14:1250-4.
9. Тер-Аванесов Г.В. Андрологические аспекты бесплодного брака. Диc. докт. мед. наук. М., 2002.
10. Кулаков В.И., Назаренко Т.А., Тер-Аванесов Г.В. Бесплодный брак: достижения, проблемы, перспективы. Тезисы конференции «Мужское здоровье», 2003 (Web-репринт).
11. Morell V. Basic infertility assessment. Prim Care. 1997; 24:195.
12. Тер-Аванесов Г.В. Андрологические аспекты бесплодного брака. Бол. органов репродукт. системы. 2004;3 (Web-репринт).
13. Селезнева И.Ю. Бесплодный брак. Эпидемиологическое исследование. Диc. канд. мед. наук. М., 1999: 3349.
14. Филиппов О.С. Бесплодный брак в Западной Сибири. Диc. докт. мед. наук. М., 1999: 27–48.
15. Андрология. Мужское здоровье и дисфункция репродуктивной системы. Под ред. Э Нишлага, Г.М. Бере. М.,2005.
16. Артифексов С. Б. Андрологические аспекты бесплодного брака. Урол. и нефрол. 1996; 4:39.
17. Palermo G, Joris H, Devroey P et al. Pregnancies after intracytoplasmic injection of single spermatozoon into an oocyte. Lancet. 1993; 240:17.
18. Морозов П.Г. Новые перспективы клинического применения гонадотропинов в андрологии. Androl. reproductol. sexol. 1993; 2 (3): 29-33.
19. CheckJH Treatment of male infertility. Clin Exp Obstet Gynecol. 2007; 34(4): 201-6.
20. Sokol R Z. Medical and endocrine therapy of male factor infertility. Infertil Reprod Med Clin North Am. 1992; 3:389.
21. Ioannidou-Kadis S, Wright PJ, Neely RD, Quinton R. Complete reversal of adult-onset isolated hypogonadotropic hypogonadism with clomiphene citrate. Fertil Steril 2006; 86(5):1513.e5-9.
22. Hussein A, Ozgok Y, Ross L, Niederberger C. Clomiphene Administration for Cases of Nonobstructive Azoospermia: A Multicenter Study. J Androl 2005; 26(6): 787-91.
Средства от гормонального дисбаланса
Благодаря многочисленным достижениям в лечении бесплодия, совершенным в последние годы, у современных женщин и мужчин есть множество вариантов, которые они могут обсудить со своими врачами. В Michigan Reproductive Medicine мы верим в полное объяснение каждого доступного варианта, а затем разрабатываем лечение, адаптированное и наиболее экономичное с учетом индивидуального диагноза и обстоятельств пары.
Чтобы помочь вам начать работу, вот обзор многих видов лечения бесплодия, доступных для удовлетворения ваших медицинских потребностей.Если у вас возникнут какие-либо вопросы, не стесняйтесь записаться на консультацию.
По данным Американского общества, большинство женщин и мужчин, пытающихся преодолеть бесплодие в США (от 85 до 90 процентов), лечатся традиционными методами лечения, такими как медикаментозное или хирургическое лечение, в отличие от ЭКО или вспомогательных репродуктивных технологий (ВРТ). репродуктивной медицины (ASRM). По мере увеличения успеха в АРТ хирургические методы лечения выбираются реже.
Это означает, что вы и ваш врач можете обсудить широкий спектр вариантов лечения, как медицинских, так и хирургических.Выбор лечения должен основываться на ваших индивидуальных обстоятельствах.
Хотя вы обсудите это более подробно со своим врачом, вот обзор медицинских вариантов лечения гормонального дисбаланса у мужчин:
Лечение нарушений производства спермы
Для завершения развития сперматозоидов от стволовых клеток до зрелых сперматозоидов, готовых к высвобождению, требуется около 72 дней. Любое повреждение яичка может нарушить выработку спермы и привести к созреванию сперматозоидов, способных успешно оплодотворить яйцеклетку.Физические травмы, химическое и радиационное воздействие, вирусы, жара, различные причины плохого состояния здоровья и генетические аномалии могут способствовать аномальному снижению выработки и функции сперматозоидов. Для восстановления нормального производства спермы может потребоваться не менее 3 месяцев.
Аномально низкий уровень ФСГ и ЛГ не позволяет яичку производить сперму
У мужчин могут быть аномально низкие уровни основных гормонов фертильности, называемых фолликулостимулирующим гормоном (ФСГ) и лютеинизирующим гормоном (ЛГ) гипофиза, которые необходимы для стимуляции производства и развития сперматозоидов.Уровень тестостерона в крови обычно ниже нормы. Эти мужчины, вероятно, хорошо отреагируют на гонадотропин, инъекционные препараты для лечения бесплодия, которые содержат ФСГ, ЛГ и ХГЧ, тем самым восполняя недостающий гормон и заставляя нормальные яички выделять яйцеклетку. Поскольку кломифен и тамоксифен обычно стимулируют высвобождение ФСГ и ЛГ из головного мозга мужчины, если мужчина не может вырабатывать ФСГ или ЛГ, то кломифен и тамоксифен будут неэффективны в качестве лекарства от бесплодия. .
Аномально низкие концентрации сперматозоидов при нормальном уровне ФСГ, ЛГ и тестостерона
Когда уровни гормонов в норме, но производство спермы низкое, использование кломифена, тамоксифена или анастраозола (аналогично летрозолу) может способствовать улучшению выработки сперматозоидов за счет повышения выработки ФСГ и ЛГ мозгом и, таким образом, стимулирования яичников к выработке сперматозоидов. в больших количествах. Трехмесячного испытания достаточно, чтобы оценить, будет ли это лечение полезным для фертильности.Кломифен и тамоксифен могут оказывать угнетающее влияние на настроение мужчины в качестве побочных эффектов.
Аномально низкие концентрации сперматозоидов с аномально высокими уровнями ФСГ, ЛГ и тестостерона (снижение резерва яичек)
Мужчины с аномально высокими уровнями основных гормонов фертильности, называемых фолликулостимулирующим гормоном (ФСГ) и лютеинизирующим гормоном (ЛГ) гипофиза, и аномально низкой концентрацией сперматозоидов, вероятно, имеют уменьшенный тестикулярный резерв. В этом состоянии его мозг уже высвобождает гормоны фертильности с максимальной отдачей.Использование кломифена, анастрозола и гонадотропинов вряд ли вызовет улучшение функции яичек и улучшит производство спермы. ЭКО с интрацитоплазматической инъекцией сперматозоидов (ИКСИ), вероятно, предоставит наилучшую возможность для рождения ребенка. Возможно, потребуется рассмотреть альтернативу выбора и использования спермы анонимного донора с помощью терапевтического осеменения донорской спермой (TDI).
Другие гормональные нарушения, вызывающие низкую концентрацию сперматозоидов
Мужчины с высоким уровнем пролактина, низким уровнем гормонов щитовидной железы (гипотиреоз) и генетическими аномалиями, вызывающими развитие опухолей покоя надпочечников, могут привести к снижению уровня гормона ФСГ из гипофиза в головном мозге, отключает функцию яичек с неспособностью производить сперму.Эти пациенты, как правило, очень благоприятно реагируют на лекарства (каберголин), которые снижают секрецию пролактина и / или заменяют гормон щитовидной железы левотироксином (Synthroid®). Опухоли покоя надпочечников могут регрессировать при терапии стероидами преднизоном, но улучшение качества спермы менее определенно.
Лечение мужского бесплодия
Транс Андрол Урол. 2014 Март; 3 (1): 9–16.
Отделение урологии, Медицинский колледж Вейл Корнелл, Нью-Йорк, Нью-Йорк 10065, США
Автор, ответственный за переписку. Для корреспонденции: Петер Н. Шлегель. Отделение урологии, Медицинский колледж Weill Cornell, 525 E 68th street, New York, NY 10065, США. Электронная почта: ude.llenroc.dem@gelhcsnp.
Поступило 12 ноября 2013 г .; Принято 21 января 2014 г.
Авторское право 2014 г. Трансляционная андрология и урология. Все права защищены.Эта статья цитировалась в других статьях в PMC.
Реферат
В большинстве случаев мужское бесплодие носит идиопатический характер. Однако существует множество известных причин мужского бесплодия, и некоторые из этих причин можно лечить медикаментозно с большим успехом.В случае идиопатических или генетических причин мужского бесплодия лечение обычно является эмпирическим; в большинстве случаев медикаментозная терапия представляет собой использование не по назначению, которое специально не одобрено FDA. Понимание гипоталамо-гипофизарно-гонадной оси (HPG) и эффекта избытка эстрогена имеет решающее значение для оценки и лечения мужского бесплодия. Использование определенного медицинского лечения было связано с увеличением выработки или подвижности сперматозоидов и в первую очередь направлено на оптимизацию выработки тестостерона (Т) клетками Лейдига, повышение уровня фолликулостимулирующего гормона (ФСГ) для стимуляции клеток Сертоли и сперматогенеза, а также нормализация отношения тестостерона к эстрогену.
Ключевые слова: Мужское бесплодие, гипогонадотропный гипогонадизм (ГГ), избыток эстрогена, гонадотропины, олигоспермия, лечение
Введение
Около 15% пар бесплодны, и на бесплодие мужского фактора приходится около 50% случаев бесплодия ( 1). В большинстве случаев мужское бесплодие носит идиопатический характер, что указывает на необъяснимые отклонения параметров сперматозоидов или необъяснимую азооспермию. Однако существует множество известных причин мужского бесплодия, и некоторые из них имеют фармакологический вариант в качестве первой линии лечения.Лечение известных причин мужского бесплодия имеет тенденцию к целенаправленному и высокому успеху. В случае идиопатических или генетических причин мужского бесплодия лечение обычно носит эмпирический характер и направлено на оптимизацию.
Важно понимать, что функция яичек включает как выработку тестостерона (Т), так и сперматогенез, и эта функция сильно регулируется осью гипоталамус-гипофиз-гонад (HPG). Сперматогенез зависит от высоких уровней интратестикулярного Т и стимуляции фолликулостимулирующего гормона (ФСГ) клеток Сертоли (2).Несмотря на потребность в Т для сперматогенеза, введение Т и других андрогенов обладает противозачаточными свойствами; они проявляют отрицательную обратную связь по HPG и, таким образом, ингибируют стимуляцию лютеинизирующего гормона (ЛГ) выработки интратестикулярного Т, а также стимуляцию ФСГ клеток Сертоли, и их следует избегать. Для большинства известных причин мужского бесплодия терапевтической целью является поддержание репродуктивной оси для увеличения тестикулярного T. Однако у некоторых мужчин с первичной недостаточностью яичек или идиопатическим мужским бесплодием специальная медикаментозная терапия не была определена, и эмпирические медицинские методы лечения не были определены. часто используются.В этой обзорной статье основное внимание будет уделено нехирургическим методам лечения мужского бесплодия, доступным в настоящее время, и дан обзор данных об эффективности этих методов лечения, список рассмотренных лекарств резюмирован в.
Таблица 1
Пересмотренное лечение мужского бесплодия
| Вещество | Администрация | Дозировка и частота | Текущая доступность |
|---|---|---|---|
| GnRH | Насос для подкожной инфузии | 25-200 нг / кг за импульс каждые 2 часа | Только в специализированных центрах или в рамках клинических испытаний |
| Хорионический гонадотропин человека (ХГЧ) | Подкожно / внутримышечно | 1500-3000 МЕ 2 раза в неделю | Доступно, FDA одобрен для лечения бесплодия из-за дефицита гонадотропина |
| Человеческий менопаузальный гонадотропин (чМГ) | Подкожно / внутримышечно | 75 МЕ 2-3 раза в неделю | Доступен, одобрен FDA для лечения бесплодия из-за дефицита гонадотропина |
| Высокоочищенный или рекомбинантный фолликулостимулятор человека g гормон (rhFSH) | Подкожно / внутримышечно | 100-150 МЕ 2–3 раза в неделю | Доступен, одобрен FDA для лечения бесплодия, вызванного дефицитом гонадотропина |
| Агонист дофамина | Перорально | Каберголин (0 .5-1 мг два раза в неделю), бромокриптин (2,5-5,0 мг два раза в неделю) | Одобрение FDA для лечения гиперпролактинемии |
| Ингибиторы ароматазы | Перорально | Анастрозол 1 мг / день | Использование не по назначению |
| Летрозол 2,5 мг / день | Использование не по назначению | ||
| Тестолактон | Недоступно в США | ||
| Селективные модуляторы рецепторов эстрогена (SERM) | Перорально | Титрат кломифена цитрата до 50 мг / день | Выкл. использование по этикетке |
| Тамоксифен 20 мг / день, торемифен 60 мг / день, ралоксифен 60 мг / день | Использование не по назначению |
Гормональное лечение
Гонадотропин-высвобождающий гормон (ГнРГ)
Пульсирующий высвобождение гонадолиберина в гипоталамусе стимулирует высвобождение ФСГ и ЛГ из передней доли гипофиза.У мужчин нормальные уровни ФСГ и ЛГ ответственны за индукцию сперматогенеза и поддержание высоких уровней тестикулярного тестикулярного тестикуляра (3). Пульсирующее введение ГнРГ является эффективным методом лечения дефицита ГнРГ у бесплодных мужчин с гипогонадотропным гипогонадизмом (ГГ) из-за недостаточной секреции гипоталамуса (например, синдром Каллмана, идиопатический ГГ). У мужчин с ГП наблюдается пониженная фертильность, которая обычно восстанавливается за счет восстановления высокого уровня тестикулярного тестикулярного уровня и стимуляции клеток Сертоли ФСГ (4).Целью терапии ГнРГ является стимуляция высвобождения гонадотропинов из передней доли гипофиза и последующих путей в HPG (3). Наиболее эффективная доза для пульсирующего ГнРГ — это доза 5-20 мкг каждые 1-2 часа, вводимая с помощью подкожного насоса или иглы (5).
ГнРГ очень эффективен в индукции сперматогенеза уже через четыре месяца после начала терапии (6). Пульсирующая терапия гонадолиберином индуцирует сперматогенез примерно у 85% пациентов (7,8), и в среднем 60% пар достигают беременности после девяти месяцев лечения, что может занять до двух лет (9).Некоторые мужчины, получающие гонадолиберин, увидят улучшение своих сексуальных характеристик, таких как увеличение объема яичек, и другие особенности, такие как рост волос на лобке. Эти изменения можно использовать в качестве клинических маркеров для мониторинга лечения. Увеличение размера яичек, нормализация уровня гонадотропина и Т, созревание вторичных половых признаков, нормальный исходный уровень ингибина В и отсутствие крипторхизма являются положительными предикторами успеха лечения (10). Когда лечение пульсирующим гонадолиберином не дает клинического ответа, метод введения, эффективность дозы или другие причины, такие как образование антител против гонадолиберина, следует оценивать как часть дифференциальной диагностики (8).ГнРГ успешно используется в лечении мужчин с ГГ, но в настоящее время нет доказательств, подтверждающих его использование для лечения идиопатического бесплодия. Около 10% пациентов с ГГ могут не нуждаться в длительном лечении; есть доказательства того, что гипоталамус будет вырабатывать и секретировать гонадолиберин после того, как лечение будет приостановлено в течение короткого периода времени (11). Несмотря на прекрасные результаты лечения пульсирующим гонадолиберином, его использование ограничено доступностью, неудобством доставки с помощью помпы и необходимостью регулярно менять подкожные иглы.
Гонадотропины
Лечение мужского бесплодия у мужчин с гипофизарной недостаточностью (например, аденома гипофиза, системные заболевания, такие как гемохроматоз и саркоидоз) основано на использовании гонадотропинов, поэтому сперматогенез и производство Т не могут быть индуцированы пульсирующим ГнРГ. Гонадотропины ранее извлекались из мочи. С развитием лабораторных технологий хорионический гонадотропин человека (rec-hCG), FSH (rec-hFSH) и LH (rec-hLH) или высокоочищенные гонадотропины мочи используются с высочайшим качеством, активностью и эффективностью.Не было подтвержденных различий в безопасности, чистоте или клинической эффективности между различными доступными высокоочищенными или рекомбинантными продуктами гонадотропина (12).
Первоначально вводят только ХГЧ. Если после нескольких месяцев лечения сперматозоиды не обнаружены, но достигнут адекватный уровень тестостерона в сыворотке крови, начинается лечение ФСГ (13). Гонадотропины представляют собой вводимые самостоятельно подкожные инъекции с дозировкой от 75 до 150 МЕ ФСГ или менопаузального гонадотропина человека (ЧМГ) два-три раза в неделю плюс 1500-2500 МЕ ХГЧ два раза в неделю.Продолжительность лечения может варьироваться от 6 до 24 месяцев и более и обычно продолжается до появления сперматозоидов в эякуляте и / или до достижения беременности. Большинство исследований показали, что гонадотропины индуцируют сперматогенез примерно у 80% мужчин (14), при этом некоторые демонстрируют использование ХГЧ в сочетании с чФСГ, чФСГ в моче или сперматогенез, индуцирующим чМГ, у 94% мужчин (15). Время, необходимое для появления сперматозоидов в эякуляте, варьируется, в большинстве исследований сообщается, что среднее время наступления беременности составляет семь месяцев, а среднее время — 28 месяцев (16).Многоцентровое исследование безопасности продемонстрировало, что комбинация ХГЧ и рчФСГ индуцирует сперматогенез у мужчин с ГГ, которые не реагируют на лечение только ХГЧ (17). Частота наступления беременности также варьируется между исследованиями: от 38% до 51% пар, обращающихся за лечением, забеременели (9,17). Гонадотропины также увеличивали уровень тестикулярного тестостерона и объем яичек с относительно небольшим количеством побочных эффектов (13). Несколько факторов коррелируют с ответом на лечение. Крипторхизм, маленькие яички, повышенный ИМТ и крайняя недостаточность гонадотропинов обычно считаются отрицательными прогностическими показателями при лечении гонадотропинами (13,18,19).Гонадотропины обычно хорошо переносятся, и правильная корректировка дозы для оптимизации уровня тестостерона минимизирует побочные эффекты, такие как гинекомастия, угри, гриппоподобные симптомы и увеличение веса.
Несмотря на то, что ГнРГ и гонадотропины доказали свою пользу и продемонстрировали успех в индукции сперматогенеза при ГГ, существуют ограниченные доказательства использования гонадотропинов у мужчин с идиопатическим бесплодием. Некоторые из рандомизированных контролируемых исследований, в которых оценивалось использование чМГ или ФСГ в сочетании с ХГЧ для лечения нормогонадотропной олигоастенотератозооспермии (ОАТ), не показали каких-либо преимуществ от лечения (20,21).Тем не менее, некоторые исследования показали, что у мужчин с гипосперматогенезом при тонкоигольной аспирации улучшаются параметры семени и частота наступления беременности при лечении гонадотропинами по сравнению с другой патологией ткани яичек (22). В настоящее время нет единого мнения об использовании заместителей ФСГ или ЛГ для лечения идиопатических ОАТ и NOA, и поскольку у большинства мужчин с недостаточностью яичек уровень ФСГ превышает 8,4 МЕ / л (23,24), Обоснование введения большего количества гонадотропинов полностью не обосновано.Следовательно, эти методы лечения следует считать эмпирическими, и требуется больше доказательств из плацебо-контролируемых исследований.
Агонист дофамина
У мужчин с бесплодием и гиперпролактинемией основной причиной следует считать пролактин-секретирующую аденому гипофиза (наиболее частые функциональные опухоли). Опухоли, вызывающие компрессию стебля и гиперпролактинемию, не следует лечить агонистами дофамина. Повышенный уровень пролактина подавляет пульсирующую секрецию гонадолиберина, мужчины будут иметь гипогонадизм и бесплодие, а также они могут испытывать головные боли или изменения поля зрения, вызванные сдавлением опухолью гипофиза.В этом случае агонисты дофамина показаны для лечения бесплодия и опухоли гипофиза. И бромокриптин, и каберголин использовались в прошлом. Однако есть доказательства того, что каберголин более эффективен, чем бромокриптин в подавлении выработки пролактина (25), и, как было показано, нормализует уровень пролактина у 70% пациентов, устойчивых к бромокриптину (26). Таким образом, каберголин (0,125–1,0 мг два раза в неделю) является предпочтительным выбором, поскольку он имеет наивысшую эффективность в нормализации уровня пролактина и сокращении пролактин-секретирующих опухолей.Пациенты, у которых не удается достичь нормального уровня пролактина при максимально переносимой дозе, или у которых наблюдается уменьшение размера опухоли менее чем на 50% и не удается восстановить фертильность, скорее всего, наблюдается резистентность к агонистам дофамина. Текущая рекомендация для опухолей, устойчивых к агонисту дофамина, — увеличить дозу лекарства или перейти с бромокриптина на каберголин. Пациентам, у которых неэффективен прием каберголина или изменение дозы, рекомендуется хирургическое вмешательство (27).
Терапия ингибитором ароматазы (AI)
Лечение AI мужчин с идиопатическим ОАТ или азооспермией является применением этого препарата не по назначению.ИА (анастрозол 1 мг в день или летрозол 2,5 мг в день) повышают уровень T, снижают уровень эстрогена и ингибируют периферический метаболизм T. Цель состоит в том, чтобы снизить эстрогенный эффект на сперматогенез. Было показано, что высокий уровень эстрогена в сочетании с низким уровнем тестостерона нарушает правильный сперматогенез (28). Что еще более важно, повышенный уровень эстрогена приведет к подавлению обратной связи оси HPG, и конечным результатом является снижение LH, необходимого для производства T, и FSH для оптимизации производства спермы (29).Активность ингибирования ароматазы независимо от ИМТ пациента предполагает, что активность ароматазы в клетках Лейдига ответственна за преобразование Т в эстрадиол (E) и нарушение параметров спермы (30,31).
Небольшое исследование тестолактона в высоких дозах не повлияло на качество спермы или частоту наступления беременности у мужчин с идиопатической олигозооспермией, однако на отношения T / E лечение в этом исследовании не повлияло (32). Использование тестолактона в другом исследовании мужчин с идиопатическим бесплодием и T <300 нг / дл с соотношением T / E <10 : 1 показало улучшение гормонального профиля и параметров спермы (33).Эти данные свидетельствуют о том, что по крайней мере небольшая группа пациентов с мужским бесплодием с повышенным уровнем Е в сыворотке может получить пользу от лечения низкими дозами тестолактона. Однако есть некоторые свидетельства того, что лечение высокими дозами тестолактона может фактически подавлять выработку Т, поэтому оно может быть неэффективным для улучшения выработки спермы и фертильности. Кандидатами на ингибирование ароматазы обычно являются мужчины с сывороткой и T <300 нг / дл и отношением T / E> 10 (33).
В неконтролируемом исследовании, сравнивающем анастрозол и тестолактон (74 получали тестолактон и 104 получали анастрозол), у бесплодных, олиго- или азооспермических мужчин с аномальным соотношением T / E лечение привело к улучшению концентрации, подвижности и морфологии сперматозоидов. у всех включенных в исследование субъектов (30), независимо от того, какое лекарство принимал пациент.Использование анастрозола может быть более эффективным при увеличении соотношения Т к эстрогену и с меньшей вероятностью вызовет прерывание выработки андрогенных стероидов, а также ингибирование ароматазы, как при использовании тестолактона, и имеет меньше побочных эффектов. Использование летрозола AI для лечения 27 мужчин с олигоспермией или азооспермией показало заметное улучшение гормонального профиля и улучшение параметров спермы, включая увеличение концентрации сперматозоидов. Двадцать процентов лечившихся мужчин с олигоспермией достигли спонтанной беременности, а у 24% мужчин с азооспермией в эякуляте была обнаружена сперма (34).Поскольку у большинства мужчин с низкой концентрацией сперматозоидов обычно наблюдается избыточная активность ароматазы, приводящая к снижению соотношения Т / Е, ИИ, по-видимому, эффективны для восстановления уровней ЛГ, ФСГ и Т, улучшения параметров спермы и восстановления фертильности. Мужчины, у которых была наибольшая польза, имели диагноз NOA или идиопатическая олигоастеноспермия и низкие T и T / E <10 : 1 (30,33,35,36). Терапия AI обычно хорошо переносится с редкими побочными эффектами, включая тошноту, снижение либидо, бессимптомное легкое повышение показателей функции печени (37).Очень важным побочным эффектом ИИ является возможное снижение минеральной плотности костей и увеличение общего количества жира в организме из-за снижения доступности эстрогена (38).
Селективные модуляторы рецептора эстрогена (SERM)
SERM представляют собой класс соединений, которые действуют на рецептор эстрогена в качестве агонистов или антагонистов. До внедрения интрацитоплазматической инъекции сперматозоидов SERM были одним из немногих вариантов, доступных для мужчин с идиопатическим бесплодием. В то время как SERM, такие как цитрат кломифена (CC), тамоксифен и торемифен, широко использовались женщинами для лечения рака груди и остеопороза, их использование для лечения мужского гипогонадизма и бесплодия в настоящее время не разрешено.CC, как и другие SERM, ингибирует центральную обратную связь эстрогена (39) и регулирует производство ЛГ и ФСГ, что приводит к индукции сперматогенеза. Поскольку CC обладает как сильными внутренними эстрогенными, так и антиэстрогенными свойствами, есть опасения, что эстрогенный эффект кломифена потенциально может иметь пагубное влияние на сперматогенез. Однако исследования показали, что у мужчин с гипогонадизмом кломифен может оказывать существенное положительное влияние на уровень сывороточного тестостерона (40) и может увеличивать частоту наступления беременности (41).В серии случаев, проведенных в международных центрах, у мужчин с необструктивной азооспермией (n = 42), получавших CC дозу, титрованную до уровня сывороточного Т 600 нг / дл, у 64% пациентов в эякуляте была сперма, достаточная для интрацитоплазматической спермы. инъекция. Однако в этом исследовании не было контрольной группы и были исключены все пациенты с синдромом только клеток Сертоли (42), что указывает на то, что КК не может быть эффективным во всех патологических группах мужчин с бесплодием.
Цитрат тамоксифена и другие аналогичные соединения торемифен и ралоксифен являются нестероидными антагонистами рецепторов эстрогена с механизмом действия, аналогичным CC на уровне гипоталамуса и гипофиза.Рандомизированные контролируемые испытания с участием мужчин с олигоспермией или азооспермией по изучению эффективности тамоксифена (20 мг в день) или торемифена и ралоксифена (60 мг в день) сообщили об улучшении параметров спермы и частоты наступления беременности после трех месяцев лечения (43). Однако другие исследования показали улучшение биохимического профиля без влияния на параметры спермы или результаты фертильности (44).
В недавно опубликованном метаанализе, в котором обобщены последние доступные рандомизированные контролируемые исследования по использованию антагонистов эстрогена (CC или тамоксифен) в качестве эмпирической медицинской терапии при идиопатическом мужском бесплодии с олиго- и / или астенотератозооспермией, объединенные данные показали, что антагонисты эстрогенов использование было связано со статистически значимым увеличением частоты наступления беременности по сравнению с контрольной группой (OR 2.42; P = 0,0004). Также было отмечено значительное увеличение концентрации сперматозоидов при средней разнице 5,24 M (5%; P = 0,001) и процент подвижности сперматозоидов при средней разнице 4,55 (P = 0,03). Тот же метаанализ также отметил значительное повышение уровней ФСГ и Т в сыворотке, которые были связаны с применением КК или тамоксифена, без существенной разницы в побочных эффектах, отмеченных между обработанной группой и контрольной группой (45). Другие метаанализы мужчин с олигоастеноспермией, получавших антиэстрогены, выявили отсутствие или незначительное увеличение частоты наступления беременности (15).4% против 12,5% в контрольной группе. Авторы не поддержали использование антиэстрогенов (46,47).
Антиоксидант
Повышенный уровень бесплодия был обнаружен у мужчин с семенной жидкостью, содержащей высокий уровень активных форм кислорода (АФК) (48). Эти АФК связаны с дисфункцией сперматозоидов, повреждением ДНК зародышевых клеток с возможностью нарушения фертильности, но точный механизм полностью не изучен. Эти ассоциации побудили клиницистов лечить бесплодных мужчин с помощью антиоксидантных добавок.Различные клинические испытания показали, что использование антиоксидантных добавок дает небольшое преимущество в улучшении функции сперматозоидов и целостности ДНК. Однако большинство этих исследований не являются рандомизированными контролируемыми испытаниями, и на сегодняшний день нет убедительных испытаний, которые продемонстрировали бы значительно более высокий уровень беременности без посторонней помощи после лечения мужчин антиоксидантной терапией (49). Более того, польза антиоксидантов может быть ограничена определенными группами пациентов, которые еще не определены четко.Очень часто используются отдельные антиоксиданты. Эти тенденции побудили фармацевтические компании производить и продавать определенные комбинации антиоксидантов, и многочисленные исследования смотрели на преимущества этих комбинаций. Исследование, в котором изучалось использование комбинации витаминов E и C, не показало улучшения параметров спермы или частоты наступления беременности (50), а аналогичное исследование с использованием витаминов E и C обнаружило значимое снижение фрагментации ДНК, но не улучшило параметры спермы, когда по сравнению с плацебо (51).В рандомизированном контролируемом исследовании комбинация витаминов A, C, E плюс NAC и цинка увеличивала концентрацию сперматозоидов без влияния на частоту наступления беременности (52). Этой группе пациентов также была проведена операция по коррекции варикоцеле, и увеличение концентрации сперматозоидов можно спутать и не связывать с применением антиоксиданта. Систематический обзор 17 рандомизированных исследований с участием 1665 бесплодных мужчин был проведен для оценки влияния пероральных антиоксидантов (витаминов C и E, цинка, селена, фолиевой кислоты, карнитина и каротиноидов) на качество спермы и частоту наступления беременности у бесплодных мужчин.Четырнадцать из 17 (82%) испытаний показали улучшение качества спермы или частоты наступления беременности после антиоксидантной терапии. Десять испытаний изучали частоту наступления беременности, а шесть показали значительное улучшение после антиоксидантной терапии (53). Этот систематический обзор имел несколько ограничений: большинство этих исследований не были контролируемыми и различались по дизайну. Объединенные данные различались по популяции, дозировке и продолжительности использования антиоксидантов. В настоящее время нет конкретных рекомендаций по использованию антиоксидантов при лечении мужского бесплодия, и использование этих продуктов является полностью эмпирическим.
Оптимизация хирургической экстракции сперматозоидов с помощью гормональных манипуляций
Использование медикаментозной терапии для оптимизации хирургической экстракции сперматозоидов также основывается на концепции, согласно которой сперматогенез зависит от высоких уровней интратестикулярной стимуляции Т и ФСГ клеток Сертоли (2). Поскольку от 60% до 70% мужчин с NOA будут иметь очаговый сперматогенез, оптимизация гормонального профиля у некоторых пациентов может быть полезной. Использование CC, AI и гонадотропинов может быть полезным для повышения уровня интратестикулярного тестостерона и нормализации уровня эстрогена перед забором сперматозоидов.В ретроспективном исследовании у мужчин с KS и NOA, которые получали AI, кломифен или ХГЧ до microTESE и испытали отскок T до 250 нг / дл или выше, скорость извлечения сперматозоидов увеличилась на 22% по сравнению с мужчинами, которые не достигли уровня сыворотки. 250 нг / дл (54). Это же исследование также показало, что пациенты с СК могут получить пользу от специального применения тестолактона (54). Аналогичное исследование, в котором оценивалось использование медикаментозной терапии перед извлечением спермы (CC, AI и гонадотропин), показало, что мужчины без СК с необструктивной азооспермией и гипогонадизмом часто реагируют на гормональную терапию повышением уровня тестостерона, но ни одного исходного уровня тестостерона. ни реакция на гормональную терапию, ни повлияла на общий забор спермы, клиническую беременность или частоту живорождений (55).Чтобы понять преимущества предварительной обработки перед микро-TESE, необходимы хорошо спланированные рандомизированные контрольные испытания, и на сегодняшний день результаты не являются окончательными. Хотя доказательств первого уровня мало, проспективное исследование, в котором оценивалось использование CC, показало статистически значимое увеличение благоприятных паттернов биопсии яичка и увеличение вероятности извлечения спермы у пациентов с задержкой созревания или гипосперматогенезом при биопсии перед лечением (42). . Напротив, у 66 мужчин, получавших CC в течение 2-3 месяцев до micro-TESE, не наблюдалось никаких улучшений в скорости извлечения сперматозоидов или клинической беременности (55).
Использование гонадотропинов для оптимизации экстракции сперматозоидов является спорным, и популяция пациентов, которым могло бы помочь такое лечение, не определена. Рандомизированные контрольные испытания могут помочь выяснить роль медикаментозной терапии перед забором сперматозоидов. Исследование с участием мужчин с нормальным уровнем ФСГ и гипосперматогенезом при биопсии яичек показало возможные преимущества такого лечения (56). Использование ХГЧ и / или рФСГ у мужчин с NOA было связано с получением сперматозоидов у мужчин, которые не прошли первоначальную микро-TESE, которые затем прошли повторную экстракцию сперматозоидов (57,58), и у мужчин с СК перед микро-TESE для оптимизации уровней тестостерона. (54), а также у мужчин с гипогонадизмом, которым не удалось нормализовать свой уровень тестостерона с помощью CC-терапии до TESE (59).
Выводы
Понимание оси HPG и эффекта избытка эстрогена имеет решающее значение для оценки и лечения мужского бесплодия. Однако цель лечения бесплодия у всех этих мужчин состоит в том, чтобы оптимизировать уровни ЛГ для стимуляции выработки Т клетками Лейдига, уровни ФСГ для стимуляции клеток Сертоли и сперматогенеза, а также устранить избыток эстрогена. Фармакологическая терапия эффективна только при небольшом количестве известных причин мужского бесплодия, когда причины относительно хорошо определены и понятны.Основываясь на текущих данных, гормональную терапию в целом не следует использовать без разбора для лечения идиопатического мужского бесплодия из-за сомнительной эффективности и ограниченной стоимости.
Сноски
Конфликт интересов : У авторов нет конфликта интересов, о котором следует заявлять.
Ссылки
1. Irvine DS. Эпидемиология и этиология мужского бесплодия.
Hum Reprod
1998; 13
Дополнение 1: 33-44. [PubMed] [Google Scholar] 2. Яров JP, Зиркин BR. Андрогенное микроокружение яичка человека и гормональный контроль сперматогенеза.Ann N Y Acad Sci
2005; 1061: 208-20. [PubMed] [Google Scholar] 3. Conn PM, Crowley WF, Jr. Гонадотропин-рилизинг-гормон и его аналоги.
N Engl J Med
1991; 324: 93-103. [PubMed] [Google Scholar] 4. Цицманн М., Нишлаг Э.
Замещение гормонов при мужском гипогонадизме.
Молекулярный эндокринол
2000; 161: 73-88. [PubMed] [Google Scholar] 5. Хапп Дж., Дитшайд В., Краузе Ю.
Пульсирующая терапия гонадотропин-рилизинг гормоном у пациентов мужского пола с синдромом Каллмана или конституциональной задержкой полового созревания.
Фертил Стерил
1985; 43: 599-608.[PubMed] [Google Scholar] 6. Блюменфельд З., Маклер А., Фриш Л. и др.
Индукция сперматогенеза и фертильности у мужчин с гипогонадотропной азооспермией путем внутривенного введения пульсирующего гонадотропин-рилизинг-гормона (ГнРГ).
Гинекол Эндокринол
1988; 2: 151-64. [PubMed] [Google Scholar] 7. Лю Л., Бэнкс С.М., Барнс К.М. и др.
Двухлетнее сравнение ответов яичек на пульсирующий гонадотропин-рилизинг-гормон и экзогенные гонадотропины с момента начала терапии у мужчин с изолированным гипогонадотропным гипогонадизмом.J Clin Endocrinol Metab
1988; 67: 1140-5. [PubMed] [Google Scholar] 8. Блюменфельд З., Фриш Л., Конн. Образование антител к гонадотропин-рилизинг-гормону (ГнРГ) у мужчин с гипогонадотропной азооспермией, получавших пульсирующий ГнРГ — диагностика и возможные альтернативные методы лечения.
Фертил Стерил
1988; 50: 622-9. [PubMed] [Google Scholar] 9. Büchter D, Behre HM, Kliesch S, et al.
Пульсирующий гонадолиберин или хорионический гонадотропин человека / менопаузальный гонадотропин человека как эффективное лечение мужчин с гипогонадотропным гипогонадизмом: обзор 42 случаев.Eur J Endocrinol
1998; 139: 298-303. [PubMed] [Google Scholar] 10. Питтелуд Н., Хейс Ф.Дж., Дуайер А. и др.
Предикторы исхода длительной терапии ГнРГ у мужчин с идиопатическим гипогонадотропным гипогонадизмом.
J Clin Endocrinol Metab
2002; 87: 4128-36. [PubMed] [Google Scholar] 11. Райвио Т., Фалардо Дж., Дуайер А. и др.
Лечение идиопатического гипогонадотропного гипогонадизма.
N Engl J Med
2007; 357: 863-73. [PubMed] [Google Scholar] 12. Комитет практики Американского общества репродуктивной медицины, Бирмингем, Алабама.Препараты гонадотропинов: прошлое, настоящее и будущее.
Фертил Стерил
2008; 90: S13-20. [PubMed] [Google Scholar] 13. Warne DW, Decosterd G, Okada H, et al.
Комбинированный анализ данных для определения прогностических факторов сперматогенеза у мужчин с гипогонадотропным гипогонадизмом, получавших рекомбинантный фолликулостимулирующий гормон человека и хорионический гонадотропин человека.
Фертил Стерил
2009; 92: 594-604. [PubMed] [Google Scholar] 14. Burgués S, Calderón MD. Самостоятельное подкожное введение высокоочищенного фолликулостимулирующего гормона и хорионического гонадотропина человека для лечения мужского гипогонадотропного гипогонадизма.Испанская совместная группа по мужскому гипогонадотропному гипогонадизму.
Hum Reprod
1997; 12: 980-6. [PubMed] [Google Scholar] 15. Миягава Ю., Цудзимура А., Мацумия К. и др.
Результат терапии гонадотропинами мужского гипогонадотропного гипогонадизма в университетских центрах мужского бесплодия: 30-летнее ретроспективное исследование.
Дж Урол
2005; 173: 2072-5. [PubMed] [Google Scholar] 16. Лю П.Я., Бейкер Х.В., Джаядев В. и др.
Индукция сперматогенеза и фертильности во время лечения гонадотропинами мужчин с гонадотропным дефицитом бесплодия: предикторы исхода фертильности.J Clin Endocrinol Metab
2009; 94: 801-8. [PubMed] [Google Scholar] 17. Булу PM, Nieschlag E, Burger HG и др.
Индукция сперматогенеза рекомбинантным фолликулостимулирующим гормоном (пурегон) у мужчин с гипогонадотропной азооспермией, которые не реагировали только на хорионический гонадотропин человека.
Дж. Андрол
2003; 24: 604-11. [PubMed] [Google Scholar] 18. Финкель Д.М., Филлипс Д.Л., Снайдер П.Дж. Стимуляция сперматогенеза гонадотропинами у мужчин с гипогонадотропным гипогонадизмом.
N Engl J Med
1985; 313: 651-5.[PubMed] [Google Scholar] 19. Беррис А.С., Родбард Х.В., Винтерс С.Дж. и др.
Терапия гонадотропинами у мужчин с изолированным гипогонадотропным гипогонадизмом: реакция на хорионический гонадотропин человека определяется исходным размером яичек.
J Clin Endocrinol Metab
1988; 66: 1144-51. [PubMed] [Google Scholar] 20. Knuth UA, Hönigl W., Bals-Pratsch M, et al.
Лечение тяжелой олигоспермии хорионическим гонадотропином человека / менопаузальным гонадотропином человека: плацебо-контролируемое двойное слепое исследование.
J Clin Endocrinol Metab
1987; 65: 1081-7.[PubMed] [Google Scholar] 21. Камишке А., Бехре Х.М., Бергманн М. и др.
Рекомбинантный фолликулостимулирующий гормон человека для лечения мужского идиопатического бесплодия: рандомизированное двойное слепое плацебо-контролируемое клиническое исследование.
Hum Reprod
1998; 13: 596-603. [PubMed] [Google Scholar] 22. Фореста С., Беттелла А., Гаролла А. и др.
Лечение мужского идиопатического бесплодия рекомбинантным фолликулостимулирующим гормоном человека: проспективное контролируемое рандомизированное клиническое исследование.
Фертил Стерил
2005; 84: 654-61.[PubMed] [Google Scholar] 23. Сикарис К., Маклахлан Р.И., Казлаускас Р. и др.
Референсные интервалы репродуктивных гормонов для здоровых фертильных молодых мужчин: оценка автоматизированных анализов платформы.
J Clin Endocrinol Metab
2005; 90: 5928-36. [PubMed] [Google Scholar] 24. Гордецкий Дж., Ван Вейнгаарден Э., О’Брайен Дж.
Новое определение аномального фолликулостимулирующего гормона в популяции мужского бесплодия.
BJU Int
2012; 110: 568-72. [PubMed] [Google Scholar] 25. Вебстер Дж., Пискителли Дж., Полли А. и др.
Дозозависимое подавление сывороточного пролактина каберголином при гиперпролактинемии: плацебо-контролируемое двойное слепое многоцентровое исследование.Европейская многоцентровая исследовательская группа по подбору доз каберголина.
Клин Эндокринол (Oxf)
1992; 37: 534-41. [PubMed] [Google Scholar] 26. Верхелст Дж., Абс Р., Мейтер Д. и др.
Каберголин в лечении гиперпролактинемии: исследование с участием 455 пациентов.
J Clin Endocrinol Metab
1999; 84: 2518-22. [PubMed] [Google Scholar] 27. Мелмед С., Касануева Ф.Ф., Хоффман А.Р. и др.
Диагностика и лечение гиперпролактинемии: руководство по клинической практике эндокринного общества.
J Clin Endocrinol Metab
2011; 96: 273-88. [PubMed] [Google Scholar] 28.Bharti S, Misro MM, Rai U. Цитрат кломифена потенцирует неблагоприятные эффекты эстрогена на семенники крысы и подавляет экспрессию генов стероидогенных ферментов.
Фертил Стерил
2013; 99: 140-8. [PubMed] [Google Scholar] 29. Santen RJ. Контроль обратной связи секреции лютеинизирующего гормона и фолликулостимулирующего гормона тестостероном и эстрадиолом у мужчин: физиологические и клинические последствия.
Clin Biochem
1981; 14: 243-51. [PubMed] [Google Scholar] 30. Раман Дж. Д., Шлегель П. Н.. Ингибиторы ароматазы при мужском бесплодии.Дж Урол
2002; 167: 624-9. [PubMed] [Google Scholar] 31. Шлегель ПН. Ингибиторы ароматазы при мужском бесплодии.
Фертил Стерил
2012; 98: 1359-62. [PubMed] [Google Scholar] 32. Кларк Р.В., Шеринс Р.Дж. Лечение мужчин с идиопатическим олигозооспермическим бесплодием с помощью ингибитора ароматазы тестолактона. Результаты двойного слепого рандомизированного плацебо-контролируемого исследования с кроссовером.
Дж. Андрол
1989; 10: 240-7. [PubMed] [Google Scholar] 33. Павлович С.П., Кинг П., Гольдштейн М. и др.
Доказательства излечимой эндокринопатии у бесплодных мужчин.Дж Урол
2001; 165: 837-41. [PubMed] [Google Scholar] 34. Сайлам Б., Эфесой О., Каян С.
Влияние ингибитора ароматазы летрозола на индекс массы тела, сывороточные гормоны и параметры спермы у бесплодных мужчин.
Фертил Стерил
2011; 95: 809-11. [PubMed] [Google Scholar] 35. Рот М.Ю., Амори Дж. К., Пейдж СТ. Лечение мужского бесплодия, вторичного по отношению к патологическому ожирению.
Нат Клин Практ Эндокринол Метаб
2008; 4: 415-9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Зумофф Б., Миллер Л.К., Штамм Г.В. Устранение гипогонадотропного гипогонадизма у мужчин с ожирением путем введения ингибитора ароматазы тестолактона.Метаболизм
2003; 52: 1126-8. [PubMed] [Google Scholar] 37. Грегориу О., Бакас П., Григориадис С. и др.
Изменения гормонального фона и семенных параметров при использовании ингибиторов ароматазы при лечении бесплодных мужчин с низким соотношением тестостерона и эстрадиола.
Фертил Стерил
2012; 98: 48-51. [PubMed] [Google Scholar] 38. Финкельштейн Дж. С., Ли Х., Бернетт-Боуи С. А. и др.
Гонадные стероиды и состав тела, сила и сексуальная функция у мужчин.
N Engl J Med
2013; 369: 1011-22. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39.Гольдштейн С.Р., Сиддханти С., Чачча А.В. и др.
Фармакологический обзор селективных модуляторов рецепторов эстрогена.
Обновление Hum Reprod
2000; 6: 212-24. [PubMed] [Google Scholar] 40. Кац Д. Д., Набулси О., Тал Р. и др.
Результаты лечения кломифена цитратом у молодых мужчин с гипогонадизмом.
BJU Int
2012; 110: 573-8. [PubMed] [Google Scholar] 41. Whitten SJ, Nangia AK, Kolettis PN. Некоторые пациенты с гипогонадотропным гипогонадизмом могут реагировать на лечение кломифена цитратом.
Фертил Стерил
2006; 86: 1664-8. [PubMed] [Google Scholar] 42.Хусейн А., Озгок Ю., Росс Л. и др.
Применение кломифена при необструктивной азооспермии: многоцентровое исследование.
Дж. Андрол
2005; 26: 787-91; обсуждение 792-3. [PubMed] [Google Scholar] 43. Фармакиотис Д., Фармакис С., Руссо Д. и др.
Благоприятное влияние торемифена на ось гипоталамус-гипофиз-яички и параметры сперматозоидов у мужчин с идиопатической олигозооспермией.
Фертил Стерил
2007; 88: 847-53. [PubMed] [Google Scholar] 44. Цурди Э., Куртис А., Фармакиотис Д. и др.Влияние селективного введения модулятора рецептора эстрогена на ось гипоталамус-гипофиз-яички у мужчин с идиопатической олигозооспермией.
Фертил Стерил
2009; 91: 1427-30. [PubMed] [Google Scholar] 45. Чуа М.Э., Эскуса К.Г., Луна С. и др.
Возвращение к антагонистам эстрогена (кломифен или тамоксифен) в качестве медицинской эмпирической терапии идиопатического мужского бесплодия: метаанализ.
Андрология
2013; 1: 749-57. [PubMed] [Google Scholar] 46. Вандекеркхов П., Лилфорд Р., Вейл А. и др.
Кломифен или тамоксифен при идиопатической олиго / астеноспермии.Кокрановская база данных Syst Rev
2000; (2): CD000151. [PubMed] [Google Scholar] 47. Виллетс А.Е., Корбо Дж. М., Браун Дж. Н.. Кломифен для лечения мужского бесплодия.
Репродукция науки
2013; 20: 739-44. [PubMed] [Google Scholar] 48. Шарма Р.К., Агарвал А. Роль активных форм кислорода в мужском бесплодии.
Урология
1996; 48: 835-50. [PubMed] [Google Scholar] 49. Салех Р.А., Агарвал А. Окислительный стресс и мужское бесплодие: от исследовательского стенда к клинической практике.
Дж. Андрол
2002; 23: 737-52. [PubMed] [Google Scholar] 50. Рольф С., Купер Т.Г., Йунг С.Х. и др.Антиоксидантное лечение пациентов с астенозооспермией или умеренной олигоастенозооспермией высокими дозами витамина C и витамина E: рандомизированное плацебо-контролируемое двойное слепое исследование.
Hum Reprod
1999; 14: 1028-33. [PubMed] [Google Scholar] 51. Греко Э., Якобелли М., Риенци Л. и др.
Снижение частоты фрагментации ДНК сперматозоидов за счет перорального лечения антиоксидантами.
Дж. Андрол
2005; 26: 349-53. [PubMed] [Google Scholar] 52. Paradiso Galatioto G, Gravina GL, Angelozzi G и др.
Может ли антиоксидантная терапия улучшить параметры спермы у мужчин со стойкой олигоспермией после ретроградной эмболизации варикоцеле?
Мир Дж Урол
2008; 26: 97-102.[PubMed] [Google Scholar] 53. Росс С., Моррисс А., Хайри М. и др.
Систематический обзор влияния пероральных антиоксидантов на мужское бесплодие.
Репродукция Биомед онлайн
2010; 20: 711-23. [PubMed] [Google Scholar] 54. Рамасами Р., Риччи Дж. А., Палермо Г. Д. и др.
Успешное лечение бесплодия при синдроме Клайнфельтера.
Дж Урол
2009; 182: 1108-13. [PubMed] [Google Scholar] 55. Reifsnyder JE, Ramasamy R, Husseini J, et al.
Роль оптимизации тестостерона перед извлечением спермы яичек микродиссекцией у мужчин с необструктивной азооспермией.Дж Урол
2012; 188: 532-6. [PubMed] [Google Scholar] 56. Aydos K, Unlü C, Demirel LC и др.
Влияние введения чистого ФСГ у мужчин с необструктивной азооспермией на получение сперматозоидов из яичек.
Eur J Obstet Gynecol Reprod Biol
2003; 108: 54-8. [PubMed] [Google Scholar] 57. Сираиси К., Оми К., Симабукуро Т. и др.
Лечение хорионическим гонадотропином человека перед микродиссекцией семенников из яичек при необструктивной азооспермии.
Hum Reprod
2012; 27: 331-9. [PubMed] [Google Scholar] 58. Селман Х., Де Санто М., Стерзик К. и др.Спасение остановки сперматогенеза у мужчин с азооспермией после длительного лечения гонадотропинами.
Фертил Стерил
2006; 86: 466-8. [PubMed] [Google Scholar] 59. Хусейн А., Озгок Ю., Росс Л. и др.
Оптимизация гормонов, регулирующих сперматогенез, у пациентов с необструктивной азооспермией и ее влияние на получение спермы: многоцентровое исследование.
BJU Int
2013; 111: E110-4. [PubMed] [Google Scholar]
Каковы врожденные причины высокого уровня фолликулостимулирующего гормона (ФСГ)?
Grover A, Smith CE, Gregory M, et al.Влияние делеции рецептора ФСГ на эпидидимальные канальцы и морфологию, количество и подвижность сперматозоидов. Мол Репрод Дев . 2005 Октябрь 72 (2): 135-44. [Медлайн].
Ardawi MS, Rouzi AA. Адипонектин плазмы и инсулинорезистентность у женщин с синдромом поликистозных яичников. Фертил Стерил . 2005 июн. 83 (6): 1708-16. [Медлайн].
Walvoord E. Замена половых стероидов для индукции полового созревания при недостаточности множественных гормонов гипофиза. Педиатр эндокринол Ред. . 2009, 6 января, приложение 2: 298-305. [Медлайн].
Топалоглу АК. Обновленная информация о генетике идиопатического гипогонадотропного гипогонадизма. Дж Клин Рес Педиатр Эндокринол . 2017 30 декабря. 9 (Приложение 2): 113-22. [Медлайн]. [Полный текст].
Каргес Б., де Ру Н. Молекулярная генетика изолированного гипогонадотропного гипогонадизма и синдрома Каллмана. Эндокр Дев . 2005. 8: 67-80. [Медлайн].
Fraietta R, Zylberstejn DS, Esteves SC.Возвращение к гипогонадотропному гипогонадизму. Клиники (Сан-Паулу) . 2013. 68 Дополнение 1: 81-8. [Медлайн]. [Полный текст].
Zhang C, Verma V, Lyden ER, et al. Роль окончательной лучевой терапии при краниофарингиоме: анализ SEER. Ам Дж. Клин Онкол . 2017 г. 3 марта [Medline].
Отто А.П., Франка М.М., Корреа Ф.А. и др. Частое развитие комбинированного дефицита гормона гипофиза у пациентов, изначально диагностированных как изолированный дефицит гормона роста: длительное наблюдение за пациентами из одного центра. Гипофиз . 2015 18 августа (4): 561-7. [Медлайн].
Nagorny P, Sane N, Fasching B, Aussedat B, Danishefsky SJ. Исследование границ синтеза гликопротеинов: полностью разработанная ß-субъединица фолликулостимулирующего гормона человека. Энгью Хем Мент Энд Энгл . 2011, 9 декабря. [Medline].
Дандона П., Дхиндса С., Чаудхури А. и др. Гипогонадотропный гипогонадизм при сахарном диабете 2 типа. Пожилой мужчина . 2008 сен.11 (3): 107-17. [Медлайн].
Ферхи К., Авакян Р., Гриво Дж. Ф. и др. Возраст как единственный прогностический фактор успешного восстановления спермы у пациентов с синдромом Клайнфельтера. Андрология . 2009 Апрель 41 (2): 84-7. [Медлайн].
Викстром AM, Дункель Л. Функция яичек при синдроме Клайнфельтера. Horm Res . 2008. 69 (6): 317-26. [Медлайн].
Ван Саен Д., Гис И., Де Шеппер Дж., Турне Х, Гуссенс Э.Может ли пубертатный мальчик с синдромом Клайнфельтера получить пользу от банка сперматогониальных стволовых клеток? Репродукция Человека . 2011 12 декабря [Medline].
Desai SS, Roy BS, Mahale SD. Мутации и полиморфизмы рецептора ФСГ: функциональные последствия для воспроизводства человека. Репродукция . 2013 декабрь 146 (6): R235-48. [Медлайн].
Rohayem J, Luberto A, Nieschlag E, Zitzmann M, Kliesch S. Отсроченное лечение неопущенных яичек может способствовать гипогонадизму и бесплодию. Эндокринная . 2017 Март 55 (3): 914-24. [Медлайн].
Cools M, Rooman RP, Wauters J, et al. Немозаичный кариотип 45, X у матери с синдромом Тернера и у ее дочери. Фертил Стерил . 2004 Октябрь 82 (4): 923-5. [Медлайн].
Livadas S, Xekouki P, Kafiri G, et al. Самопроизвольная беременность и рождение здоровой женщины от женщины с синдромом Тернера и повышенным уровнем гонадотропинов. Фертил Стерил . 2005 Март.83 (3): 769-72. [Медлайн].
Gruber N, Kugler S, de Vries L, et al. Частота и этиология первичной недостаточности яичников среди израильских подростков. Дж. Здоровье подростков . 2020 24 января. [Medline].
Trabado S, Maione L, Salenave S, Baron S, Galland F, Bry-Gauillard H, et al. Уровни эстрадиола у мужчин с врожденным гипогонадотропным гипогонадизмом и эффекты различных методов гормонального лечения. Фертил Стерил .2011 июн. 95 (7): 2324-9, 2329.e1-3. [Медлайн].
Efesoy O, Cayan S, Akbay E. Эффективность рекомбинантного человеческого фолликулостимулирующего гормона в лечении различных типов мужского бесплодия в одной университетской больнице. Дж Андрол . 2009 28 мая. [Medline]. [Полный текст].
Casarini L, Crepieux P, Reiter E, et al. ФСГ для лечения мужского бесплодия. Int J Mol Sci . 2020 25 марта. 21 (7): [Medline].[Полный текст].
Bry-Gauillard H, Larrat-Ledoux F, Levaillant JM, et al. Антимюллеров гормон и морфология яичников у женщин с изолированным гипогонадотропным гипогонадизмом / синдромом Каллмана: эффекты рекомбинантного человеческого ФСГ. Дж Клин Эндокринол Метаб . 2017 г. 1. 102 (4): 1102-11. [Медлайн]. [Полный текст].
Zhang M, Tong G, Liu Y и др. Последовательный и непрерывный очищенный мочевой ФСГ / ХГЧ у мужчин с идиопатическим гипогонадотропным гипогонадизмом. Дж Клин Эндокринол Метаб . 2015 июн.100 (6): 2449-55. [Медлайн].
Rohayem J, Sinthofen N, Nieschlag E, Kliesch S, Zitzmann M. Причины гипогонадотропного гипогонадизма предсказывают ответ на замену гонадотропинов у взрослых. Андрология . 2016 4 января (1): 87-94. [Медлайн].
границ | Клиническое использование ФСГ при мужском бесплодии
Введение
При мужском бесплодии показанием для лечения фолликулостимулирующим гормоном (ФСГ) является индукция и поддержание сперматогенеза у пациентов с гипогонадотропным гипогонадизмом (1).Поскольку эти пациенты обычно страдают азооспермией без стимуляции гонадотропинами и во время терапии тестостероном, наличие достаточно большого количества прогрессивно подвижных и нормально сформированных сперматозоидов в эякуляте во время терапии экзогенными гонадотропинами может привести к желаемой клинической беременности для многих бесплодных пар. На экспериментальной основе, а в некоторых случаях уже в клинической практике, препараты ФСГ также используются для лечения мужчин с нормогонадотропным бесплодием и идиопатическим нарушением сперматогенеза (2, 3).
Первичной целью терапии ФСГ у гипогонадотропных или нормогонадотропных пациентов является не стимуляция роста яичек или сперматогенеза per se , а индукция беременности у партнерши бесплодной пары и, наконец, живорождение здорового человека. ребенок. В этом обзоре суммированы эффекты лечения ФСГ на этот первичный клинический результат в этих двух группах пациентов с мужским бесплодием. Введение ФСГ детям или в подростковом возрасте не является темой этого обзора.
Терапия ФСГ мужского бесплодия у пациентов с гипогонадотропным гипогонадизмом
У пациентов с гипогонадотропным гипогонадизмом мужское бесплодие возникает из-за отсутствия стимуляции сперматогенеза гонадотропинами ФСГ и лютеинизирующим гормоном (ЛГ). При так называемом идиопатическом / изолированном / врожденном гипогонадотропном гипогонадизме (IHH или CHH) и синдроме Каллмана основным патофизиологическим признаком является нарушение гипоталамического синтеза или секреции гонадотропин-рилизинг-гормона (GnRH) (4).Это приводит к снижению или отсутствию синтеза или секреции ЛГ и ФСГ нестимулированным гипофизом и, наконец, к эндокринному гипогонадизму с низким уровнем тестостерона в сыворотке крови и бесплодию с азооспермией или тяжелой олигозооспермией в качестве соответствующих лабораторных маркеров. Различные другие заболевания, включая вторичный дефицит ГнРГ, приводят к той же патофизиологии (4).
Другими причинами гипогонадотропного гипогонадизма являются недостаточность гипофиза, вызванная опухолями (особенно макропролактиномами), метастазы гипофиза и гипофизарной ножки, послеоперационные состояния, лучевая терапия области гипофиза, травмы, инфекции, гемохроматоз, сосудистые нарушения и другие. (4).Гипогонадотропный гипогонадизм вызван недостаточностью гипофиза для секретирования значительных уровней ЛГ и ФСГ. На клиническую картину у этих пациентов дополнительно влияют возможные нарушения других гормонов гипофиза.
Терапия выбора для пациентов с гипогонадотропным гипогонадизмом, вызванная различными патофизиологическими причинами, как упомянуто выше, — на протяжении большей части жизни — экзогенная замена тестостерона для поддержания всех андрогензависимых функций.Эта терапия хорошо зарекомендовала себя на протяжении десятилетий, относительно удобна для пациентов мужского пола и сравнительно недорогая (5).
В случае, если у пациентов возникает желание иметь детей от своей партнерши, заместительной терапии тестостероном становится недостаточно, и ее необходимо прервать. Затем пациентов следует лечить препаратами ФСГ и в дополнение к фармакологическим препаратам для стимуляции выработки интратестикулярного тестостерона клетками Лейдига. Поскольку в настоящее время препараты ЛГ не одобрены для лечения мужского гипогонадотропного гипогонадизма, пациентов обычно лечат препаратами хорионического гонадотропина человека (ХГЧ) с аналогичной, но не идентичной биологической активностью (6).ХГЧ имеет более длительный период полувыведения, чем ЛГ, и пациентов можно эффективно лечить двумя инъекциями в неделю (4).
У пациентов с гипогонадотропным гипогонадизмом, вызванным гипоталамическими расстройствами, для лечения также можно использовать экзогенный пульсирующий гонадолиберин, поскольку он стимулирует секрецию ФСГ и ЛГ гипофизом (4, 7). Из-за сложной и трудоемкой пульсирующей терапии сегодня только несколько пациентов с гипогонадотропным гипогонадизмом лечат пульсирующим ГнРГ.Пульсирующая терапия гонадолиберином, по-видимому, не имеет доказанных преимуществ перед терапией ФСГ плюс ХГЧ у пациентов с гипоталамическим гипогонадотропным гипогонадизмом. Однако отсутствие достаточно хорошо спланированных рандомизированных проспективных исследований не позволяет сделать однозначных выводов о наилучшей терапии бесплодия у этих пациентов (8, 9).
Ранний опыт применения чМГ в сочетании с терапией ХГЧ
ФСГ успешно используется для лечения бесплодия у пациентов с гипогонадотропным гипогонадизмом более 50 лет, первоначально с менопаузальными гонадотропинами в моче, обладающими активностью ФСГ.Стоит прочитать первые сообщения о терапии ФСГ у гипогонадотропных пациентов. MacLeod с соавторами сообщили об успешной терапии менопаузальными гонадотропинами в моче у 37-летней пациентки, перенесшей полную гипофизэктомию в 1963 г. (10, 11). Пациент предоставил образец спермы за 1 день до гипофизэктомии, который показал 576 миллионов сперматозоидов на эякулят и довольно хорошую подвижность и морфологию сперматозоидов. После операции качество эякулята значительно снизилось, и через несколько недель после гипофизэктомии пациент больше не мог сдавать образцы спермы.Примерно через 14 недель после гипофизэктомии была проведена двусторонняя биопсия яичка, которая показала инволюцию сперматогенеза до уровня сперматогоний и только несколько участков с первичными сперматоцитами. Через день после первой биопсии яичка пациенту было начато лечение чМГ (менопаузальный гонадотропин человека, выделяемый из мочи человека, в основном с ФСГ и некоторой активностью ЛГ) в дозе примерно 206 МЕ. в день.
После 64 дней лечения гонадотропинами в период менопаузы другая биопсия яичка только правого яичка показала стимулированный сперматогенез, показывая все стадии сперматогенеза, включая поздние удлиненные семенники яичка.Однако восстановление сперматогенеза оказалось нормальным только качественно, но не количественно. Поскольку пациент все еще не мог производить эякулят, вероятно, из-за недостаточной низкой активности ЛГ в препарате чМГ и, следовательно, низкого уровня тестостерона в сыворотке, терапия ХГЧ с использованием 4000 МЕ. через день добавляли для стимуляции выработки тестостерона клетками Лейдига. При этом доза чМГ 206 МЕ. давали уже не ежедневно, а только через день (чередуя с инъекциями ХГЧ).Благодаря комбинированной терапии чМГ и ХГЧ пациент восстановил способность производить эякулят, который показал общее количество сперматозоидов в несколько миллионов с прогрессирующей подвижностью сперматозоидов и нормальной морфологией сперматозоидов, которые все еще были снижены по сравнению с уровнями, проанализированными до гипофизэктомии (11). Позже пациентка решила не продолжать терапию чМГ, и, к сожалению, данные о фертильности отсутствуют. Однако этот ранний подробный отчет четко продемонстрировал принцип терапии ФСГ в сочетании с ХГЧ для стимуляции сперматогенеза у пациентов с гипогонадотропным гипогонадизмом.
Клинические исследования с чМГ в сочетании с терапией ХГЧ
С тех пор несколько пациентов с гипогонадотропным гипогонадизмом успешно прошли курс лечения чМГ плюс ХГЧ для стимуляции сперматогенеза и достижения желаемой беременности у партнера-женщины. Одно из наиболее полных исследований эффективности лечения гипогонадотропного гипогонадизма у пациентов с различной этиологией было опубликовано Büchter et al. более 20 лет назад (8). Это исследование можно рассматривать как референсное исследование для лечения этих пациентов чМГ, поскольку в то время в андрологической клинике все больше и больше чМГ заменяли высокоочищенными или рекомбинантными препаратами ФСГ (12, 13).В этом исследовании Büchter и его коллег 21 пациент с гипогонадотропным гипогонадизмом из-за нарушений гипофиза лечился чМГ плюс ХГЧ. Поскольку некоторым из этих пациентов было проведено более одного курса лечения, в анализ исследования можно было включить 30 курсов лечения. Еще 18 пациентов с гипогонадотропным гипогонадизмом из-за гипоталамических нарушений, таких как синдром Каллмана или врожденный гипогонадотропный гипогонадизм, лечились чМГ плюс ХГЧ (18 случаев, 20 курсов лечения).В целом, 31 из 50 курсов лечения чМГ плюс ХГЧ был начат для индукции беременности у партнерши, а 19 из 50 курсов — только для индукции сперматогенеза.
Во всех 30 курсах лечения (100%) у пациентов с нарушением гипофиза сперматогенез стимулировался от азооспермии до присутствия сперматозоидов в эякуляте. У пациентов с гипоталамическим расстройством терапия гонадотропинами индуцировала сперматогенез в 18 из 20 курсов лечения (90%).Продолжительность терапии до первого обнаружения сперматозоидов в эякуляте была весьма различной. У пациентов с заболеванием гипофиза среднее время лечения составляло 4 месяца (от 2 до 16 месяцев). У пациентов с гипоталамическим расстройством средняя продолжительность лечения составляла 6 месяцев (1–18 месяцев). Время до индукции беременности партнерши у пациентов с нарушениями гипофиза составляло 10 месяцев (2–46 месяцев) и 8 месяцев (1–15 месяцев) у пациентов с нарушениями гипоталамуса.В эту обзорную статью была включена информация о беременностях, которая была добавлена в подтверждение публикации Büchter et al. (8). Дополнительная беременность у партнерши произошла после лечения гонадотропином одной пациентки с нарушением гипофиза в течение 42 месяцев, а также одной пациентки с гипоталамическим расстройством, леченной в течение 48 месяцев. С учетом этих данных, терапия чМГ плюс ХГЧ у пациентов с нарушением гипофиза привела к 18 беременностям в ходе 21 курса лечения (86%) и 6 беременностям в ходе 10 курсов лечения (60%) у пациентов с нарушением гипоталамуса (8).По сравнению с другими современными методами лечения бесплодия, включая применение вспомогательных репродуктивных технологий (ВРТ), эта «причинная» терапия мужского бесплодия у пациентов с гипогонадотропным гипогонадизмом оказалась высокоэффективной (14).
Факторы, влияющие на эффективность лечения
Хотя терапия чМГ плюс ХГЧ у бесплодных пациентов с гипогонадотропным гипогонадизмом оказывается довольно успешной в отношении стимуляции сперматогенеза и, наконец, индукции клинической беременности у партнера-женщины, лечение может длиться довольно долго.Пациенты должны быть проинформированы о том, что гормональная терапия может длиться несколько месяцев и даже лет, прежде чем может быть достигнута желаемая беременность. Следовательно, важно определить прогностические факторы, влияющие на эффективность лечения (вставка 1).
Вставка 1. Прогностические факторы успеха лечения .
Клинические факторы при начале терапии ФСГ плюс ХГЧ у взрослых пациентов мужского пола с гипогонадотропным гипогонадизмом, позволяющие прогнозировать успешное лечение бесплодия (15)
• В анамнезе нормальное половое созревание или задержка пубертата
• Нет истории крипторхизма
• Более высокий исходный объем яичка
• Более высокие исходные уровни ингибина B в сыворотке
В недавнем исследовании 51 взрослого пациента с гипогонадотропным гипогонадизмом, прошедшего один курс лечения ФСГ (мочевой или рекомбинантный ФСГ) плюс ХГЧ, те пациенты, у которых был гипогонадотропный гипогонадизм, приобретенный после полового созревания, или у которых была остановка полового созревания, показали значительно лучшие результаты лечения (15). ).Эти пациенты достигли более высокого конечного двустороннего объема яичек и более высоких конечных концентраций сперматозоидов по сравнению с пациентами с гипогонадотропным гипогонадизмом, проявляющимся до нормального начала полового созревания. Наиболее важно то, что частота наступления беременности на 62% была выше у пациенток с постпубертатным гипогонадотропным гипогонадизмом по сравнению с пациентами с пре-пубертатным гипогонадизмом (42%). Кроме того, зачатие у женщин-партнеров пациентов с постпубертатным гипогонадотропным гипогонадизмом произошло значительно раньше (20.3 ± 11,5 мес.), Чем у женщин-партнеров пациентов с препубертатным гипогонадизмом (43,1 ± 43,8 мес.).
Терапевтический успех был также выше у пациентов без ранее не опущенных яичек, у пациентов с более высоким исходным объемом яичек и у пациентов с более высокими исходными концентрациями ингибина B в сыворотке (15). Идентификация этих прогностических факторов согласуется с различными клиническими исследованиями, проведенными другими исследовательскими группами (16–21).
Клинические исследования с рекомбинантным или мочевым ФСГ в сочетании с терапией ХГЧ
Не было проведено адекватных крупных рандомизированных контролируемых исследований (РКИ) для сравнения эффективности рекомбинантного или высокоочищенного ФСГ с мочевыми препаратами чМГ у мужчин — в отличие от применения препаратов ФСГ у женщин для АРТ.Из доступной информации кажется, что эффективность различных препаратов ФСГ у пациентов мужского пола с гипогонадотропным гипогонадизмом вполне сопоставима в отношении стимуляции сперматогенеза и индукции желаемой беременности у партнера-женщины (13, 18, 20-25). Сегодня в Германии для этой терапии у пациентов мужского пола разрешены только рекомбинантные ФСГ, а не препараты ФСГ из мочи.
Общие схемы дозирования
Одной из наиболее распространенных схем дозирования гонадотропинов при мужском гипогонадотропном гипогонадизме является введение 150–225 I.ЕД ФСГ два или три раза в неделю в сочетании с 1000–2500 МЕ. ХГЧ два раза в неделю (4). Некоторые врачи начинают лечение только ХГЧ в течение, например, 3 месяцев, поскольку некоторые пациенты — возможно, с некоторой остаточной активностью ФСГ — достигают стимуляции сперматогенеза одним ХГЧ (13, 20, 25, 26). Однако концентрации сперматозоидов, наблюдаемые после терапии только ХГЧ, по-видимому, ниже, чем при комбинированном лечении ФСГ плюс ХГЧ (27). Следовательно, этим пациентам, принимающим ХГЧ, в какой-то момент также следует добавлять ФСГ для достижения наилучшего результата лечения.Кроме того, было показано, что индукция сперматогенеза, достигаемая лечением ФСГ плюс ХГЧ при гипогонадотропном гипогонадизме, может поддерживаться качественно, но не количественно у большинства пациентов с одним только ХГЧ (28). В этой связи для снижения относительно высоких затрат на терапию гонадотропинами была предложена последовательная терапия с 3-месячным лечением ФСГ плюс ХГЧ с чередованием только терапии ХГЧ в течение еще 3 месяцев (29). Тем не менее, неизвестно, обладает ли этот режим дозирования такой же высокой эффективностью в отношении частоты клинической беременности с первичным исходом.
Доза и интервал введения ФСГ могут быть адаптированы для отдельных пациентов с гипогонадотропностью для достижения оптимального результата лечения. Эффективность можно контролировать по увеличению объема яичек, стимуляции сперматогенеза, достигнутым уровням ФСГ в сыворотке крови, достигнутым уровням тестостерона в сыворотке и другим факторам. К сожалению, отсутствуют крупные рандомизированные сравнительные исследования с разными препаратами ФСГ, разными дозами и разными интервалами между инъекциями (13, 24).Ретроспективное исследование показало, что более низких еженедельных доз ФСГ достаточно для стимуляции сперматогенеза и индукции желаемой беременности у партнерши (24). Другие утверждали, что доза ХГЧ в сочетании с ФСГ может быть слишком высокой для оптимального лечебного эффекта (30). Поскольку нынешние схемы дозирования ФСГ и ХГЧ все еще имеют недостаток, заключающийся в довольно длительной продолжительности лечения до достижения желаемой беременности, все еще кажется полезным испытать различные препараты и режимы дозирования ФСГ и ХГЧ с помощью надлежащим образом спланированных рандомизированных контролируемых клинических испытаний для улучшения результатов лечения. терапии гонадотропинами при мужском гипогонадотропном гипогонадизме.
ФСГ в сочетании с рекомбинантным ХГЧ или ЛГ
В Германии препараты рекомбинантного ХГЧ и ЛГ одобрены для терапии репродуктивными гормонами у женщин. У мужчин до сих пор не опубликовано адекватных исследований, сравнивающих эти препараты с мочевым ХГЧ. Комбинация рекомбинантного ФСГ с рекомбинантным ЛГ или ХГЧ в одной инъекционной ручке позволит упростить самостоятельное введение, более точную настройку индивидуальной терапии, более высокую комплаентность и, возможно, более высокую эффективность лечения. Кроме того, можно предположить, что ЛГ вместо терапии ХГЧ в сочетании с ФСГ может привести к гораздо большей клинической эффективности в отношении стимуляции сперматогенеза и частоты наступления беременности при мужском гипогонадотропном гипогонадизме (6, 30).Пока шприцы для инъекций с рекомбинантным ЛГ одобрены только для лечения женщин, и пришло время предоставить эти возможности также пациентам с гипогонадотропностью мужского пола. Следует поощрять фармацевтические компании к проведению соответствующих клинических исследований.
Препараты ФСГ длительного действия
Другим вариантом улучшения лечения могло бы стать использование аналогов ФСГ длительного действия, которые уже успешно используются при лечении бесплодия у женщин. В недавнем многоцентровом клиническом исследовании фазы III корифоллитропина альфа у мужчин с азооспермией и гипогонадотропным гипогонадизмом было продемонстрировано, что введение 150 мкг препарата ФСГ длительного действия, вводимого каждую вторую неделю, приводит к значительному увеличению объема яичек и индукции сперматогенеза, что сопоставимо. к эффектам, наблюдаемым при использовании рекомбинантных препаратов ФСГ короткого действия (25).
Терапия ФСГ у мужчин с нормогонадотропом и идиопатическим бесплодием
Ранние нерандомизированные исследования
Поскольку терапия ФСГ оказалась довольно успешной в отношении стимуляции сперматогенеза у пациентов с гипогонадотропным гипогонадизмом и частоты наступления беременности у их партнеров-женщин, было проверено, может ли эта терапия также успешно применяться у пациентов мужского пола с нормогонадотропным идиопатическим бесплодием. Ранние неконтролируемые исследования этих пациентов с терапией чМГ плюс ХГЧ в течение периода лечения 3 месяца продемонстрировали увеличение общего количества сперматозоидов в эякуляте, а также частоту наступления беременности у партнеров-женщин (31).Увеличение частоты наступления беременности было особенно очевидным у так называемых респондеров, которые определялись увеличением количества сперматозоидов как минимум на 25 миллионов на эякулят (31).
Рандомизированные исследования под контролем плацебо
Однако нельзя исключать, что положительные эффекты ФСГ у нормогонадотропных пациентов в неконтролируемых исследованиях были обусловлены хорошо известным феноменом регрессии к среднему. Следовательно, эффективность лечения чМГ плюс ХГЧ в течение 13 недель у нормогонадотропных пациентов с олигозооспермией была пересмотрена в рандомизированном плацебо-контролируемом двойном слепом клиническом исследовании.Положительные эффекты, наблюдаемые в неконтролируемых испытаниях, не могут быть подтверждены этим рандомизированным исследованием. Воздействие на классические переменные анализа эякулята по данным ВОЗ было сходным в группе, получавшей реальный препарат, и в группе плацебо (32). Однако две из 19 пациенток, получавших чМГ плюс ХГЧ, достигли беременности у партнера-женщины в течение 2 месяцев после прекращения лечения, в то время как у 20 пациентов, получавших плацебо, беременность не вызывалась.
Из-за небольшого числа включенных пациенток это рандомизированное контролируемое исследование не имело достаточной мощности, чтобы сделать выводы о частоте наступления беременности.Кроме того, обычный анализ эякулята может не выявить всех положительных эффектов, влияющих на фертильность. Терапия ФСГ оказывает явное положительное влияние на конденсацию и фрагментацию ДНК сперматозоидов, что, по-видимому, весьма актуально для фертильности (2, 33–37). Эти аспекты могут игнорироваться стандартными процедурами анализа спермы, рекомендованными в настоящее время ВОЗ (38).
Мета-анализ контролируемых исследований
Поскольку опубликованных контролируемых исследований с достаточно большим количеством участников еще нет, влияние на частоту наступления беременности можно оценить только с помощью метаанализа.В 2013 г. в обновленном Кокрановском обзоре обобщены научные данные об эффективности терапии гонадотропинами при идиопатическом бесплодии по мужскому фактору для увеличения частоты клинических беременностей у партнера-женщины (таблица 1) (39). В этом обзоре учитывались только РКИ с ФСГ / чМГ отдельно или в комбинации с ХГЧ для пациентов с идиопатическим бесплодием по мужскому фактору, в которых контрольная группа получала плацебо или не лечилась. Наконец, в анализ были включены шесть РКИ. Показатель самопроизвольной беременности в результате естественного полового акта у 16% женщин-партнеров пациенток, получающих лечение гонадотропинами, оказался значительно выше, чем уровень спонтанной беременности 7% у партнеров мужчин, получавших плацебо или не получавших лечения (отношение шансов Пето [ИЛИ ] 4.94, 95% ДИ 2,13–11,44; 5 клинических исследований; 412 участников; доказательства среднего качества). Не было замечено различий в частоте наступления беременности между контрольной и контрольной группами после дополнительного лечения с помощью интрацитоплазматической инъекции сперматозоидов (ИКСИ) или внутриматочной инсеминации, но количество включенных пациенток было слишком низким, чтобы сделать окончательные выводы.
Таблица 1 . Основные результаты двух недавних метаанализов частоты наступления беременности после лечения ФСГ у мужчин с идиопатическим бесплодием.
Недавно Santi et al. Провели еще один комплексный метаанализ (таблица 1) по частоте клинических беременностей как основной переменной результата. включая все контролируемые клинические испытания по введению ФСГ (включая одно небольшое исследование с чМГ плюс ХГЧ) партнерам-мужчинам с идиопатическим бесплодием (40). Рандомизация не была критерием включения в этот анализ. Всего было включено 15 контролируемых клинических испытаний с участием 614 мужчин, получавших ФСГ, и 661 пациента, получавших плацебо или нелеченных.В девяти из 15 исследований сообщалось о частоте спонтанных беременностей (384 пациентки, получавшие ФСГ, 308 пациенток из контрольной группы). Частота самопроизвольной беременности в этих девяти исследованиях была значительно выше у пациенток, получавших ФСГ, по сравнению с контрольной группой (ОШ 4,50, 95% ДИ 2,17–9,33). В восьми исследованиях оценивалась частота наступления беременности после терапии ФСГ и применения дополнительной АРТ (322 пациентки, получавшие ФСГ, 275 контрольных). В этом метаанализе частота беременностей, связанных с АРТ, оказалась значительно выше у женщин-партнеров пациентов мужского пола, получавших ФСГ, по сравнению с контрольной группой (OR 1.60, 95% ДИ 1,08–2,37).
Размер эффекта терапии ФСГ на частоту наступления беременности
Хотя эти метаанализы продемонстрировали, что терапия ФСГ при идиопатическом нормогонадотропном мужском бесплодии может увеличить клиническую беременность у партнеров-женщин, размер эффекта все еще относительно невелик. Было подсчитано, что для достижения одной спонтанной беременности 10 пациенткам необходимо лечить ФСГ (40). Восемнадцати пациенткам необходимо лечить ФСГ, чтобы добиться еще одной беременности после АРТ (40).Поскольку препараты ФСГ довольно дороги и многие врачи, занимающиеся лечением бесплодия, считают этот эффект недостаточно высоким, лечение ФСГ при идиопатическом мужском бесплодии до сих пор не входит в стандартную схему лечения и не покрывается страховыми компаниями во многих странах (3).
Выбор правильного пациента с нормогонадотропом для терапии ФСГ
Чтобы преодолеть эти недостатки, необходимо обязательно правильно выбрать пациентов для терапии ФСГ. Доказательства относительно терапии ФСГ у нормогонадотропных пациентов пока ограничиваются идиопатическим бесплодием, а это означает, что не удалось обнаружить ни одной идентифицируемой, общепринятой причины мужского бесплодия.Следовательно, все пациенты мужского пола должны пройти надлежащее диагностическое андрологическое обследование перед началом любой терапии ФСГ, а также партнерша-женщина должна пройти надлежащее диагностическое гинекологическое обследование! Нормогонадотропные пациенты мужского пола с идентифицируемыми и, возможно, излечимыми причинами мужского бесплодия (например, непроходимость) не должны получать ФСГ. Очевидно, что пациенты мужского пола с повышенным уровнем биоактивного ФСГ в сыворотке крови не должны получать терапию ФСГ. Было предложено не проводить лечение ФСГ бесплодным пациентам с гипосперматогенезом, связанным с нарушениями созревания на уровне сперматид (2).
В дополнение к этим факторам, терапия ФСГ у пациентов с нормозооспермическим бесплодием может быть улучшена путем оптимизации дозы ФСГ, интервала между инъекциями и особенно продолжительности лечения (1). В недавнем проспективном двойном слепом плацебо-контролируемом клиническом исследовании в Китае с участием 354 пациентов с идиопатической олигозооспермией наилучшие результаты были получены у пациентов, получавших самую высокую дозу ФСГ 300 МЕ. каждый второй день и в течение самого длительного периода лечения (максимальная продолжительность лечения в этом исследовании составляла 5 месяцев) (41).Используя знания о терапии гонадотропинами у гипогонадотропных пациентов, можно предположить, что более длительное лечение нормогонадотропных пациентов также улучшит частоту наступления беременности у женщин-партнеров (8).
Еще одним многообещающим подходом к улучшению результатов лечения может быть применение фармакогенетики ФСГ. Одноядерный полиморфизм (SNP) p.N680S в экзоне 10 гена рецептора FSH ( FSHR ), как было показано, влияет на ответ яичников во время контролируемой стимуляции яичников (42).Следовательно, было логично протестировать действие p.N680S также в отношении терапии ФСГ у нормогонадотропных пациентов с идиопатическим бесплодием (34). В этом исследовании первичной переменной результата был индекс фрагментации ДНК (DFI) сперматозоидов в эякуляте (36, 37). Можно показать, что общий DFI значительно снизился от исходного уровня к концу исследования — суррогатный эффект, указывающий на улучшение фертильности — у пациентов мужского пола с гомозиготным полиморфизмом N p.N680S, но не у пациентов с гомозиготным полиморфизмом S. рецептор ФСГ.Эти результаты показывают, что возможен выбор правильных нормогонадотропных пациентов для терапии ФСГ, и, вероятно, для разных групп пациентов можно использовать разные схемы лечения.
За последние годы было проведено несколько фармакогенетических исследований у нормогонадотропных мужчин, в которых тестировались SNP гена бета-субъединицы FSH ( FSHB ), SNP FSHR или их комбинации (34, 35, 43, 44). Эти испытания были подробно рассмотрены Шубертом и его коллегами в этой теме исследования границ в эндокринологии (45).К сожалению, эти клинические испытания приводят к весьма разным результатам, вероятно, из-за дизайна исследования, критериев включения и, как одного из основных факторов, в дозах ФСГ и интервалах между инъекциями. Однако только крупные плацебо-контролируемые рандомизированные многоцентровые исследования с частотой наступления беременности — без какого-либо суррогатного маркера — в качестве первичной переменной результата, наконец, позволят сделать вывод о ценности фармакогенетики ФСГ для выбора правильных нормогонадотропных пациентов с идиопатическим бесплодием для терапии ФСГ. .
Терапия ФСГ у пациентов с неудачным тестом TESE
В настоящее время различные клиницисты предлагают терапию
ФСГ пациентам с идиопатической азооспермией после неудачной экстракции сперматозоидов из яичек (TESE) (46–48). Пока что эти исследования представляют собой отчеты о клинических случаях или имеют небольшое количество пациентов и не включают рандомизированную контрольную группу. Следовательно, однозначного заключения об эффективности терапии ФСГ у этих пациентов с идиопатической азооспермией пока невозможно.
Перспективы
Несмотря на то, что лечение АРТ достаточно эффективно для бесплодных пар в отношении желаемой клинической беременности и рождения здорового ребенка, пациенты и органы здравоохранения все больше нуждаются в применении эффективных причинно-следственных методов лечения бесплодия мужского пола, когда это возможно и целесообразно.Поэтому всегда следует проводить систематическое андрологическое обследование мужчины-партнера бесплодной пары, даже если некоторые гинекологические причины бесплодия уже выявлены. В Германии теперь обязательным является тщательное андрологическое обследование, прежде чем можно будет начать любую АРТ (49).
Гипогонадотропный гипогонадизм является хорошим примером того, как причинная гормональная терапия мужского бесплодия может применяться с высокой клинической эффективностью в отношении индукции беременности у партнера-женщины.Еще неизвестно, будет ли терапия ФСГ полезной и общепринятой для лечения мужского бесплодия у нормогонадотропных пациентов с идиопатическим нарушением сперматогенеза.
Без сомнения, необходимы более хорошо спланированные проспективные рандомизированные исследования для определения наилучшего лечения ФСГ для бесплодных пациентов мужского пола. Все соответствующие участники системы здравоохранения должны быть стимулированы к предоставлению соответствующих ресурсов для оптимизации результатов лечения мужского бесплодия — у мужчин!
Взносы авторов
Всю работу над этой статьей выполнила HB.
Заявление о конфликте интересов
Автор заявляет, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
2. Барбонетти А., Калоджеро А.Е., Балерсия Дж., Гаролла А., Краус С., Ла Виньера С. и др. Использование фолликулостимулирующего гормона (ФСГ) для лечения бесплодного мужчины: заявление о позиции Итальянского общества андрологии и сексуальной медицины (SIAMS). J Endocrinol Invest. (2018) 41: 1107–22. DOI: 10.1007 / s40618-018-0843-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3. Колпи Г.М., Франкавилла С., Хайдл Г., Линк К., Бер Х.М., Гулис Д.Г. и др. Европейская академия андрологии: руководство по лечению олиго-астено-тератозооспермии. Андрология. (2018) 6: 513–24. DOI: 10.1111 / andr.12502
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Behre HM, Nieschlag E, Partsch C-J, Wieacker P, Simoni M.Заболевания гипоталамуса и гипофиза. В: Nieschlag E, Behre HM, Nieschlag S, редакторы. Андрология. Мужское репродуктивное здоровье и дисфункция. 3-е изд. Берлин: Springer (2010). п. 169–92.
Google Scholar
5. Nieschlag E, Behre HM. Тестостероновая терапия. В: Nieschlag E, Behre HM, Nieschlag S, редакторы. Андрология. Мужское репродуктивное здоровье и дисфункция. 3-е изд. Берлин: Springer (2010). п. 437–55.
6. Казарини Л., Лиспи М., Лонгобарди С., Милоса Ф., Ла Марка А., Тальясакки Д. и др.Действие ЛГ и ХГЧ на один и тот же рецептор приводит к количественно и качественно разной внутриклеточной передаче сигналов. PLoS ONE. (2012) 7: e46682. DOI: 10.1371 / journal.pone.0046682
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Янг Дж., Сюй Ц., Пападакис Дж. Э., Асьерно Дж. С., Майоне Л., Хиетамаки Дж. И др. Клиническое лечение врожденного гипогонадотропного гипогонадизма. Endocr Ред. (2019) 40: 669–710. DOI: 10.1210 / er.2018-00116
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8.Büchter D, Behre HM, Kliesch S, Nieschlag E. Пульсирующий гонадолиберин или хорионический гонадотропин человека / менопаузальный гонадотропин человека как эффективное лечение для мужчин с гипогонадотропным гипогонадизмом: обзор 42 случаев. Eur J Endocrinol. (1998) 139: 298–303. DOI: 10.1530 / eje.0.13
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Мао Дж. Ф., Лю З. X., Не М., Ван Х, Сюй Х. Л., Хуанг Б. К. и др. Пульсирующая терапия гонадотропин-рилизинг гормоном связана с более ранним сперматогенезом по сравнению с комбинированной терапией гонадотропинами у пациентов с врожденным гипогонадотропным гипогонадизмом. Азиат Дж. Андрол. (2017) 19: 680–5. DOI: 10.4103 / 1008-682X.193568
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. МакЛауд Дж, Пазианос А., Рэй Б. Восстановление человеческого сперматогенеза и репродуктивного тракта с помощью гонадотропинов в моче после гипофизэктомии. Fertil Steril. (1966) 17: 7–23. DOI: 10.1016 / S0015-0282 (16) 35821-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Kliesch S, Behre HM, Nieschlag E.Рекомбинантный фолликулостимулирующий гормон человека и хорионический гонадотропин человека для индукции сперматогенеза у гипогонадотропных мужчин. Fertil Steril. (1995) 63: 1326–8. DOI: 10.1016 / S0015-0282 (16) 57619-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Bouloux PM, Nieschlag E, Burger HG, Skakkebaek NE, Wu FC, Handelsman DJ, et al. Индукция сперматогенеза рекомбинантным фолликулостимулирующим гормоном (пурегон) у мужчин с гипогонадотропной азооспермией, которые не реагировали только на хорионический гонадотропин человека. Дж Андрол. (2003) 24: 604–11. DOI: 10.1002 / j.1939-4640.2003.tb02712.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Блюменауэр В., Черомин Ю., Фер Д., Фидлер К., Гнот С., Крюссель Дж. С. и др. D · I · R Annual 2017 — Немецкий ЭКО-регистр. J Reproduktionsmed Endrokrinol. (2018) 15: 217–50.
15. Rohayem J, Sinthofen N, Nieschlag E, Kliesch S, Zitzmann M. Причины гипогонадотропного гипогонадизма предсказывают реакцию на замену гонадотропинов у взрослых. Андрология. (2016) 4: 87–94. DOI: 10.1111 / andr.12128
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Беррис А.С., Родбард Х.В., Винтерс С.Дж., Шеринс Р.Дж. Терапия гонадотропинами у мужчин с изолированным гипогонадотропным гипогонадизмом: реакция на хорионический гонадотропин человека определяется исходным размером яичек. J Clin Endocrinol Metab. (1988) 66: 1144–51. DOI: 10.1210 / jcem-66-6-1144
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17.Миягава Ю., Цудзимура А., Мацумия К., Такао Т., Тохда А., Кога М. и др. Результат терапии гонадотропинами мужского гипогонадотропного гипогонадизма в университетских центрах мужского бесплодия: 30-летнее ретроспективное исследование. J Urol. (2005) 173: 2072–5. DOI: 10.1097 / 01.ju.0000158133.09197.f4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Лю П.Й., Бейкер Х.В., Джаядев В., Захарин М., Конвей А.Дж., Хандельсман Д. Индукция сперматогенеза и фертильности во время лечения гонадотропинами мужчин с гонадотропным дефицитом бесплодия: предикторы исхода фертильности. J Clin Endocrinol Metab. (2009) 94: 801–8. DOI: 10.1210 / jc.2008-1648
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Варн Д.В., Декостерд Дж., Окада Х., Яно Й., Коиде Н., Хоулз С.М. Комбинированный анализ данных для определения прогностических факторов сперматогенеза у мужчин с гипогонадотропным гипогонадизмом, получавших рекомбинантный фолликулостимулирующий гормон человека и хорионический гонадотропин человека. Fertil Steril. (2009) 92: 594–604. DOI: 10.1016 / j.fertnstert.2008.07.1720
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Двайер А.А., Райвио Т., Питтелуд Н. Замена гонадотропинов для индукции фертильности у мужчин с гипогонадизмом. Best Practices Clin Endocrinol Metab. (2015) 29: 91–103. DOI: 10.1016 / j.beem.2014.10.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Лю З., Мао Дж., Ву Х, Сю Х., Ван Х, Хуанг Б. и др. Предикторы эффективности и исхода лечения гонадотропинами для мужского врожденного гипогонадотропного гипогонадизма: ретроспективное исследование 223 пациентов. Медицина. (2016) 95: e2867. DOI: 10.1097 / MD.0000000000002867
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Аноним. Эффективность и безопасность высокоочищенного мочевого фолликулостимулирующего гормона с хорионическим гонадотропином человека для лечения мужчин с изолированным гипогонадотропным гипогонадизмом. Европейская исследовательская группа Metrodin HP. Fertil Steril. (1998) 70: 256–62. DOI: 10.1016 / S0015-0282 (98) 00156-3
CrossRef Полный текст | Google Scholar
23.Bouloux P, Warne DW, Loumaye E, Исследовательская группа FSH мужского бесплодия. Эффективность и безопасность рекомбинантного фолликулостимулирующего гормона человека у мужчин с изолированным гипогонадотропным гипогонадизмом. Fertil Steril. (2002) 77: 270–3. DOI: 10.1016 / S0015-0282 (01) 02973-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Синиси А.А., Эспозито Д., Белластелла Г., Майоне Л., Палумбо В., Гандини Л. и др. Эффективность рекомбинантного человеческого фолликулостимулирующего гормона в низких дозах в индукции сперматогенеза и фертильности при гипогонадотропном гипогонадизме. J Endocrinol Invest. (2010) 33: 618–23. DOI: 10.1007 / BF03346659
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Nieschlag E, Bouloux PG, Stegmann BJ, Shankar RR, Guan Y, Tzontcheva A, et al. Открытое клиническое испытание по изучению эффективности и безопасности корифоллитропина альфа в сочетании с ХГЧ у взрослых мужчин с гипогонадотропным гипогонадизмом. Репрод Биол Эндокринол. (2017) 15:17. DOI: 10.1186 / s12958-017-0232-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27.Ян Л., Чжан С.Х., Донг К., Сюн З.Б., Ли Х. Применение гормонального лечения при гипогонадотропном гипогонадизме: опыт более десяти лет. Int Urol Nephrol. (2012) 44: 393–9. DOI: 10.1007 / s11255-011-0065-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Депенбуш М., фон Эккардштейн С., Симони М., Нишлаг Э. Поддержание сперматогенеза у гипогонадотропных гипогонадных мужчин только с помощью хорионического гонадотропина человека. Eur J Endocrinol. (2002) 147: 617–24.DOI: 10.1530 / eje.0.1470617
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Zhang M, Tong G, Liu Y, Mu Y, Weng J, Xue Y, et al. Последовательный и непрерывный очищенный мочевой ФСГ / ХГЧ у мужчин с идиопатическим гипогонадотропным гипогонадизмом. J Clin Endocrinol Metab. (2015) 100: 2449–55. DOI: 10.1210 / jc.2014-3802
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Казарини Л., Санти Д., Бриганте Дж., Симони М. Два гормона для одного рецептора: эволюция, биохимия, действия и патофизиология ЛГ и ХГЧ. Endocr Rev. (2018) 39: 549–92. DOI: 10.1210 / er.2018-00065
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Шилл В.Б., Юнгст Д., Унтербургер П., Браун С. Комбинированное лечение чМГ / ХГЧ у субфертильных мужчин с идиопатической нормогонадотропной олигозооспермией. Int J Androl. (1982) 5: 467–77. DOI: 10.1111 / j.1365-2605.1982.tb00278.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Knuth UA, Honigl W, Bals-Pratsch M, Schleicher G, Nieschlag E.Лечение тяжелой олигоспермии хорионическим гонадотропином человека / менопаузальным гонадотропином человека: плацебо-контролируемое двойное слепое исследование. J Clin Endocrinol Metab. (1987) 65: 1081–7. DOI: 10.1210 / jcem-65-6-1081
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Kamischke A, Behre HM, Bergmann M, Simoni M, Schafer T., Nieschlag E. Рекомбинантный фолликулостимулирующий гормон человека для лечения мужского идиопатического бесплодия: рандомизированное двойное слепое плацебо-контролируемое клиническое испытание. Hum Reprod. (1998) 13: 596–603. DOI: 10.1093 / humrep / 13.3.596
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Симони М., Санти Д., Негри Л., Хоффманн И., Муратори М., Балди Е. и др. Лечение человеческим рекомбинантным ФСГ улучшает фрагментацию ДНК сперматозоидов у мужчин с идиопатическим бесплодием в зависимости от полиморфизма рецепторов ФСГ. P.N680S: фармакогенетическое исследование. Hum Reprod. (2016) 31: 1960–9. DOI: 10.1093 / humrep / dew167
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35.Casamonti E, Vinci S, Serra E, Fino MG, Brilli S, Lotti F и др. Кратковременное лечение ФСГ и созревание сперматозоидов: проспективное исследование у мужчин с идиопатическим бесплодием. Андрология. (2017) 5: 414–22. DOI: 10.1111 / andr.12333
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Муратори М., Балди Э. Эффекты ФСГ на фрагментацию ДНК сперматозоидов: обзор клинических исследований и возможных механизмов действия. Front Endocrinol. (2018) 9: 734. DOI: 10.3389 / fendo.2018.00734
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Санти Д., Спаггиари Дж., Симони М. Индекс фрагментации ДНК сперматозоидов как многообещающий инструмент прогнозирования для диагностики мужского бесплодия и управления лечением — метаанализы. Reprod Biomed Online. (2018) 37: 315–26. DOI: 10.1016 / j.rbmo.2018.06.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. ВОЗ. Лабораторное руководство ВОЗ по исследованию и обработке спермы человека. Женева: Пресса ВОЗ (2010).
Google Scholar
39. Аттиа А.М., Абу-Сетта А.М., Аль-Инани Х.Г. Гонадотропины при идиопатическом нарушении фертильности по мужскому фактору. Кокрановская база данных Syst Rev. (2013) CD005071. DOI: 10.1002 / 14651858.CD005071.pub4
CrossRef Полный текст | Google Scholar
41. Дин Ю.М., Чжан XJ, Ли Дж.П., Чен С.С., Чжан Р.Т., Тан В.Л. и др. Лечение идиопатической олигозооспермии рекомбинантным человеческим фолликулостимулирующим гормоном: проспективное рандомизированное двойное слепое плацебо-контролируемое клиническое исследование в популяции Китая. Clin Endocrinol. (2015) 83: 866–71. DOI: 10.1111 / cen.12770
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Бехре Х.М., Греб Р.Р., Мемпель А, Зоннтаг Б., Кизель Л., Кальтвассер П. и др. Значение общего однонуклеотидного полиморфизма в экзоне 10 гена рецептора фолликулостимулирующего гормона (ФСГ) для ответа яичников на ФСГ: фармакогенетический подход к контролируемой гиперстимуляции яичников. Pharmacogenet Genomics. (2005) 15: 451–6.DOI: 10.1097 / 01.fpc.0000167330.92786.5e
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Ферлин А., Винанзи С., Селиче Р., Гаролла А., Фриго А.С., Фореста С. К фармакогенетическому подходу к мужскому бесплодию: полиморфизм промотора бета-субъединицы фолликулостимулирующего гормона. Fertil Steril. (2011) 96: 1344–1349.e1342. DOI: 10.1016 / j.fertnstert.2011.09.034
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Селиче Р., Ферлин А., Гаролла А., Каретта Н., Фореста С.Влияние эндогенного ФСГ на нормальный сперматогенез человека у взрослых. Int J Androl. (2011) 34 (6 Pt 2): e511–7. DOI: 10.1111 / j.1365-2605.2010.01134.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Барботин А.Л., Бюллетень С, Сигала Дж., Лерой М., Ригот Дж. М., Дьюайли Д. и др. Беременность после интрацитоплазматической инъекции сперматозоидов после расширенной подготовки спермы и гормональной терапии у мужчины с азооспермией с задержкой созревания и микролитиазом: отчет о клиническом случае и обзор литературы. Андрология. (2017) 49: e12665. DOI: 10.1111 / and.12665
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Cocci A, Cito G, Russo GI, Falcone M, Capece M, Timpano M и др. Эффективность лечения высокоочищенным урофоллитропином у пациентов с идиопатической азооспермией перед экстракцией сперматозоидов из яичек. Urologia. (2018) 85: 19–21. DOI: 10.5301 / uj.5000253
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48.Лаурсен Р.Дж., Эльбаек Х.О., Повлсен Б.Б., Ликкегаард Дж., Дженсен К.Б.С., Эстевес С.К. и др. Гормональная стимуляция сперматогенеза: новый способ лечения бесплодного мужчины с необструктивной азооспермией? Int Urol Nephrol. (2019) 51: 453–6. DOI: 10.1007 / s11255-019-02091-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Bundesärztekammer. Richtlinie zur Entnahme und Übertragung von menschlichen Keimzellen im Rahmen der assistierten Reproduktion. Deutsches Ärzteblatt. (2018) A1 – A22. DOI: 10.3238 / arztebl.2018.Rili_assReproduktion_2018
CrossRef Полный текст | Google Scholar
Как естественным образом повысить фертильность
У студентов NUNM есть много возможностей для изучения тем, исследований и областей практики, которые их интересуют. Наши студенты выбирают врача, которым хотят стать, от широкого выбора по выбору до участия в исследовательском исследовании и самообучения. Здесь Рэйчел Петерсон, докторант-натуропат, делится своими исследованиями и перспективами повышения фертильности с помощью естественной медицины.
Планируете ли вы зачать ребенка через 15 лет или надеетесь завести ребенка в ближайшее время, важно учитывать вашу фертильность и гормональное здоровье. Печальная реальность заключается в том, что бесплодие сегодня является общенациональной эпидемией, и даже когда вы чувствуете, что готовы к рождению ребенка, ваше тело может быть не готово. [1] Для сравнения: Центр по контролю и профилактике заболеваний заявляет, что 12,1% женщин в возрасте от 15 до 44 лет борются с бесплодием, от чего страдают более 7 миллионов американских женщин. [1] Очень важно подготовить ваше тело, разум и дух для легкого зачатия и беременности. В качестве дополнительного бонуса суть фертильности заключается в гормональном балансе, поэтому создание прочной основы на раннем этапе дает положительные результаты на всю жизнь (чистая кожа, регулярные менструации и здоровое либидо). По сути, здоровый образ жизни сейчас может спасти мир трудностей в будущем.
Менструальный цикл — ключевой показатель гормонального здоровья
Наблюдение — ваш лучший инструмент, когда вы играете важную роль в вашем пути к плодовитости.Ваше тело постоянно передает важные сигналы, и по мере развития нашей осведомленности мы можем читать эти сообщения и соответствующим образом корректировать свой выбор. Исследования показывают, что менструальный цикл является индикатором вашего общего гормонального фона. [1] В качестве первого шага поработайте над установлением регулярных циклов. Начните отслеживать свой цикл и отметьте время овуляции для оптимального зачатия. [2] Также можно отметить качество крови, продолжительность цикла, регулярность и сопутствующие симптомы. [1] Хотите верьте, хотите нет, но месячные не обязательно должны сопровождаться болезненными спазмами, переполнением тампонов, вздутием живота и мигренью, и эти симптомы фактически указывают на дисбаланс в соотношении эстрогена и прогестерона. [1] Цвет и текстура вашей крови могут предоставить дополнительную информацию о вашем конкретном балансе или дисбалансе. [1] Кроме того, продолжительность вашего цикла (особенно лютеиновой фазы) указывает на ваш уровень прогестерона и на то, сможете ли вы сохранить беременность после первоначального зачатия. [1] Обратитесь к своему лечащему врачу за вопросами и поддержкой в облегчении симптомов и исправлении основного гормонального дисбаланса.
Обращайте внимание на стрессоры, воспаление и надпочечники
Помимо определения уровня гормонов, не менее важно следить за своим общим здоровьем и вести здоровый образ жизни. Исследования показывают, что воспаление — огромное препятствие для зачатия. [2] Очень важно управлять воспалительной природой состояний, таких как синдром поликистозных яичников (СПКЯ), эндометриоз и аутоиммунные заболевания. [2] Между кортизолом и воспалением существует тесная связь. [2] Вы должны справляться со стрессом и поддерживать свои надпочечники, чтобы ваше тело и нервная система были энергетически готовы ко всем изменениям, которые приносит беременность. [2] Физические упражнения и сон — важные составляющие сбалансированного образа жизни. Кроме того, большое количество исследований показывает, что иглоукалывание может быть мощным средством для балансирования гормонов и повышения фертильности. [2] Наконец, создание здорового бактериального баланса во влагалищном канале позволяет сперматозоидам достигать яйцеклетки, поэтому необходимо лечить хронические дрожжевые инфекции, бактериальный вагиноз и инфекции мочевыводящих путей (ИМП). [1] Если вы планируете роды через естественные родовые пути, ваш ребенок будет напрямую заселен вашими бактериями, поэтому создание здорового микробиома также создает здоровую послеродовую среду для вашего ребенка. [1] Не забудьте пройти обследование на наличие заболеваний, передающихся половым путем (ЗППП), которые могут вызвать длительные проблемы с фертильностью. [1]
Сбалансированная диета — основа высокой фертильности
Когда дело доходит до устранения дисбаланса и оптимизации фертильности, сбалансированная диета является основой. [3] Начните с диеты из цельных продуктов с большим количеством фруктов, овощей и сбалансированной пищи, содержащей белок, полезные жиры и сложные углеводы. [3] Выбирайте экологически чистые продукты и чистящие средства, поскольку в недавнем исследовании пестициды в пищевых продуктах были связаны с бесплодием. [4] Пестициды нарушают работу эндокринной системы, нарушая естественный гормональный баланс организма. [4] Исключите обработанные пищевые продукты, растительные масла и сахар. [5] Исследование в области репродукции человека показало, что женщины, которые ели нездоровую пищу четыре раза в неделю или чаще, имели более высокий уровень бесплодия. [5] Исключение фруктов из рациона также было связано с увеличением бесплодия. [5] Следует избегать употребления кофеина, поскольку он может чрезмерно стимулировать надпочечники, повышать уровень эстрогена и истощать запасы витаминов группы B. [1] Также следует избегать других стимуляторов, таких как сигареты и алкоголь. [1]
Какие продукты лучше всего подходят для гормонов?
Тренер по здоровью Алиса Витти рекомендует определенные продукты, которые уравновешивают гормоны и способствуют выведению.Гречка содержит d-хиро-инозит, который выводит излишки тестостерона и стабилизирует уровень сахара в крови. [1] Листовая зелень содержит фолиевую кислоту, витамин Е, магний и кальций; питательные вещества, поддерживающие не только менструальный цикл, но и развитие головного и спинного мозга плода. [1] Нут обеспечивает дозу витамина B6 для оптимального уровня прогестерона. [1] Пчелиная пыльца, маточное молочко и мед могут поддерживать функцию яичников. [1] Витамин D необходим для овуляции, и органические яйца на свободном выгуле обеспечивают хорошую дозу. [1] Семена подсолнечника содержат цинк, который способствует балансу эстрогена и прогестерона. [1] Омега-3 жирные кислоты важны для уменьшения воспаления, регулирования гормонов и увеличения притока крови к матке, яичникам и влагалищу. [1] Лосось, устрицы, семена чиа, льняное семя и грецкие орехи являются хорошими источниками омега-3. [1] Мононенасыщенные жиры, содержащиеся в авокадо, миндале и кешью, также связаны с повышением фертильности. [1] Корица помогает сбалансировать уровень сахара в крови и улучшает овуляцию. [1] Наконец, добавляйте куркуму в любой прием пищи для получения противовоспалительного эффекта. [1] Обязательно смешайте специю с черным перцем для максимальной биодоступности. [1]
Какие добавки поддерживают фертильность?
Добавки могут дополнительно поддерживать здоровые гормоны, менструальный цикл и фертильность. Ваш лечащий врач может помочь вам определить, могут ли эти травы вам помочь. Смесь китайских трав, содержащая донг квай, может способствовать развитию здорового эндометрия (слизистой оболочки матки). [1] Добавки омега-3 также способствуют эстрогену, наряду с витамином D3. [2] Исследования показали, что дефицит витамина D связан с бесплодием, поэтому прием добавок витамина D и регулярные анализы крови могут быть полезными, если это рекомендовано вашим врачом. [2] Добавка B6, наряду с продуктами, богатыми витамином B, также может помочь повысить уровень прогестерона. [2] Аномальные уровни ФСГ или ЛГ можно уравновесить с помощью ежедневных добавок витекса или белого пиона, и они работают лучше всего, когда также повышен уровень гормона пролактина. [2] Мио-инозитол называют «витамином яичников», поскольку исследования показывают, что он связан с улучшением качества яйцеклеток и повышением частоты наступления беременности, потенциально за счет повышения чувствительности яичников к ФСГ и ЛГ. [2] В сочетании с D-хиро-инозитолом это отличная добавка, особенно для женщин с СПКЯ. [2] Было показано, что N-ацетилцистеин (NAC), направленный на высокий уровень андрогенов и воспаление, увеличивает содержание глутатиона в яичниках и улучшает фертильность. [2] Корень солодки также может уменьшать количество андрогенов, обладая дополнительным противовоспалительным действием. [2] Наконец, исследования показывают, что антиоксидантный кофермент Q10 может способствовать регулярной овуляции. [2]
Никогда не поздно и не рано подготовиться к беременности
Независимо от того, на каком этапе пути к фертильности вы находитесь, никогда не бывает слишком поздно или рано сосредоточиться на балансировании циклов и подготовке тела к беременности. Уравновешивание гормонов и улучшение фертильности — это долгий и многомерный путь. Добавки, диета и факторы образа жизни — это всего лишь несколько частей более широкой картины: целостный, жизненно важный образ жизни, поддерживающий создание жизни.Эта статья задумана как отправная точка для начала более широкой беседы. Как вы можете лучше понимать сигналы своего тела? Как вы можете поддерживать ежемесячные сдвиги в своем цикле и общий гормональный баланс? Может показаться, что над этим есть много размышлений, но одно просто: установление здорового, сбалансированного образа жизни сегодня способствует лучшему здоровью и возможностям на будущее.
* Пожалуйста, не забывайте, прежде чем добавлять какие-либо витамины или добавки в свой распорядок дня или перед радикальным изменением своих привычек питания, сначала поговорите со своим врачом.
Еще статьи о женском здоровье
Хотите узнать о здоровье женщин и естественной медицине? NUNM предлагает на выбор несколько программ, в том числе докторскую степень по натуропатии, докторскую степень по китайской медицине, степень магистра в области питания и многое другое. Зарегистрируйтесь и запросите дополнительную информацию, чтобы узнать больше о ваших возможностях.
Список литературы
- Витти А. Женский кодекс: совершенствуйте свой цикл, повышайте фертильность, усиливайте сексуальное влечение и становитесь источником энергии.Нью-Йорк, штат Нью-Йорк: HarperOne, издательство HarperCollinsPublishers; 2014. [1]
- McCulloch F. 8 шагов, чтобы обратить вспять ваш СПКЯ: проверенная программа для сброса гормонов, восстановления метаболизма и восстановления фертильности. Остин, Техас: издательство Greenleaf Book Group Press; 2016. [2]
- Фрэнк П. Женское бесплодие. Новости и обзор врача-натуропата. https://ndnr.com/womens-health/female-infertility-2/. Опубликовано 12 августа 2006 г. По состоянию на 31 января 2019 г. [3]
- Смит Н. Остатки пестицидов в пище снижают фертильность.Новости и обзор врача-натуропата. https://ndnr.com/naturopathic-news/pesticide-residue-on-food-decreases-fertility/. Опубликовано 13 ноября 2017 г. По состоянию на 30 января 2019 г. [4]
- Смит Н. Диета для улучшения фертильности. Новости и обзор врача-натуропата. https://ndnr.com/naturopathic-news/diet-to-help-with-fertility/. Опубликовано 11 июня 2018 г. По состоянию на 31 января 2019 г. [5]
Мужское бесплодие и низкий уровень ЛГ и ФСГ
Доктор Ларри Липшульц — пионер в лечении проблем со здоровьем мужчин и, в частности, мужского бесплодия.В то время, когда бесплодие все еще широко ошибочно воспринималось как преимущественно женская проблема, доктор Липшульц внес огромный вклад в науку о диагностике и лечении проблем с мужской фертильностью. Он остается лидером в этой области, и пациенты, и его сверстники считают его одним из ведущих экспертов по вопросам мужской фертильности в Соединенных Штатах.
Двумя ведущими факторами мужского бесплодия, о которых доктор Липшульц помог расширить наше понимание, являются низкие уровни лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ).Эти гормоны необходимы для воспроизводства как у мужчин, так и у женщин, а низкий уровень у обоих партнеров может способствовать бесплодию. Доктор Липшульц может диагностировать мужское бесплодие, обнаруживая низкий уровень ЛГ и ФСГ в своей урологической клинике в Хьюстоне, штат Техас. Хотя низкий уровень этих гормонов не может быть единственной причиной бесплодия, они могут быть важной частью головоломки бесплодия, а их лечение может значительно повысить шансы на успешную беременность.
Что такое ЛГ и ФСГ?
ЛГ — это гормон, который вырабатывается гипофизом как у мужчин, так и у женщин.У женщин ЛГ стимулирует фолликул яичника, что, в свою очередь, приводит к росту яйцеклетки и выработке эстрогена. У мужчин ЛГ связывается с клетками Лейдига в семенниках, способствуя высвобождению тестостерона, который необходим для производства сперматозоидов.
Как и ЛГ, ФСГ — это гормон, который вырабатывается гипофизом как у мужчин, так и у женщин. У женщин ФСГ в основном регулирует выработку эстрогена и прогестерона и играет важную роль в общей регуляции менструального цикла.У мужчин ФСГ имеет решающее значение для развития яичек и производства спермы.
Как низкие уровни ЛГ и ФСГ влияют на мужскую фертильность?
И ЛГ, и ФСГ жизненно важны для правильного производства спермы. Низкий уровень этих гормонов может быть, по крайней мере, частично ответственен за низкое количество сперматозоидов, которое является основной причиной бесплодия у мужчин.
Обычно диагностика начинается с анализа спермы. Если количество сперматозоидов менее 15 миллионов на миллиметр спермы, у мужчины диагностируется низкое количество сперматозоидов.Затем доктор Липшульц может назначить анализы для определения уровней ЛГ и ФСГ. Помимо влияния на количество сперматозоидов, низкие уровни ЛГ и ФСГ могут быть симптомами других проблем, таких как гипогонадизм, состояние, при котором организм не вырабатывает достаточное количество тестостерона.
Точная диагностика основных причин мужского бесплодия имеет важное значение для назначения наиболее эффективного лечения. Безоперационные методы лечения оказались весьма эффективными при лечении низких уровней ЛГ и ФСГ у мужчин.
Узнать больше о мужском бесплодии и низком уровне ЛГ и ФСГ
Если вы хотите узнать больше о связи между мужским бесплодием и низким уровнем ЛГ и ФСГ, мы рекомендуем вам связаться с Ларри Липшульцем, М.D., сегодня в Медицинском колледже Бейлора, отделение урологии Скотта.
Репродуктивные гормоны — Best Tests Issue 18
Каковы основные репродуктивные гормоны?
Фолликулостимулирующий гормон (ФСГ) и лютеинизирующий гормон (ЛГ)
Лютеинизирующий гормон (ЛГ) и фолликулостимулирующий гормон (ФСГ) — важные гормоны гипофиза, необходимые для репродуктивной функции.
процессы как у мужчин, так и у женщин. ЛГ и ФСГ высвобождаются передней долей гипофиза в ответ на пульсирующее высвобождение гонадотропина.
стимуляция гормона (ГнРГ) гипоталамусом и отрицательная обратная связь эстрогена или тестостерона.
У женщин комбинированное действие ФСГ и ЛГ стимулирует рост фолликулов яичников и стероидогенез, при этом
производство андрогенов, которые затем превращаются в эстрогены под действием фермента ароматазы. Всплеск в середине цикла
в ЛГ также вызывает овуляцию. Уровень ФСГ обычно повышается во время менопаузы, потому что яичники становятся менее отзывчивыми.
на ФСГ, который заставляет гипофиз увеличивать производство ФСГ. Однако колебания активности яичников, особенно
в начале перименопаузы означает, что уровни ФСГ и эстрадиола не являются надежными предикторами менопаузы, как это иногда бывает
на пременопаузальном уровне.
У мужчин ФСГ стимулирует клетки Сертоли, вызывая сперматогенез, а ЛГ вызывает интерстициальные клетки Лейдига.
яичек для выработки тестостерона.
Диапазон значений
Референсный диапазон для ФСГ и ЛГ у взрослых женщин составляет: 1
.
Нормативный диапазон для ФСГ у взрослых мужчин составляет 2–12 МЕ / л, а для ЛГ — 2–9 МЕ / л. 1
| Фаза | ФСГ (МЕ / л) | ЛГ (МЕ / л) |
|---|---|---|
| Ранний фолликулярный | 3–10 | 2–8 |
| Пик в середине цикла | 4–25 | 10–75 |
| Постменопаузальный | > 20 | > 15 |
| Беременность | <1 | 2–9 |
Эстрадиол
Эстрадиол является основным эстрогеном у женщин в период овуляции и доминирующим гормоном яичников во время фолликулярной
(первая) фаза менструального цикла.Концентрация эстрадиола меняется на протяжении менструального цикла. Эстрадиол
высвобождается параллельно с ростом фолликулов и достигает максимума при созревании фолликула (до овуляции). Эстрадиол
продукция постепенно снижается, если ооцит, выделяемый фолликулом, не оплодотворяется. Лабораторные исследования обычно измеряют
E2 формы эстрадиола, большая часть которых связана с глобулином, связывающим половые гормоны (SHBG). Уровень эстрадиола значительно снижается
во время менопаузы.
У мужчин эстроген является важной частью репродуктивной системы и необходим для созревания сперматозоидов. Начальный
гипогонадизм (нарушение реакции на гонадотропины, включая ЛГ и ФСГ) может привести к повышенной секреции яичек
эстрадиол и повышенное превращение тестостерона в эстрадиол. Ожирение также может повышать уровень эстрогена у мужчин. 3 An
увеличение соотношения эстрогенов и андрогенов у мужчин связано с гинекомастией (развитие груди
ткань).
Диапазон значений
Референсный диапазон эстрадиола для взрослых женщин составляет: 1
.
| Фаза | Эстрадиол (пмоль / л) |
|---|---|
| Ранний фолликулярный | <300 |
| Овуляторный всплеск | <500–3000 |
| Лютеиновая волна | 100–1400 |
| Постменопаузальный | <200 |
Н.B. Уровни эстрадиола обычно не определяются у женщин, использующих оральные контрацептивы, содержащие эстроген, поскольку это подавляет
производство эстрадиола из яичников. Уровни эстрадиола у женщин, принимающих некоторые формы ЗГТ (например, валерат эстрогена)
будет высоким.
Референсный диапазон эстрадиола для взрослых мужчин зависит от анализа, поэтому рекомендуется проконсультироваться в местной лаборатории.
Пример эталонного диапазона эстрадиола для взрослых мужчин составляет 0–200 пмоль / л. 1
Прогестерон
Прогестерон — доминирующий гормон яичников, секретируемый во время лютеиновой (второй) фазы менструального цикла. Его
основная функция — подготовить матку к имплантации эмбриона, если во время этого произойдет оплодотворение.
цикл. Если наступает беременность, высвобождается хорионический гонадотропин человека (ХГЧ), который поддерживает желтое тело, которое в
Turn позволяет уровню прогестерона оставаться повышенным.Примерно на двенадцатой неделе беременности плацента начинает производить
прогестерон вместо желтого тела. Уровень прогестерона снижается после родов и во время кормления грудью. Прогестерон
уровни низкие у женщин после менопаузы. У мужчин почти весь прогестерон превращается в тестостерон в яичках.
Нет показаний, кроме исследования фертильности у женщин (при некоторых обстоятельствах), для которого требуется прогестерон.
измерение в условиях общей практики.
Диапазон значений
Обнаружение овуляции — измерение на 20-23 день нормального 28-дневного цикла:
Референсный диапазон прогестерона у взрослых мужчин составляет 1
.
| 0-6 нмоль / л | овуляция маловероятна |
| 7-25 нмоль / л | возможна овуляция |
| > 25 нмоль / л | вероятна овуляция |
Пролактин
У женщин после введения эстрогена пролактин стимулирует выработку молока в груди.Во время беременности пролактин
концентрации начинают увеличиваться примерно на шестой неделе беременности, достигая пика на поздних сроках беременности.
У мужчин и небеременных женщин секреция пролактина гипофизом подавляется гипоталамической системой.
выброс дофамина. Опухоли или образования, которые приводят к сдавлению ножки гипофиза, или препараты, блокирующие дофамин.
рецепторы, например психотропы, опиаты и агонисты дофамина могут вызывать гиперпролактинемию за счет снижения доставки дофамина
в гипофиз.Гипотиреоз также может быть связан с гиперпролактинемией, если уровень тиреотропин-рилизинг-гормона
(TRH) повышаются, что стимулирует выработку пролактина.
Гиперпролактинемия — наиболее частое эндокринное заболевание гипоталамо-гипофизарной системы, вызывающее бесплодие.
у обоих полов. Пролактин-секретирующие опухоли (пролактиномы) являются наиболее распространенным типом опухолей гипофиза. Обычно это
небольшие опухоли (микропролактиномы) и характеризуются ановуляцией или другими нарушениями менструального цикла, галактореей
(секреция молока из груди) и сексуальная дисфункция.В редких случаях опухоли могут быть большими (макропролактиномы) и присутствовать
с такими симптомами, как головные боли и битемпоральная гемианопсия (отсутствие зрения во внешних половинах поля зрения).
N.B. Галакторея может возникать у мужчин, но это гораздо менее распространенный симптом высокого пролактина у мужчин.
Диапазон значений
Уровень пролактина колеблется в течение суток, а уровень в сыворотке крови самый низкий примерно через три часа после
просыпаться.Образцы лучше всего собирать во второй половине дня. 1 Стресс или болезнь также могут повышать уровень пролактина,
поэтому в идеале пациенты должны быть здоровыми и не принимать лекарства, которые могут влиять на уровень пролактина, такие как психотропы,
опиаты или агонисты дофамина.
Референсные диапазоны
зависят от конкретного анализа, поэтому рекомендуется проконсультироваться в местной лаборатории, чтобы узнать их референсный диапазон.
Пример референсного диапазона для пролактина составляет 50-650 мЕд / л для взрослых женщин и 50-450 мЕд / л для взрослых мужчин. 1
Примерно у 10% пациентов повышение общего пролактина может быть связано с связыванием пролактина с другим белком сыворотки (макропролактином). 1 дюйм
у этих пациентов, если небольшой биологически активный пролактин находится в пределах нормы, повышенный пролактин обычно может
можно рассматривать как лабораторный артефакт. Лаборатории обычно проверяют эту возможность у новых пациентов с
необъяснимая гиперпролактинемия.
Повышенный уровень пролактина обычно связан со снижением уровня эстрогена или тестостерона.
Тестостерон
Тестостерон — это основной андроген, отвечающий за развитие и поддержание мужских половых признаков.
Также он стимулирует анаболические процессы в несексуальных тканях. У мужчин ЛГ стимулирует клетки Лейдига в семенниках к
производят тестостерон. Небольшое количество тестостерона у мужчин вырабатывается надпочечниками.
У женщин большая часть тестостерона вырабатывается путем периферического превращения стероидов-предшественников андрогенов в тестостерон,
остальная часть вырабатывается яичниками и надпочечниками.Уровни циркулирующего тестостерона колеблются в зависимости от
менструальный цикл и увеличение при беременности. Уровни тестостерона в сыворотке остаются относительно стабильными во время и после
климакс. 4 Синдром поликистозных яичников — наиболее частая причина гиперандрогении (повышение уровня тестостерона
уровни) у самок. Более редкие причины включают синдром Кушинга, врожденную гиперплазию надпочечников и опухоли, секретирующие андрогены.
Диапазон значений
Референсный диапазон общего тестостерона у взрослых мужчин различается в разных лабораториях.Примерный диапазон
составляет 8-35 нмоль / л. Если единичный уровень тестостерона ранним утром явно находится в пределах нормы (например,> 15 нмоль / л)
тогда дальнейшее тестирование не требуется. Если получен низкий или пограничный результат, подтверждающий тест рано утром (когда
пациент здоров).
Референсные диапазоны
тестостерона для женщин также зависят от конкретного анализа. Пример эталонного диапазона взрослой женщины для
общий тестостерон равен 0.5 — 2,5 нмоль / л. 1 Современные анализы тестостерона второго поколения обычно имеют более низкую
колеблется у женщин из-за меньшего вмешательства со стороны других стероидов, таких как DHEAS
Свободный тестостерон можно рассчитать из общего тестостерона и глобулина, связывающего половые гормоны (SHBG). Однако ГСПГ
тестирование требуется только в редких случаях, например, при нарушениях связывания половых гормонов (например, гипертиреоз, противосудорожные препараты).
употребление, тяжелое ожирение) может ввести в заблуждение уровень общего тестостерона.Обсуждение с эндокринологом или химиком
перед обращением в ГСПГ рекомендуется обратиться к патологу.
Хорионический гонадотропин человека (ХГЧ)
ХГЧ структурно и функционально идентичен ЛГ, за исключением его бета-цепи, поэтому его часто называют
как бета-ХГЧ (или бета-ХГЧ).
ХГЧ выделяется клетками трофобласта во время беременности. Эти клетки образуют внешний слой развивающейся бластоцисты.
после зачатия и эмбриональной имплантации.ХГЧ стимулирует выработку прогестерона желтым телом и увеличивает
васкуляризация между трофобластом и стенкой матки. Выявляется примерно через три дня после имплантации.
эмбриона, что происходит примерно через шесть-двенадцать дней после овуляции и оплодотворения. Во время нормальной беременности
Уровень ХГЧ обычно удваивается примерно каждые два дня, затем выходит на плато и начинает снижаться через восемь-десять недель, но
будет оставаться повышенным на протяжении всей беременности. 5 Женщины, беременные двойней, как правило, производят более высокие уровни
ХГЧ, чем у одиночных эмбрионов, но уровень ХГЧ не может быть надежно использован для прогнозирования этого. 6
Измерение ХГЧ в моче или сыворотке можно использовать для подтверждения беременности на ранних сроках (в большинстве случаев уровень ХГЧ в моче достаточен). Сыворотка
ХГЧ также может быть полезен в качестве первоначального исследования у женщин, у которых есть симптомы, которые могут указывать на внематочную беременность, выкидыш.
или трофобластическое заболевание. Трансвагинальное УЗИ можно использовать примерно после пяти недель беременности или при уровне ХГЧ> 1000.
— 2000 МЕ / л, для выявления признаков беременности. 7
На нежизнеспособную беременность может указывать снижение или плато уровня ХГЧ на ранних сроках беременности (помня, что
ХГЧ снижается при нормальной беременности примерно после девяти-десяти недель беременности). Однако сам по себе ХГЧ не является надежным
прогностический фактор внематочной беременности, поскольку нет определенной модели уменьшения или увеличения числа беременностей.8 После выкидыша это может
требуется три или четыре недели, чтобы уровни ХГЧ вернулись к уровням небеременных (7 При неполном выкидышах,
Уровень ХГЧ может оставаться повышенным, и может потребоваться хирургическое вмешательство.
У мужчин ХГЧ продуцируется некоторыми опухолями яичек, и поэтому он используется в качестве сывороточного онкомаркера для некоторых форм.
рака яичек.
Диапазон значений
Уровень ХГЧ на ранних сроках беременности может варьироваться в широком диапазоне. Скорость увеличения, т. Е. Удвоения
время дает больше полезной информации, чем фактические уровни. Большинство анализов мочи дают положительные результаты при уровне ХГЧ> 20-25.
МЕ / л. Сыворотка ХГЧ 1
Чрезмерно высокий уровень ХГЧ, e.грамм. > 100000 МЕ / л может указывать на гестационную трофобластическую болезнь, например коренной зуб
беременность.
Когда следует исследовать репродуктивные гормоны?
Существует несколько показаний для измерения уровня репродуктивных гормонов, однако в условиях общей практики
наиболее частыми причинами являются исследование первичной или вторичной аменореи или олигоменореи у женщин, исследование
гипогонадизм у мужчин, подтверждение беременности и некоторые аспекты исследования фертильности.Измерение уровня гормонов у женщин
при типичных симптомах климакса в этом обычно нет необходимости. В таблице 1 приведены рекомендуемые гормоны.
тесты для некоторых из наиболее распространенных клинических сценариев, связанных с эндокринной системой, которые встречаются в общей практике.
От врачей общей практики не ожидается, что они будут исследовать и диагностировать каждую эндокринную дисфункцию. Роль генерала
Практикующий часто определяет пациентов, которым требуется направление для дальнейшей оценки и диагностики во вторичном отделении.
забота.
Таблица 1: Рекомендуемые гормональные тесты в условиях общей практики
Ключ:
= рекомендуется =
может потребоваться
— = обычно не требуется
Исследование первичной аменореи (задержки полового созревания)
Возможный сценарий: матери приводят своих дочерей на консультацию, так как они обеспокоены тем, что у них «месячные»
еще не начались, а у других девочек из их группы сверстников уже начались менструации.
В большинстве случаев все, что требуется — это уверенность и бдительное ожидание. Однако, если нет признаков развития груди
(первый явный признак полового созревания у девочек) к возрасту 12-14 лет или менструация не началась к 16 годам
у женщин с нормальным пубертатным развитием необходимо начать исследование. 9
Частой причиной первичной аменореи является потеря веса, соблюдение диеты или чрезмерные физические нагрузки (известная как гипоталамическая аменорея).Более редкие причины включают заболевание гипофиза или щитовидной железы, анатомические аномалии (например, агенез Мюллера) и врожденные аномалии.
(например, синдром Тернера, синдром Каллмана).
Лабораторные исследования могут быть рассмотрены, если опасения не исчезнут, несмотря на период бдительного ожидания. Соответствующие тесты
включают: ФСГ, ЛГ, эстрадиол, пролактин, тестостерон, ТТГ и FT4. Может быть трудно интерпретировать значение
аномальных результатов, поэтому консультация или направление к эндокринологу или гинекологу для дальнейшего исследования
и рекомендуется диагностика.
Уровни эстрадиола могут указывать на то, нет ли абсолютно никаких доказательств активности эстрогена в яичниках или же уровни
начали повышаться с допубертатного уровня, что указывает на то, что активность гонад может начаться. Низкий уровень эстрадиола в ассоциации
с низким уровнем ЛГ указывает на гипоталамическую аменорею.
Низкий уровень ФСГ и ЛГ (20 МЕ / л) и ЛГ (> 40 МЕ / л) предполагает гипергонадотропный гипогонадизм,
что может указывать на синдром Тернера. 10
Повышенный уровень пролактина и / или аномалии ТТГ и FT4 могут указывать на гипофизарную причину.
Синдром поликистозных яичников, который чаще ассоциируется со вторичной аменореей, иногда может быть причиной
первичная аменорея. Об этом может свидетельствовать повышенный уровень тестостерона.
Нормальный уровень гормонов у женщин с первичной аменореей, но в остальном нормальное развитие, может указывать на анатомические
аномалии, такие как неперфорированная девственная плева или мюллерова агенезия (врожденный порок, который приводит к отсутствию матки
и маточные трубы).При подозрении на это требуется дальнейшее расследование.
Преждевременное половое созревание
Преждевременное (раннее) половое созревание обычно определяется как появление вторичных половых признаков у девочек в возрасте
до восьми лет или у мальчиков до девяти лет. Это гораздо более редкое проявление, чем задержка полового созревания и обследование.
преждевременного полового созревания у детей сложно. Любой ребенок с ранними признаками вторичных половых признаков должен быть
направлен к детскому эндокринологу или педиатру.Своевременное лечение важно, так как преждевременные результаты полового созревания
при ускоренном развитии скелета и нарушении окончательного роста взрослой особи.
Исследование вторичной аменореи и олигоменореи
Вторичная аменорея (прекращение менструации у женщин, у которых ранее была менструация) или олигоменорея (менструация
постоянно> 35 дней) чаще всего вызывается гипоталамической аменореей, синдромом поликистозных яичников или преждевременным возникновением яичников.
неудача (после первого исключения беременности).
Первоначальные исследования включают ФСГ, ЛГ и эстрадиол. Другие тесты будут зависеть от предполагаемой причины. Добавьте пролактин
и ТТГ при подозрении на гиперпролактинемию — это может быть связано с галактореей или симптомами заболевания щитовидной железы.
Уровень ФСГ в сыворотке> 20 МЕ / л и низкий эстрадиол у женщин в возрасте
Низкий уровень ЛГ и эстрадиола предполагает гипоталамическую причину аменореи (например, потеря веса, чрезмерные физические нагрузки или стресс).
Гиперпролактинемия
Стресс, прием лекарств и гипотиреоз следует рассматривать как причины гиперпролактинемии.Макропролактин, неактивный
форма пролактина, может быть доброкачественной причиной повышения уровня пролактина — это может быть обнаружено с помощью лабораторного анализа. Один раз
другие возможные причины повышения пролактина были исключены, визуализация гипофиза (МРТ или КТ) для пролактиномы
может рассматриваться в качестве вторичной помощи.
Синдром поликистозных яичников (СПКЯ)
СПКЯ можно диагностировать на основании двух из трех следующих критериев: клинических признаков или биохимических признаков гиперандрогении,
олигоменорея и / или ановуляция и поликистоз яичников на УЗИ. 11 В большинстве областей, финансируется государством
УЗИ для исследования СПКЯ не является приоритетом.
Тестостерон не обязательно требуется для диагностики СПКЯ, и уровень тестостерона повышается не у всех женщин с
СПКЯ, особенно с минимальными клиническими проявлениями. Можно рассмотреть возможность тестирования тестостерона вместе с ФСГ и ЛГ.
у пациентов с умеренным гирсуитизмом, поскольку значительно повышенный уровень может указывать на необходимость рассмотрения других причин.Если общий уровень тестостерона> 5 нмоль / л, необходимо дальнейшее исследование, чтобы исключить другие причины, такие как позднее начало
врожденная гиперплазия надпочечников, синдром Кушинга, опухоль надпочечников или яичников. 1 При подозрении на заболевание гипофиза,
добавьте пролактин, ТТГ и FT4, чтобы исключить возможность вторичного гипотиреоза.
Уровни свободного тестостерона (рассчитанные из общего тестостерона + SHBG) также иногда измеряются у женщин с СПКЯ,
но обычно в этом нет необходимости в условиях общей практики.Рекомендуется проконсультироваться с химическим патологом.
или эндокринолог, прежде чем обращаться в ГСПГ.
Уровень
ЛГ обычно повышен, тогда как уровень ФСГ в норме или снижен у женщин с СПКЯ.
Для получения дополнительной информации см .: «Понимание
синдром поликистозных яичников », BPJ 12 (апрель 2008 г.).
Исследование менопаузы
Тесты на гормоны обычно не нужны для диагностики менопаузы или наблюдения за лечением.
У женщин старше 45 лет с типичными симптомами менопаузы гормоны обычно не рекомендуются, так как уровни
имеют тенденцию значительно колебаться в течение этого периода, и вероятность наступления менопаузы выше в этой возрастной группе.Возраст и
Для постановки диагноза обычно достаточно одного года истории аменореи.
Тестирование ФСГ может быть полезным при определенных обстоятельствах, например, для определения причины олигоменореи и фертильности.
потенциал у более молодой женщины (в возрасте 12 лет ФСГ должен
обычно повторяется не реже одного раза (например, через шесть недель) для подтверждения результата. 2 N.B. ФСГ не позволяет надежно прогнозировать
климакс у женщин, использующих комбинированные пероральные контрацептивы. 2
Нет никакой пользы в измерении уровней эстрадиола для оценки доз заместительной гормональной терапии. 12 Эстрадиол
измерение также бесполезно при оценке риска перелома в постменопаузе.
Для получения дополнительной информации см .: «Гормональный
заместительная терапия: последние данные и рекомендации по лечению », BPJ 12 (апрель 2008 г.).
Исследование гипогонадизма у мужчин
Задержка полового созревания
Первым признаком полового созревания у мужчин является увеличение размера яичек, что обычно происходит в возрасте около 12 лет.
Наиболее частой причиной задержки полового созревания у мужчин является конституциональная задержка роста и полового созревания.Это чаще встречается в
мальчики с семейным анамнезом задержки полового созревания. Догоняющий рост, начало полового созревания и всплеск полового созревания происходят позже
чем в среднем, но в конечном итоге приводит к нормальному взрослому росту, половому развитию и фертильности.
Если клинические признаки полового созревания отсутствуют примерно к 16 годам, клиническое обследование и обследование могут
быть на рассмотрении. Первоначальные лабораторные исследования включают ФСГ, ЛГ, тестостерон, пролактин, ТТГ и FT4.Рекомендуется
что результаты обсуждаются с эндокринологом, и пациент направляется для дальнейшего обследования и диагностики
если необходимо.
Повышенный уровень ФСГ и ЛГ указывает на первичный гипогонадизм. Низкие или нормальные уровни ФСГ и ЛГ предполагают вторичный гипогонадизм, который
в редких случаях может быть связано с дисфункцией гипоталамуса, гипопитуитаризмом, гипотиреозом или гиперпролактинемией. Конституционный
задержка полового созревания связана с низким уровнем ФСГ и ЛГ.
Для получения дополнительной информации см .: «Выбранные
темы мужского здоровья », Best Tests (сентябрь 2010 г.).
Гинекомастия
Гинекомастия — доброкачественное увеличение ткани груди у мужчин, которое указывает на дисбаланс между свободными эстрогенами.
и андрогены. Важно различать настоящую гинекомастию, которая ощущается как концентрический, эластичный или твердый бугорок.
ткани вокруг соска из-за скопления жировой ткани.
Гинекомастия довольно часто встречается в период среднего и позднего полового созревания, когда относительно высокие уровни эстрогена вырабатываются
яички и периферические ткани, прежде чем тестостерон достигнет уровня взрослого человека.Почти во всех случаях это разрешается в
от одного до двух лет. Заболеваемость гинекомастией снова возрастает у пожилых мужчин, что, возможно, связано со снижением уровня свободного тестостерона.
уровни.
У взрослых мужчин с гинекомастией после устранения причин, таких как лекарства (например, антиандрогены, трициклические
антидепрессанты, метронидазол, спиронолактон, блокаторы кальциевых каналов, циметидин) или сопутствующее заболевание (например, цирроз),
рассмотрите возможность тестирования уровня тестостерона (а затем — ЛГ, если он низкий), эстрадиола и ХГЧ.ХГЧ измеряется, потому что в редких случаях
Производство ХГЧ опухолью яичка (или другой эктопической опухолью, секретирующей ХГЧ), может привести к чрезмерному уровню эстрогена,
проявляется как увеличение ткани груди.
Для получения дополнительной информации см .: «Выбранные
темы мужского здоровья », Best Tests (сентябрь 2010 г.).
Поздний гипогонадизм
У взрослого мужчины с клинически значимыми признаками и симптомами гипогонадизма (например, снижение либидо, отсутствие ранним утром
эрекция), подумайте о тестировании уровня тестостерона.Образец следует собирать рано утром, например 8 утра, как
дневные и вечерние уровни могут быть значительно ниже.
Если единичный уровень тестостерона ранним утром явно находится в пределах нормы (например,> 15 нмоль / л), то больше не нужно
требуется тестирование. Если обнаружен низкий или пограничный уровень тестостерона, необходимо провести подтверждающий тест рано утром.
(когда пациент здоров) и одновременное измерение ЛГ, чтобы отличить возможные первичные от вторичных
гипогонадизм.Если уровни ЛГ низкие, можно добавить пролактин для исследования гиперпролактинемии.13 Требуется только ФСГ.
добавлено при исследовании фертильности.
Высокий уровень ЛГ в сыворотке (и ФСГ, если измеряется) и низкий или пограничный уровень тестостерона соответствуют первичному гипогонадизму. Низкий
или несоответствующий нормальный уровень ЛГ в сочетании с низким уровнем тестостерона соответствует вторичному гипогонадизму.
SHBG, для измерения свободного тестостерона, требуется только в редких случаях, например, при нарушениях связывания половых гормонов.
(е.грамм. гипертиреоз, прием противосудорожных средств, тяжелое ожирение) могут ввести в заблуждение уровень общего тестостерона. Обсуждение
в таких случаях может помочь эндокринолог или химический патолог
Для получения дополнительной информации см .: «Возрастные
снижение тестостерона у мужчин », Best Tests (июнь 2012 г.).
Исследование недостаточной фертильности
Вероятность того, что здоровая пара репродуктивного возраста забеременеет в каждом репродуктивном цикле, составляет 20-25%. 14 Это
возрастает до 60% в течение шести месяцев, 84% в первый год и 92% в течение второго года. 14
Если у пары возникают проблемы с фертильностью, сначала успокойте и дайте совет относительно фертильной фазы менструального цикла.
цикл и оптимальная частота полового акта, то есть каждые два-три дня. Графики температуры бесполезны и должны
не рекомендуется. 15 Факторы образа жизни, влияющие на фертильность, такие как ИМТ 30 и курение, должны
быть адресованным.
Расследование может быть рассмотрено, если беременность не наступила через 12 месяцев у женщины в возрасте 35 лет. 15 Оба партнера должны быть оценены и обследованы. Первоначальные расследования
В первичной медико-санитарной помощи необходимо установить, идет ли овуляция у самки и есть ли у мужчины нормальный анализ спермы. 15
У женщины с регулярным менструальным циклом можно предположить, что происходит овуляция. Однако, если есть сомнения
(т.е.беременность не наступила в ожидаемые сроки) прогестерон можно измерить за семь дней до ожидаемого срока.
дата менструации, например на 21 день обычного 28-дневного цикла, чтобы проверить, произошла ли овуляция — овуляция вероятна
если прогестерон> 25 нмоль / л. У женщин с длительным циклом прогестерон можно проверить на 21 день цикла, а затем
повторять каждые семь дней до наступления менструации (или всего за семь дней до предполагаемой менструации, если циклы продлены.
но штатный).
ФСГ, ЛГ и эстрадиол следует проверять в начале менструального цикла (второй — шестой день, где первый день — это первый день).
менструации). 15 Повышенный уровень ФСГ свидетельствует о снижении резерва яичников и вероятности преждевременных родов.
яичниковая недостаточность. 15
Самок с отсутствующими или нерегулярными циклами следует обследовать на предмет вторичной аменореи.
Если у партнера-мужчины изначально был ненормальный анализ спермы, повторите его через шесть недель для подтверждения.Дальнейшее расследование
Анализ основных причин аномального анализа спермы обычно проводится в отделении вторичной медико-санитарной помощи. Однако тестостерон, ФСГ
и ЛГ могут быть исследованы при подозрении на гипогонадизм.
Критерии оценки субфертильности у женщин, финансируемой государством, следующие:
- ИМТ 18-32
- Некурящий или бывший курильщик> трех месяцев
- Возраст
- Менее двух детей от текущих отношений
- Не менее двух лет субфертильности,
или
один год, если возраст 35 или шесть месяцев, с ановуляцией, азооспермией, олигоспермией, двусторонней салингэктомией, непроходимостью маточных труб,
офрэктомия или преждевременная недостаточность яичников
Устойчивость к андрогенам
Измерение эстрадиола рекомендуется мужчинам с обнаружением высоких уровней сывороточного тестостерона и ЛГ, а также
особенности недостаточной маскулинизации (напр.грамм. редкие волосы на лобке, лице или теле, недоразвитая мошонка, половой член и яички), как
это наводит на мысль об устойчивости к андрогенам. 13
Раннее направление к репродуктологу или соответствующему специалисту следует предлагать, если: 16
- Возраст партнера старше 35 лет
- У партнерши аменорея / олигоменорея
- Партнерша в анамнезе перенесла операции на органах брюшной полости или таза
- Партнерша прошла патологическое обследование органов малого таза
- У партнера женского или мужского пола в анамнезе были инфекции, передающиеся половым путем (включая воспалительные заболевания органов малого таза)
- У партнера-мужчины ненормальный анализ спермы
- У партнера-мужчины неопущенные яички или другая патология половых органов
- Партнер-мужчина в анамнезе урогенитальная хирургия
- У партнера-мужчины варикоцеле
- Пара очень обеспокоена и будет уверена, если проконсультируется.
Отдельные клиники репродуктивного здоровья могут иметь особые критерии для направления к специалистам,
обратитесь за советом в местную клинику.
Исследование беременности на ранних сроках
Случайный анализ мочи на ХГЧ можно использовать в первичной медико-санитарной помощи для диагностики беременности на ранних сроках. Положительный анализ мочи возможен на
однако в первый день задержки менструации задержка теста снижает вероятность ложноотрицательного результата. Ложноотрицательный
результат может возникнуть, если анализ мочи будет проведен слишком рано после имплантации эмбриона, особенно если образец мочи
разбавлен. Если есть подозрение на беременность, несмотря на отрицательный результат теста, тест следует повторить через неделю.В зависимости от
в зависимости от типа используемого набора, уровни ХГЧ> 20–25 МЕ / л покажут положительный результат. Большинство производителей домашних тестов на беременность
имеют аналогичный порог обнаружения и считаются надежными при использовании в соответствии с инструкциями производителя. 17 А
положительный или отрицательный результат домашнего теста на беременность обычно должен быть подтвержден врачом, чтобы убедиться, что
техника отбора проб была соблюдена.

 Факт этот докзан, поэтому если жира у вас уже не много, а тестостерон не высок – тренировки с отягощениями – отличный способ повысить уровень тестостерона.
Факт этот докзан, поэтому если жира у вас уже не много, а тестостерон не высок – тренировки с отягощениями – отличный способ повысить уровень тестостерона.  В Вашем случае, по всей видимости, это возрастной гипогонадизм, явление нормальное , которое не минует никого. Вам ни в коем случае не надо тратить деньги на бустеры, трибулусы и прочие штуки. Вылечить возрастной гипогонадизм нереально и самым лучшим будет гормозамещающая терапия. ГЗТ. То есть тут совет как поднять уровень тестостерона мужчине после 40 один – идете к эндокринологу и пусть он вам назначает препараты замещающие терапии.
В Вашем случае, по всей видимости, это возрастной гипогонадизм, явление нормальное , которое не минует никого. Вам ни в коем случае не надо тратить деньги на бустеры, трибулусы и прочие штуки. Вылечить возрастной гипогонадизм нереально и самым лучшим будет гормозамещающая терапия. ГЗТ. То есть тут совет как поднять уровень тестостерона мужчине после 40 один – идете к эндокринологу и пусть он вам назначает препараты замещающие терапии.