Equality — СЕКРЕТЫ МУЖСКИХ ЦИКЛОВ #эндокринология #обзор…
СЕКРЕТЫ МУЖСКИХ ЦИКЛОВ
#эндокринология #обзор #гормональные_циклы #тестостерон
Статья Алексея Стукальского. Редакция Наталии Бутковой.
Наличие гормональных циклов у женщин – общеизвестный факт, изучаемый (в том числе) в школьном курсе биологии. Исследований, рассматривающих женские гормональные циклы и их влияние на здоровье и самочувствие женщины – великое множество. Мужские же гормональные циклы — не слишком популярная тема, о них не так часто слышно, и может показаться, что у мужчин в принципе нет цикличных изменений в гормональном фоне. Однако это совсем не так.
На данный момент в научной литературе суточные (циркадные) и более короткие (ультрадианные) колебания гормонов у мужчин [1][2][3][4][5] описаны весьма подробно. Например, известно, что максимальный уровень тестостерона у мужчин наблюдается утром (пик примерно в 8 утра), днем он снижается, а ночью, наоборот, растет. И хотя о перепадах одних гормонов ученые знают больше, чем о других, само явление является довольно хорошо изученным и широко признанным научной общественностью.
Но все становится сложнее, когда мы пытаемся узнать больше о длительных гормональных циклах. Переработав большой массив литературы, мы нашли некоторые исследования, свидетельствующие о существовании подобных флуктуаций длиною более суток (инфрадианных), и даже более месяца (сезонные циклы) у мужчин. Давайте же взглянем на известные научные данные о потенциально существующих периодичных колебаниях уровня гормонов у мужчин и их возможном влиянии на организм. Описание всех проанализированных работ вы можете найти в сводной таблице (https://vk.com/page-64367994_53410717), где указана основная информация об исследованиях: метод, количество участников, длительность наблюдения, результаты.
АНДРОГЕНЫ
Одним из важных гормонов, вырабатывающихся в организме мужчин и женщин, является тестостерон. Как уже говорилось, в течение дня уровень тестостерона в мужском организме то повышается, то понижается – этот факт изучен. Однако при попытке обнаружить более длительные циклы (инфрадианные) ученые получили весьма противоречивые данные.
Одной из ранних попыток обнаружить мужские гормональные циклы было исследование уровня тестостерона в плазме, проведенное Роуи и коллегами в 1974 году [6]. Тогда инфрадианных циклов обнаружить не удалось. Гораздо позже, в 2006-2007 году, Селек и коллеги, исследуя возможные 3-15 дневные циклы в концентрации тестостерона в слюне, также не смогли найти никаких статистически значимых циклов подобной длительности [7][8].
Но существуют и другие исследования.
В некоторых работах были обнаружены короткие циклы в колебаниях уровня тестостерона у мужчин – длиной от нескольких дней до двух недель. Например, в 1968 году Коркер и Эксли, изучая уровень гормонов в мужской моче, обнаружили 8-10 дневные циклы тестостерона у одного из двух мужчин в своем исследовании [9]. Годом раньше Измаил и коллеги обнаружили циклы длиной от 4 до 12 дней у 5 участников [10]. Немного позже, в 1974 году, результаты подтвердились — Харкнесс также обнаружил циклы длиною в среднем 3-5 и 12-18 дней [11]. Также имеется неопубликованное исследования Созена на одном человеке, обнаружившее циклы колебания уровня тестостерона в моче длиною 4.5 и 8.5 дня [1(TABLE 7.6)]. Есть и более поздние исследования со схожими результатами. Например, в 1999 Пронина частично подтвердила ранние исследования, обнаружив инфрадианные ритмы с периодами от 5 до 13,5 дней у подростков [12], и Диатроптов, который обнаружил 4,06 суточные периоды колебаний тестостерона [13]. В 2005 году Хиршенхаузер и коллеги, изучая гормональный фон 27 мужчин, также обнаружили 7-дневные циклы [14]. Вероятно, существуют циклические изменения уровня тестостерона длиной до двух недель.
Также имеется неопубликованное исследования Созена на одном человеке, обнаружившее циклы колебания уровня тестостерона в моче длиною 4.5 и 8.5 дня [1(TABLE 7.6)]. Есть и более поздние исследования со схожими результатами. Например, в 1999 Пронина частично подтвердила ранние исследования, обнаружив инфрадианные ритмы с периодами от 5 до 13,5 дней у подростков [12], и Диатроптов, который обнаружил 4,06 суточные периоды колебаний тестостерона [13]. В 2005 году Хиршенхаузер и коллеги, изучая гормональный фон 27 мужчин, также обнаружили 7-дневные циклы [14]. Вероятно, существуют циклические изменения уровня тестостерона длиной до двух недель.
Другие же исследования нашли и более длительные гормональные циклы – длиною около месяца. Например, в 1975 Деринг и коллеги обнаружили у 12 из 20 испытуемых циклы в 20-22 дня. Колебания уровня тестостерона составляли в среднем 17% от среднего значения [15]. Причем их результаты подтвердились при использовании трех (из четырех) аналитических методов. Из более поздних исследований можно отметить работу Селек и
Из более поздних исследований можно отметить работу Селек и
коллег 2002 года. Исследуя уровень гормонов у 1 мужчины, они обнаружили свидетельство 30 дневных изменений в уровне тестостерона [16]. Та же команда подтвердила свои выводы в 2003 году, обнаружив 20-30 дневные циклы тестостерона в слюне 31 мужчины [17]. В 2013 Курвуазье и коллеги обнаружили в своем исследовании 30 дневный цикл способностей к мысленному вращению у 7 из 10 мужчин, на который вероятно может влиять цикл тестостерона [39] . Интересно, что некоторые исследователи обнаружили факторы, которые могут влиять на наличие циклов у мужчин. Например, Хиршенхаузер и коллеги обнаружили 28-дневные колебания гормонов, но только у мужчин, желающих завести детей, у остальных такой цикл отсутствовал [14].
Самые длинные циклы, которые были замечены ученными у мужчин – это сезонные гормональные циклы. Сезонные колебания тестостерона были зарегистрированы во многих проведенных исследованиях [18], но Р. Смит и коллеги в своем обзоре за 2013 год указывают на противоречивость результатов исследований, что мешает включить сезонные гормональные циклы в клиническую практику. Однако в своем обзоре Р.Смит и коллеги не отрицают существования подобных циклов [19]. Новые исследования довольно последовательно находят сезонное колебание в уровнях гормонов [18][20][21], что подтверждает существование длительных цикличных изменений уровня тестостерона.
Однако в своем обзоре Р.Смит и коллеги не отрицают существования подобных циклов [19]. Новые исследования довольно последовательно находят сезонное колебание в уровнях гормонов [18][20][21], что подтверждает существование длительных цикличных изменений уровня тестостерона.
Как мы видим, в научной литературе существуют достаточно противоречивые данные о инфрадианных гормональных циклах мужчин. Тем временем, подобные колебания в уровне тестостерона, вполне вероятно, могут влиять на самочувствие и здоровье мужчин. Существует исследование, отмечающее влияние 20-30 дневных циклов тестостерона на способность мысленного вращения [22][39]. Также тестостерон, вероятно, играет роль в описанных в литературе длительных и коротких [30, 3-128, 3.5, 20, (38,16, 21)-дневных] циклах настроения, раздражительности, бдительности и эффективности [23][24][25][26][1(TABLE 7.6)]. Сезонные же циклы тестостерона, по-видимому, могут влиять на пространственные способности [27]. Сезонные колебания других гормонов включая тестостерон, могут быть задействованы в сезонных скачках суицидального, агрессивного и сексуального поведения, а также влиять на тревожность [28][29][1 TABLE 4. 8]. Имеются также негативные результаты, не показавшие сезонных колебаний рейтинга боли, тревожности и болевого порога[5]. Очевидно, что гормоны имеют огромное влияние на самочувствие мужчин, поэтому важно дальнейшее изучение цикличных изменений уровня тестостерона.
8]. Имеются также негативные результаты, не показавшие сезонных колебаний рейтинга боли, тревожности и болевого порога[5]. Очевидно, что гормоны имеют огромное влияние на самочувствие мужчин, поэтому важно дальнейшее изучение цикличных изменений уровня тестостерона.
ЭСТРОГЕНЫ
Интересно, что тестостерон — не единственный гормон, имеющий циклические изменения в мужском организме. Экслей и коллеги обнаружили 8-10-дневный цикл эстрона [30], а Селек и коллеги — 12 дневный цикл эстрадиола [8] у мужчин. В ряде исследований были обнаружены сезонные колебания эстрогенов [31] [32] [33], но результаты, опять же, противоречивы [34] [35] [36]. Также имеется исследование, обнаружившее 30 дневный цикл эстрадиола у мужчин и его связь с мысленным вращением[39].
Как и с андрогенами, вероятные гормональные колебания нуждаются в дальнейшем изучении, тем более, что уже есть несколько исследований, обнаруживших цикличные изменения уровня эстрогенов.
КЕТОСТЕРОИДЫ
Помимо эстрогеновых циклов, Экслей и коллеги также обнаружили 8-10-дневный цикл экскреции 17-оксостероидов [30], Кертис — циклы амплитудой 18 и 45,6 дней [37], а Халберг, наблюдавший за одним мужчиной на протяжении 15 лет, в ряде своих работ отметил 7-, 20- и 30-дневные циклы [37] [38].
ВЫВОД
К сожалению, мужские гормональные циклы пока остаются весьма малоизученным феноменом. Из-за чрезвычайной скудности литературы и противоречивых данных у нас нет стопроцентных доказательств, чтобы однозначно утверждать о наличии инфрадианных циклов тестостерона и других гормонов, как и об их длительности. Но отбрасывать их было бы преждевременно. Существующих исследований достаточно для того, чтобы понять – в дальнейшем исследовании периодических колебаний уровня гормонов есть смысл. Например, с учётом новой литературы наличие сезонных колебаний вызывает все меньше сомнений. Вероятно, дальнейшие
исследования инфрадианных циклов также смогут внести ясности в этот вопрос. Гормональные циклы могут иметь весьма значительное влияние на мужской организм — от способности к мысленному вращению до перепадов настроения и изменения поведения. Эти циклы необходимо выявить и учитывать как в клинической практике, так и в повседневной жизни.
1. Koukkari, Willard L., and Robert B.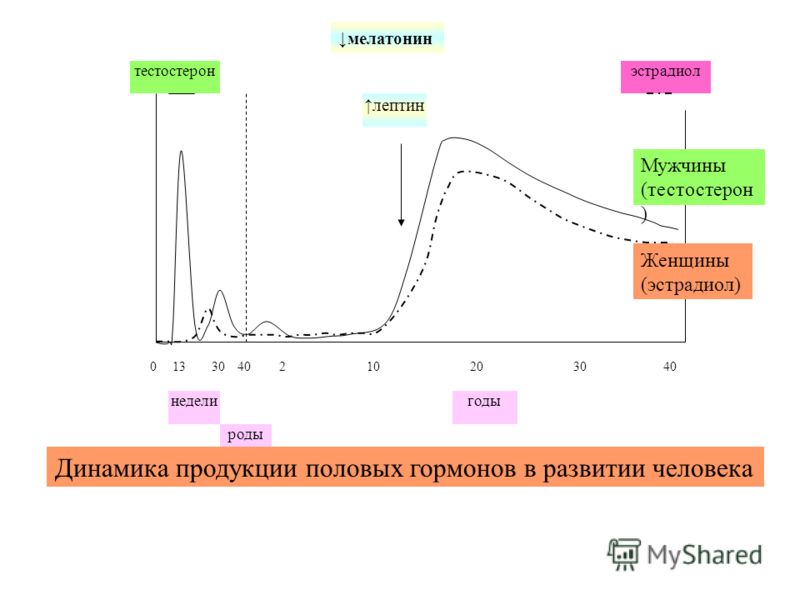 Sothern. Introducing biological rhythms: A primer on the temporal organization of life, with implications for health, society, reproduction, and the natural environment. Springer Science & Business Media, 2007. стр 272-285
Sothern. Introducing biological rhythms: A primer on the temporal organization of life, with implications for health, society, reproduction, and the natural environment. Springer Science & Business Media, 2007. стр 272-285
2. Diver, Michael J., et al. «Diurnal rhythms of serum total, free and bioavailable testosterone and of SHBG in middle‐aged men compared with those in young men.»Clinical endocrinology58.6 (2003): 710-717.
3. Nicolau, Grazziela Y., et al. «Circadian and circannual rhythms of hormonal variables in elderly men and women.»Chronobiology international1.4 (1984): 301-319.
4. Kennaway, David J., and Helen Wright. «Melatonin and circadian rhythms.»Current topics in medicinal chemistry2.2 (2002): 199-209.
5. Choi, Jae Chan, et al. «Effects of seasonal differences in testosterone and cortisol levels on pain responses under resting and anxiety conditions.»Yonsei medical journal55.1 (2014): 216-223.
6. Rowe P. H. et al. Temporal variations of testosterone levels in the peripheral blood plasma of men //Journal of Endocrinology. – 1974. – Т. 61. – №. 1. – С. 63-73.
– 1974. – Т. 61. – №. 1. – С. 63-73.
7. Celec, Peter, et al. «Infradian dynamics and variability of salivary testosterone in men and women.»Biological Rhythm Research 38.5 (2007): 367-372.
8. Celec, Peter, et al. «Infradian rhythmic variations of salivary estradioland progesterone in healthy men.»Biological Rhythm Research 37.01 (2006): 37-44.
9. Corker C. S., Exley D. Daily changes in urinary testosterone levels of the human male //Journal of Endocrinology. – 1968. – Т. 40. – №. 2. – С. 255-256.
10 Ismail, A. A. A., and R. A. Harkness. «Urinary testosterone excretion in men in normal and pathological conditions.» Acta endocrinologica 56.3 (1967): 469-480.
11. Harkness R. A. Variations in testosterone excretion by man. – 1974.
12. Пронина Т. С. Циркадные и инфрадианные ритмы экскреции тестостерона и альдостерона у детей //Пробл. эндокринол. – 1992. – №. 1. – С. 38-42.
13. Диатроптов М. Е. Инфрадианный ритм изменения уровня стероидных гормонов и рецепторного антагониста интерлейкина-1 у мужчин зрелого возраста //Иммунология. – 2011. – Т. 6. – С. 324-27.
– 2011. – Т. 6. – С. 324-27.
14 Hirschenhauser, Katharina, and Didone Frigerio. «5. Hidden Patterns of Male Sex Hormones and Behaviour Vary with Life History.» (2005).
15. Doering C. H. et al. A cycle of plasma testosterone in the human male //The Journal of Clinical Endocrinology & Metabolism. – 1975. – Т. 40. – №. 3. – С. 492-500.
16. Celec, Peter, et al. «The circalunar cycle of salivary testosterone and the visual-spatial performance.»Bratislavske lekarske listy 103.2 (2002): 59-69
17. Celec P. et al. Circatrigintan cycle of salivary testosterone in human male //Biological rhythm research. – 2003. – Т. 34. – №. 3. – С. 305-315.
18. Choi, Jae Chan, et al. «Effects of seasonal differences in testosterone and cortisol levels on pain responses under resting and anxiety conditions.»Yonsei medical journal55.1 (2014): 216-223.
19. Smith, Ryan P., et al. «The evidence for seasonal variations of testosterone in men.»Maturitas74.3 (2013): 208-212.
20. Bellastella, G., et al. «Seasonal variations of plasma gonadotropin, prolactin, and testosterone levels in primary and secondary hypogonadism: evidence for an independent testicular role.»Journal of endocrinological investigation36.5 (2013): 339-342.
21. Tak, Young Jin, et al. «Serum 25-hydroxyvitamin D levels and testosterone deficiency in middle-aged Korean men: a cross-sectional study.»Asian journal of andrology17.2 (2015): 324.
22. Ostatníková D. et al. Spatial abilities during the circalunar cycle in both sexes //Learning and Individual Differences. – 2010. – Т. 20. – №. 5. – С. 484-487.
23. Ramey, Estelle. «Men’s Cycles (They Have Them Too, You Know).»Ms., Preview(1972): 10-14. (если нужен pdf обращайтесь в лс к Алексею)
24. Eastwood, M. Robin, et al. «Infradian rhythms: a comparison of affective disorders and normal persons.»Archives of general psychiatry42.3 (1985): 295-299.
25. Cornelissen, G., et al. «Mapping of circaseptan and circadian changes in mood.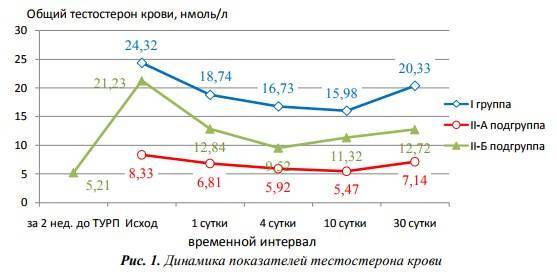 «Scripta medica78.2 (2005): 89.
«Scripta medica78.2 (2005): 89.
26. Empson, J. «Periodicity in body temperature in man.»Cellular and Molecular Life Sciences33.3 (1977): 342-343.
27 Kimura, Doreen, and Elizabeth Hampson. «Cognitive pattern in men and women is influenced by fluctuations in sex hormones.» Current directions in psychological science 3.2 (1994): 57-61.
28 Woo, Jong-Min, Olaoluwa Okusaga, and Teodor T. Postolache. «Seasonality of suicidal behavior.» International journal of environmental research and public health 9.2 (2012): 531-547.
29 Demir, Aslan, Mehmet Uslu, and Omer Erkam Arslan. «The effect of seasonal variation on sexual behaviors in males and its correlation with hormone levels: a prospective clinical trial.» Central European journal of urology 69.3 (2016): 285.
30 Exley, D., et al. «The human male cycle of urinary oestrone and 17-oxosteroids.» Journal of Endocrinology 35.1 (1966): 83-99.
31 Moskovic, Daniel J., Michael L. Eisenberg, and Larry I. Lipshultz. «Seasonal Fluctuations in Testosterone‐Estrogen Ratio in Men From the Southwest United States.» Journal of andrology 33.6 (2012): 1298-1304
«Seasonal Fluctuations in Testosterone‐Estrogen Ratio in Men From the Southwest United States.» Journal of andrology 33.6 (2012): 1298-1304
32 Bjørnerem, Åshild, et al. «Seasonal variation of estradiol, follicle stimulating hormone, and dehydroepiandrosterone sulfate in women and men.» The Journal of Clinical Endocrinology & Metabolism 91.10 (2006): 3798-3802
33 Reinberg, Alain, et al. «Annual variation in semen characteristics and plasma hormone levels in men undergoing vasectomy.» Fertility and sterility 49.2 (1988): 309-315.
34 Andersson A. M. et al. Variation in levels of serum inhibin B, testosterone, estradiol, luteinizing hormone, follicle-stimulating hormone, and sex hormone-binding globulin in monthly samples from healthy men during a 17-month period: possible effects of seasons //The Journal of Clinical Endocrinology & Metabolism. – 2003. – Т. 88. – №. 2. – С. 932-937.
35 Brambilla, Donald J., et al. «Lack of seasonal variation in serum sex hormone levels in middle-aged to older men in the Boston area. » The Journal of Clinical Endocrinology & Metabolism 92.11 (2007): 4224-4229.
» The Journal of Clinical Endocrinology & Metabolism 92.11 (2007): 4224-4229.
36 Berg, Sandra J., and Katherine E. Wynne-Edwards. «Changes in testosterone, cortisol, and estradiol levels in men becoming fathers.» Mayo Clinic Proceedings. Vol. 76. No. 6. Elsevier, 2001. 37 Curtis, G. C. «Long-term changes in corticosteroid excretion.» (1974).
37 Halberg, Franz, et al. «Spectral resolution of low-frequency, small-amplitude rhythms in excreted 17-ketosteroids; probable androgen-induced circaseptan desynchronization.» Acta endocrinologica 50.4 Suppl (1965): S5-S54.
38 Levi, Francis, and Franz Halberg. «Circaseptan (about-7-day) bioperiodicity—spontaneous and reactive—and the search for pacemakers.» International Journal of Clinical & Laboratory Research 12.2 (1982): 323-370.
39 Courvoisier, D. S., Renaud, O., Geiser, C., Paschke, K., Gaudy, K., & Jordan, K. (2013). Sex hormones and mental rotation: an intensive longitudinal investigation. Hormones and Behavior, 63(2), 345-351.
Солнечные ванны повышают сексуальное влечение мужчин
Подпись к фото,
Солнечные ванны полезны, но в умеренном количестве
Уровень сексуального влечения у мужчин или либидо находится в прямой зависимости от уровня получаемой солнечной радиации.
По данным группы австрийских ученых, опубликовавших в научном журнале Clinical Endocrinology («Клиническая эндокринология») результаты обследования 2299 мужчин, уровень мужского гормона тестостерона в крови мужчин зависит от присутствия витамина Д, а тот, в свою очередь, колеблется в зависимости от инсоляции.
Содержание и того, и другого в крови обследованных мужчин колебалось в зависимости от времени года.
Ученым уже давно известно, что низкий уровень тестостерона снижает либидо, а также уровень общей энергии.
От него также зависят и другие важные функции организма и у мужчин и у женщин, например, сила мускулов и плотность костных тканей.
Максимальный уровень обеих веществ наблюдался в августе, а к зиме он значительно понижался, достигая самой низкой отметки в марте.
Теперь один из авторов исследования профессор Винфрид Марц предлагает проверить, позволяют ли таблетки с витамином Д повысить уровень тестостерона.
Эд Бранд, сотрудник форума Sunlight Research в Нидерландах, некоммерческой организации, созданной для популяризации последних научных открытий в области воздействия на организм солнечного излучения, указывает: «Мужчины, которые принимают меры к поддержанию достаточного уровня витамина Д, обеспечивают тем самым и адекватный уровень тестостерона и, соответственно, уровень либидо».
Облучаться надо осторожно
При этом онкологи предупреждают, что чрезмерное увлечение солнечными ваннами может привести к повышению риска заболеть раком
Алан Пейси, профессор андрологии в университете Шеффилда на севере Англии, считает: «Нам известно, что для увеличения уровня либидо и общего самочувствия мужчин, у которых отмечается низкий уровень содержания тестостерона, применяется гормонотерапия».
«Однако это рекомендуется делать только в конкретных клинических обстоятельствах, когда известно, что в организме вырабатывается мало тестостерона».
«Нам пока неясно, оказывают ли сезонные колебания в уровне тестостерона ощутимое воздействие на самочувствие мужчин, и я бы хотел призвать мужчин проявлять разумную осторожность при использовании кварцевых инсоляторов».
Известно, что уровень витамина Д можно повысить и за счет употребления большого количества рыбы и других продуктов, обладающих повышенным содержание ненасыщенных жиров типа Омега-3.
РОЛЬ ТЕСТОСТЕРОНА В ОРГАНИЗМЕ МУЖЧИН И ЖЕНЩИН
X-Potens Tribulus 500 (Экстракт Tribulus Тerrestris) придает силу, мышечную крепость, выносливость и мужественность
http://finvitamin.com.ua/product/x-potens-tribulus-3
Тестостерон — это мужской половой гормон, вырабатываемый в яичках мужчин. Кроме яичек тестостерон синтезируется также и из андростендиона, вырабатываемого сетчатой зоной коры надпочечников. Тестостерон вырабатывается и в женском организме (в той же коре надпочечников и в яичниках), правда, в гораздо меньших количествах.
Тестостерон вырабатывается и в женском организме (в той же коре надпочечников и в яичниках), правда, в гораздо меньших количествах.
В любом случае, непосредственно в тестостерон превращается вещество, называемое прекурсором тестостерона или прогормоном. Синтез тестостерона происходит в основном в яичках (клетки Лейдига) главным образом под влиянием гипофизарного лютеинизирующего гормона (ЛГ или лютропина). ЛГ, в свою очередь, вырабатываются в гипофизе под воздействием гипоталамического гормона, именуемого гонадотропин-рилизинг гормон (ГнРГ, ГтРГ). Гипофиз использует информацию о наличии половых гормонов в крови для того, чтобы регулировать производство ЛГ, а гипоталамус — для регулирования производства ГнРГ. В любом случае, повышение уровня свободного тестостерона в организме является для гипофиза сигналом к сокращению производства ЛГ, а раз падает производство лютеинизирующего гормона, то сокращается и производство собственно тестостерона.
Значение гормона тестостерона для мужчин трудно переоценить; тестостерон, собственно, и делает мужчин мужчинами — он отвечает за формирование вторичных половых признаков. Именно благодаря тестостерону мужчины имеют растительность на лице и теле; именно благодаря тестостерону мужчины имеют более низкий голос и более агрессивный характер, чем женщины. Наконец, именно тестостерон может способствовать облысению некоторых мужчин. Тестостерон активизирует и анаболические процессы в организме (процессы создания новых клеток, накопление жиров, создание новых мышечных волокон и тканей организма).
Именно благодаря тестостерону мужчины имеют растительность на лице и теле; именно благодаря тестостерону мужчины имеют более низкий голос и более агрессивный характер, чем женщины. Наконец, именно тестостерон может способствовать облысению некоторых мужчин. Тестостерон активизирует и анаболические процессы в организме (процессы создания новых клеток, накопление жиров, создание новых мышечных волокон и тканей организма).
Тестостерон для женщин также является немаловажным гормоном. Существует прямая связь между уровнем тестостерона в крови женщин и отложением жиров. В период, предшествующий менопаузе, равно как и после нее, уровень тестостерона в организме женщин существенно понижается. Именно в этот период женщины наиболее склонны к отложению жиров.
Кроме того, недостаток тестостерона в крови у женщин может существенно ослабить половое влечение; низкий уровень тестостерона способствует возникновению проблем с концентрацией внимания, увеличивает вероятность депрессивных состояний. Более того, недостаток тестостерона влечет за собой повышенную сухость и утончение кожи. Так что и для женщин важность этого гормона не менее трудно переоценить, чем для мужчин.
Более того, недостаток тестостерона влечет за собой повышенную сухость и утончение кожи. Так что и для женщин важность этого гормона не менее трудно переоценить, чем для мужчин.
Уровень тестостерона в крови мужчин очень сильно возрастает в период полового созревания, собственного тестостерона в юношеские годы может вполне хватить для формирования атлетического телосложения. А вот после 45-50 лет уровень тестостерона в мужском организме начинает неуклонно и довольно таки резко снижаться, а уровень эстрогена повышаться. Взятые вместе эти два фактора неизбежно приводят к различным и очень неприятным расстройствам, среди которых стоит выделить проблемы с простатой, сердечно сосудистой системой, памятью, заболевания, связанные с ослаблением иммунитета и даже возрастную гинекомастию (увеличение молочных желез). Как бы то ни было, в этот период дополнительный прием препаратов, стимулирующих выработку гормона тестостерона, весьма желателен.
Уровень тестостерона имеет суточные колебания: максимум приходится на 7-9 часов утра, в минимум на 0-3 часа ночи. Помимо суточных колебаний, тестостерон в крови у мужчин имеет и сезонные колебания: он возрастает весной, а пик его приходится на ночь. Начиная с июля уровень тестостерона постепенно снижается, и наименьшего значения достигает к середине сентября. Именно это время наиболее «благоприятно» для начала осенней депрессии.
Помимо суточных колебаний, тестостерон в крови у мужчин имеет и сезонные колебания: он возрастает весной, а пик его приходится на ночь. Начиная с июля уровень тестостерона постепенно снижается, и наименьшего значения достигает к середине сентября. Именно это время наиболее «благоприятно» для начала осенней депрессии.
Tribulus Тerrestris стимулирует работу гипоталамуса и гипофиза и усиливает выработку лютеинизирующего гормона, который отдает команду яичкам вырабатывать тестостерон.
Помимо этого растение Tribulus Тerrestris усиливает выработку гипофизом фолликулостимулирующего гормона, под действием которого в яичках усиливается сперматогенез (увеличивается объем эякулята, концентрация сперматозоидов и их подвижность) и возрастает фертильность. Помимо усиления сексуальных возможностей, Tribulus Тerrestris может увеличить величину и силу мышц у спортсменов, поскольку тестостерон является мощным анаболическим гормоном.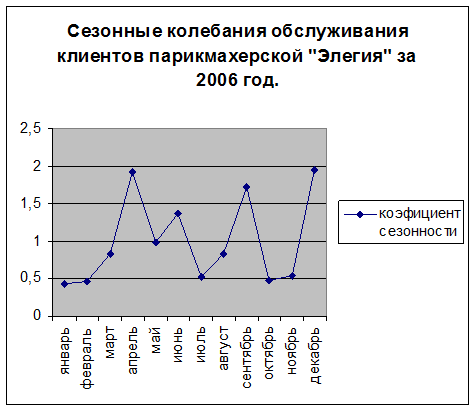
Спортсмены используют Tribulus Тerrestris еще и потому, что он обладает мочегонным действием, и использование его позволяют избавиться от избытка воды в организме. Tribulus Тerrestris показан не только мужчинам, но и женщинам, особенно после 30 лет, поскольку нормализует выработку гипофизом фолликулостимулирующего и лютеинизирующего гормонов, тем самым, восстанавливая баланс синтеза эстрогена, тестостерона и прогестерона. Прием Tribulus Тerrestris надо прекратить за 5 дней до начала менструации. После возобновления менструации прием препарата можно продолжить. Использование препарата в период менопаузы помогает снимать климактерические синдромы.
Современные методы определения тестостерона | Гончаров
1. Waggoner W, Boots LR, Azziz R.Total testosterone and DHEAS levels as predictors of androgen-secreting neoplasms: a populational study.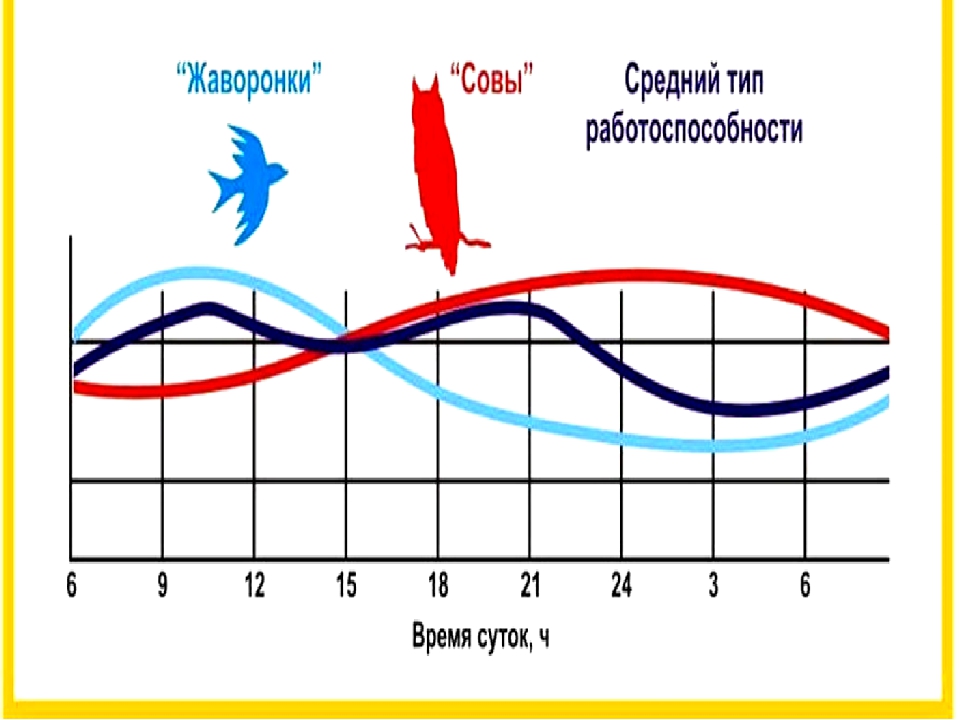 Gynecol Endocrinol. 1999 ;13(6):394-400.
Gynecol Endocrinol. 1999 ;13(6):394-400.
2. Rittmaster R.S., Arab D.M., Lehman L. — Dose-responseeffect of depot leuprolide acetate on serum androgens in hirsute women.Fertility Steril, 1996; 65: 962-965.
3. Lughetti L., Prediezi B., Ferrari M. et al. — Diagnosis of central precocious puberty: endocrine assessment.J Pediatr Endocrinol Metabol, 2000; 13: 709-715.
4. Choi H.H., Gray P.B., Storer T.W. et al. — Effects of testosterone replacement in human immunodeficiency virus-infected women with weight loss. J Clin Endocrinol Metab. 2005; 90: 15311541.
5. Svartberg J., Jorde R., Sundsford J. et al. — Seasonal variation of testosterone and waist to hip ratio in men: the Troms study J Clin Endocrinol Metab. 2003; 88:3099-3104.
2003; 88:3099-3104.
6. Wall J.R., Jarrett R.J., Zimmet P.Z et al. — Fall in plasma testosterone levels in normal vale subjects in response to an oral glucose load. Lancet, 1973; 1: 967-968.
7. Jeibmann A., Zahedi S., Simoni M. et al. — Glucagon like peptide-1 reduces the pulsatile component of testosterone secretion in healthy males. Eur J Clin Invest 2005; 35: 565-572.
8. Vermeulen A, Kaufman J.M. — Diagnosis of hipogonadism in the aging male. Aging male 2002; 5: 170-176.
9. Sarkova T., Eriksson C.J. — Testosterone increases in men after a low dose of alcohol. Alcohol Clin Exp Res 2003; 682685.
10. Heikkonen E., Vlikahri R., Roine R. et al. — The combine effect of alcohol and physical exercise on serum testosterone, luteinzing hormone and cortisol in males. — Alcohol Clin Exp Res 1996; 20: 711-716.
Heikkonen E., Vlikahri R., Roine R. et al. — The combine effect of alcohol and physical exercise on serum testosterone, luteinzing hormone and cortisol in males. — Alcohol Clin Exp Res 1996; 20: 711-716.
11. Daly W., Seegers C.A., Rubin D.A. et al. — Relationship between stress hormones and testosterone with prolonged endurance exercise. Eur J Appl Physiol, 2005; 93: 375-380.
12. Goncharov N.P. et al. — Effect of stress on the profile of plasma steroids in baboons (papio hamodryas). Acta Endocrinol. (Copench) 1979; 90 (2), 372-384.
13. кация г.В. — Эндокринная функция тестикул у павианов гамадрилов при хроническом психоэмоциональном стрессе. — Бюл Эксп Биол мед. 1984; 97(3): 285-287.
14. Goncharov N.P. et al. — Levels of adrenal and gonad hormones in rhesus monkeys during chronic hipokinesia. — Endocrinology 1984; 115(1): 129-135.
Goncharov N.P. et al. — Levels of adrenal and gonad hormones in rhesus monkeys during chronic hipokinesia. — Endocrinology 1984; 115(1): 129-135.
15. гончаров Н.П. и др. — Характеристика стероидогенеза у обезьян при стрессе; зависимость от пола м возраста. — Вестник Акад мед Наук СССР 1987; 10:88-94.
16. Vermeulen A, Kaufman J.M., Giagulli V.A. — Influence of some biological indexes on sex hormone-binding globulin and androgens levels in aging or obese males. J Clin Endocrinol Metab 1996; 81: 1821-1826.
17. Wheeler M.J. — Factors that affect the interpretation of testosterone results. CPD Clinicfl Biochemistry 2003; 5: 86-90.
18. DPC Technicfl Services department. Immulite/immulite, 1000 total testosterone — manufactures instruction. PILKTW-7, 24-4-2005, Los Angeles, USA.
Immulite/immulite, 1000 total testosterone — manufactures instruction. PILKTW-7, 24-4-2005, Los Angeles, USA.
19. Carruthers M, Trinick TR, Wheeler MJ.The validity of androgen assays.Aging Male 2007 ;10(3):165-72.
20. Taieb J., Mathian B., Millot F. et al. — Testosterone measurement by 10 immunoassays and by isotope-dilution gas chromatographymass spectrometry in sera from 116 men, women and children. Clin chem 2003; 49: 1371-85.
21. Wang C., Catlin D.H., Demers L.M. et al. — Measurement of total serum testosterone in adult men: comparison of current laboratory methods versus liquid chromatography — tandem mass spectrometry. J Clin Endocrinol Metab 2004; 89: 534-543.
22. Sikaris K, McLachlan RI, Kazlauskas R, et al.Reproductive hormone reference intervals for healthy fertile young men: evaluation of automated platform assays.J Clin Endocrinol Metab. 2005;90(11):5928-36.
Sikaris K, McLachlan RI, Kazlauskas R, et al.Reproductive hormone reference intervals for healthy fertile young men: evaluation of automated platform assays.J Clin Endocrinol Metab. 2005;90(11):5928-36.
23. Goncharov N, Katsya G, Dobracheva A. et al. Serum testosterone measurement in men: evaluation of modern immunoassay technologies.Aging Male 2005 ;8(3-4):194-202.
24. Matsumoto A. M,. Bremner W. J.Editorial: Serum Testosterone Assays—Accuracy Matters.J Clin Endocrinol Metab 2004; 89: 520-524,
25. Rosner W, Auchus R, Azziz R. et al. POSITION STATEMENT: Utility, Limitations, and Pitfalls in Measuring Testosterone: An Endocrine Society Position Statement. J Clin Endocrinol Metab 2007; 92: 405-413.
26. Guo T, Taylor RL, Singh RJ, Soldin SJ. et al/ Simultaneous determination of 12 steroids by isotope dilution liquid chromatography-photospray ionization tandem mass spectrometry. Clin. Chemica Acta 2006; 372: 76-82
Guo T, Taylor RL, Singh RJ, Soldin SJ. et al/ Simultaneous determination of 12 steroids by isotope dilution liquid chromatography-photospray ionization tandem mass spectrometry. Clin. Chemica Acta 2006; 372: 76-82
27. Kushnir M., Rockwood AL, Roberts WL et al. Performance Characteristics of a Novel Tandem Mass Spectrometry Assay For Serum Testosterone.Clin. Chem. 2006; 52: 120 128.
28. Vermeulen A., Verdonc K.L., Kaufman J.M. — A critical evaluation of sample methods for the estimation of free testosterone in serum. J Clin Endocrinol Metab; 1999; 84:366672
29. Zhan Sh. Critical review of development, validation and transfer for high throughput bioanalytical LC-MS/ MS methods. Current pharmaceutical analysis, 2005,1,3-14).
30. Schurmeyer T. Nieschlag E. Salivary and serum testosterone under physiological and pharmacological conditions. Ninth Tenovus Workshop—Immunoassays of Steroids in Saliva 1982;202-209 Alpha Omega Cardiff, Wal
31. Ekins R.The free hormone hypothesis and measurement of free hormones.Clin Chem. 1992 ;38(7):1289-93.
32. Obminski Z. Changes in the free ( unboud) fraction of testosterone in serum in vitro as affected by pH and temperature. Exp. Clin. Endocri. Diabetes 1998; 106:85-88.
33. Kley H.K., Bartmann E., Kruske,per HL. A simple and rapid method to measure non-protein bound fractions of cortisol, testosterone and estradiol by eqilibrium dialysis: comparison with centrifugal filtration. Acta Endocrin.1977; 85:212-219.
Acta Endocrin.1977; 85:212-219.
34. Hammond G.L., Nikser J.A.,Jones L.A. Sitteri R.K. Estimation of the percentage of free steroids in undiluted serum by centrofugal ultrafiltration — dialisys. J. Biol. Chem.1980;255:5023-26
35. Rosner W. Errors in the measurement of plasma free testosterone. J.Clin. Endocrinol.Metab 1997; 82: 2014—5)
36. Stockl D., Franzini C, Kratochvila J,et al. Analytical specifications of reference methods compilation and critical discussion (from the members of the European EQA-Organizers Working Group B). Eur. J. Clin. Chem. Clin. biochem. 1996;34: 319-37
37. Van Uytfanghe K, Stöckl D, Kaufman JM et al.Evaluation of a Candidate Reference Measurement Procedure for Serum Free Testosterone Based on Ultrafiltration and Isotope Dilution—Gas Chromatography—Mass Spectrometry. Clin. Chem.2004; 50: 2101 2110.
Clin. Chem.2004; 50: 2101 2110.
38. Vermeulen A, Kaufman JM. Ageing of the hypothalamopituitary-testicular axis in men. Horm Res. 1995;43(1-3):25-8. Review.
39. Rosner W. Measurement of free testosterone in Serum by DPC or DSL RIA — An Extraordinarily Inaccurate Assay for Free testosterone Is Still with Us. J.Clin. Endocrinol.Metab 2001;86(6): 2903-05.
40. Aldrecht S., Zimmermann T., Brandl H. et al. // Chemiluminescence at the turn of the millenium — from annual fair curiosity to indispensable tool of laboratory diagnostics. J Lab Med 1997;21: 191 — 204.
41. Goncharov N., Katsya G., Dobracheva A. et al. — Diagnostic significance of free salivary testosterone measurement using a direct luminescence immunoassay in healthy men and in patients with disorders of androgen status. — The Aging Male 2006; 9: 111-122.
— The Aging Male 2006; 9: 111-122.
42. гончаров Н.П., кация г.В., Добрачева А.Д. и др. — Диагностическая значимость определения общего тестостерона в сыворотке и свободного биологически активного тестостерона в слюне. Пробл эндокринол 2007; 3: 30-35.
Андрогенный дефицит и проблемы его диагностики современными неизотопными методами определения тестостерона | Гончаров
Во второй половине прошлого века произошла технологическая революция в методах определения гормонов и других биологически активных соединений. Ее обеспечило открытие технологии радиоиммуноанализа (РИА). Разработка методов получения высокоспецифичных поликлональных, а позже моноклональных антисывороток к различным низкомолекулярным лигандам позволила использовать методы РИА не только в эндокринологии, но и в фармакологии, физиологии и других областях медицины.
В РИА-методах для стероидных гормонов на преаналитическом этапе использовалась их экстракция из биологического материала соответствующими органическими растворителями. А в необходимых случаях проводилось хроматографическое выделение стероидов. Использование в РИА-методах изотопной метки создавало определенные трудности в их эксплуатации, включая экологические. Поэтому академические лаборатории и коммерческие компании создали неизотопные методы иммуноанализа, включая имму- ноферментные (ИФА) методы, затем методы второго и третьего поколения с высокой разрешающей способностью, где применялись люминесцентная и флюоресцентная метки.
Переход на автоматизированные системы иммуноанализа обеспечивал высокую производительность, что в комбинации с оперативностью получения результатов сделало их экспресс-методами в диагностике эндокринных нарушений. Однако по мере их эксплуатации и накопления полученных данных возникли проблемы, прежде всего для группы близкородственных по химической структуре стероидных гормонов. В последние 5 лет опубликована целая серия оригинальных работ, в которых доказана неадекватность определения в крови общей циркуляции таких гормонов, как тестостерон (Т), эстрадиол, и других стероидов прямыми неэкстракционными методами, включая практически все используемые анализаторы с их химической составляющей. Как правило, они принципиально завышают концентрацию гормона, что входит в противоречие с клиническими проявлениями заболевания.
В последние 5 лет опубликована целая серия оригинальных работ, в которых доказана неадекватность определения в крови общей циркуляции таких гормонов, как тестостерон (Т), эстрадиол, и других стероидов прямыми неэкстракционными методами, включая практически все используемые анализаторы с их химической составляющей. Как правило, они принципиально завышают концентрацию гормона, что входит в противоречие с клиническими проявлениями заболевания.
Более того, практика быстрого получения результатов из лаборатории, не гарантирующая (все выполняет автомат) правильности определения гормонов, приводит к ослаблению анализа клинических проявлений заболевания, а во многих случаях и к неправильному лечению. Итогом многочисленных обсуждений этой проблемы международным сообществом было официальное заявление Международной ассоциации эндокринологов в 2007 г. [27] о недопустимости использования прямых методов иммуноанализа, включая все анализаторы, для определения Т у женщин и детей. В настоящее время крупные лаборатории США и Европы применяют для определения Т и других стероидов высокочувствительную и высокоточную технологию тандем-масс-спектрометрии (TD-MS). Для этой цели рекомендуются масс-спектрометры фирмы «АРГ-3000/5000 или фирмы «Waters/Micromass Quattro».
Для этой цели рекомендуются масс-спектрометры фирмы «АРГ-3000/5000 или фирмы «Waters/Micromass Quattro».
Диагностика гипогонадизма у мужчин по уровню Т, особенно возрастного дефицита Т с использованием анализаторов, должна быть прежде всего тщательно соотнесена с его клиническими проявлениями. В представленной работе наряду с обсуждением обозначенной проблемы отражен также собственный опыт авторов и даны методические разработки для улучшения диагностики андрогенного дисбаланса по уровню свободного тестостерона (св. Т).
Т — основной гормон мужского организма. Главные его биологические функции — развитие, формирование и обеспечение мужского фенотипа и сперматогенеза. У женщин Т обеспечивает рост, метаболизм костной ткани, ее ремоделирование и поддержание анаболических процессов, особенно в мышечной ткани.
Высокочувствительный и специфический метод определения Т необходим для диагностики многих клинических состояний. Как известно, концентрация Т в крови у женщин низкая и не превышает 7% от его содержания в крови взрослых мужчин. Аналогичная ситуация характерна и для детей, что значительно затрудняет количественное определение Т. Вместе с тем оценка андрогенного статуса у женщин необходима при широком спектре клинических симптомов и патологических состояний, например таких, как гирсутизм, акне, алопеция, ан- дрогенсекретирующие опухоли яичников и надпочечников. Его определение также очень важно для выбора минимальной дозы, необходимой для подавления продукции андрогенов у женщин с гипер- андрогенией [6, 21, 24, 39]. У детей точное количественное определение Т необходимо для установления половой принадлежности новорожденного с необычными, измененными гениталиями, а также для динамического наблюдения за детьми с задержкой пубертата и преждевременным половым развитием. Динамический мониторинг уровня Т требуется пациентам с выявленной врожденной дисфункцией коры надпочечников (ВДКН) вследствие дефицита 21-гидроксилазы и некоторых других ферментных систем стероидогенеза. Мониторинг за уровнем Т необходим также при проведении антиандрогенной терапии определенных форм дисгормонального рака и, в частности, при лечении рака предстательной железы пролонгированными препаратами люлиберина (фармакологическая кастрация; широко используется в настоящее время).
Аналогичная ситуация характерна и для детей, что значительно затрудняет количественное определение Т. Вместе с тем оценка андрогенного статуса у женщин необходима при широком спектре клинических симптомов и патологических состояний, например таких, как гирсутизм, акне, алопеция, ан- дрогенсекретирующие опухоли яичников и надпочечников. Его определение также очень важно для выбора минимальной дозы, необходимой для подавления продукции андрогенов у женщин с гипер- андрогенией [6, 21, 24, 39]. У детей точное количественное определение Т необходимо для установления половой принадлежности новорожденного с необычными, измененными гениталиями, а также для динамического наблюдения за детьми с задержкой пубертата и преждевременным половым развитием. Динамический мониторинг уровня Т требуется пациентам с выявленной врожденной дисфункцией коры надпочечников (ВДКН) вследствие дефицита 21-гидроксилазы и некоторых других ферментных систем стероидогенеза. Мониторинг за уровнем Т необходим также при проведении антиандрогенной терапии определенных форм дисгормонального рака и, в частности, при лечении рака предстательной железы пролонгированными препаратами люлиберина (фармакологическая кастрация; широко используется в настоящее время). Точное количественное определение Т необходимо для диагностики распространенного возрастного андрогенного дефицита (прежнее название PADAM). Сниженный уровень общего тестостерона (об. Т) у мужчин в возрасте 40—60 лет регистрируется в 7% случаев, а в возрасте 60—80 лет — в 21% случаев.
Точное количественное определение Т необходимо для диагностики распространенного возрастного андрогенного дефицита (прежнее название PADAM). Сниженный уровень общего тестостерона (об. Т) у мужчин в возрасте 40—60 лет регистрируется в 7% случаев, а в возрасте 60—80 лет — в 21% случаев.
Преаналитические факторы, влияющие на уровень тестостерона
Сезонные колебания уровня Т. По данным J. Svar- tberg и соавт. [32], сезонные колебания концентрации об. Т достигают 19%, а свободного — 31%. Наиболее низкие концентрации регистрируются летом, пиковые — осенью. Они также зависят от региона проживания. Приведенную разницу в уровнях, естественно, необходимо учитывать при выполнении продолжительных исследований.
Суточные колебания. Как известно, 50—60% об. Т с высокой аффинностью связано с секс-стероид- связывающим глобулином (СССГ), а 40—50% — с альбумином (легко диссоциирующая связь). Только 1—2% Т циркулирует в свободной форме (св. Т) и вместе со связанным с альбумином Т они обозначаются как биодоступный Т (био. Т). Суточные колебания био. Т достигают 57%, св. Т — 68%, тогда как колебания об. Т составляют 45%. Данный процесс обусловлен увеличением синтеза Т в ночное время с одновременным снижением связывающих белков вследствие особенностей гемодинамики организма в горизонтальном положении. С возрастом выраженный суточный ритм сглаживается, что также необходимо учитывать при выборке протокола клинических исследований [32].
Т). Суточные колебания био. Т достигают 57%, св. Т — 68%, тогда как колебания об. Т составляют 45%. Данный процесс обусловлен увеличением синтеза Т в ночное время с одновременным снижением связывающих белков вследствие особенностей гемодинамики организма в горизонтальном положении. С возрастом выраженный суточный ритм сглаживается, что также необходимо учитывать при выборке протокола клинических исследований [32].
Диета. Содержание Т во многом определяется временем приема пищи и ее составом. В большинстве проводимых или опубликованных работах этот фактор не учитывается. Взятие крови натощак или после легкого завтрака может существенно влиять на результаты определения Т. Еще в 1973 г. была опубликована работа, в которой зарегистрировано падение уровня Т в крови у здоровых мужчин после перорального приема глюкозы [40]. Позднее, при проведении глюкозотолерантного теста, наблюдалось падение концентрации об. Т на 15% через 30 мин, которое сохранялось на протяжении последующих 3 ч [18]. Причем зарегистрированное падение было не связано со снижением сигнала со стороны ЛГ, а обусловлено выбросом в кровь глюкагоноподобного пептида-1 (GLP-1), который уменьшает импульсную продукцию Т. Наиболее важный эффект диеты — изменение содержания СССГ, концентрация которого снижается при большом потреблении белка, жирной пищи и, наоборот, повышается при приеме вегетарианской пищи и диете, богатой клетчаткой [18]. Большое содержание свободных жирных кислот нарушает процесс связывания половых стероидов с СССГ, что сказывается на уровне св. Т [38].
Причем зарегистрированное падение было не связано со снижением сигнала со стороны ЛГ, а обусловлено выбросом в кровь глюкагоноподобного пептида-1 (GLP-1), который уменьшает импульсную продукцию Т. Наиболее важный эффект диеты — изменение содержания СССГ, концентрация которого снижается при большом потреблении белка, жирной пищи и, наоборот, повышается при приеме вегетарианской пищи и диете, богатой клетчаткой [18]. Большое содержание свободных жирных кислот нарушает процесс связывания половых стероидов с СССГ, что сказывается на уровне св. Т [38].
Алкоголь. В небольшой дозе алкоголь повышает уровень Т в крови на 20% у мужчин [28] и у женщин [16]. Хроническое злоупотребление алкоголем приводит к необратимым деструктивным изменениям клеток Лейдига и клеток Сертоли семенников, к развитию ожирения, повышению уровня эстрогенов, в результате формирует необратимый дефицит андрогенов в комбинации с эректильной дисфункцией.
Физическая активность. Чрезмерные физические нагрузки, например у молодых спортсменов, приводят к падению уровня как об. Т, так и св. Т [7].
Т, так и св. Т [7].
Психосоматическое состояние организма. Стресс, как физический, так и психоэмоциональный, приводит к подавлению продукции Т через центральные механизмы — гипоталамус—аденогипофиз— гонадотропины. Кроме того, повышенный выброс кортизола ингибирует стероидогенез в клетках Лейдига [1, 3, 10, 11].
Сексуальная активность. Уровень как об. Т, так и св. Т повышается в процессе интимных отношений у обоих партнеров, мастурбация также сопровождается увеличением концентрации циркулирующего Т.
Курение. У курильщиков уровень об. Т и св. Т возрастает на 5—15% [36].
Преаналитический этап, связанный с получением проб крови и ее обработкой.
Сравнительно недавно экспериментально была четко обоснована схема получения сыворотки для последующего определения Т: отделение сыворотки от форменных элементов должно проходить в течение 6 ч при комнатной температуре или пробы крови могут храниться при 4°С до 48 ч, а затем их необходимо центрифугировать. Пробы сыворотки можно хранить при — 20°С в течение 3 мес, а при —70°С больше 6 мес. Более продолжительное хранение проб сыворотки не гарантирует правильного определения концентрации Т, так как за это время может измениться сама технология определения гормона. Недопустимы также повторное замораживание и размораживание проб сыворотки, которые приводят к деструкции СССГ и неправильному определению уровня св. Т и био. Т. В случае определения Т с помощью экстракционного РИА-метода использование сыворотки или плазмы не имеет принципиального значения. Однако при применении неизотопных прямых методов исследования, включая автоматические анализаторы, необходимо использовать только сыворотку, так как в плазме определяется заниженная концентрация Т [8, 42]. Использование ЭДТА или цитрата для получения плазмы недопустимо для всех методов. Забор крови в стеклянные или пластиковые пробирки для получения сыворотки не влияет на результаты определения Т. Однако при использовании гелевого разделяющего компонента, что имеет место в вакуумтейнерах для взятия крови, происходит завышение результатов для об. Т до 28%, занижение уровня ФСГ на 43%, завышение общего Т3 на 58%, Т4 — на 34%. При одних и тех же ваккумтей- нерах разные анализаторы могут генерировать различные результаты при определении того или иного гормона. Более подробно влияние различных экзогенных и эндогенных факторов на уровень об. Т изложены в цитируемой работе [5].
Проблемы иммуноанализа тестостерона автоматизированными системами
Начиная с конца 60-х годов прошлого века основным методом определения об. Т в сыворотке являлся РИА-метод с предварительной экстракцией его этиловым эфиром. Он принципиально изменил возможности диагностики различных форм андрогенного дефицита. Однако использование радиоактивной метки в методах РИА создавало целый ряд проблем для гормональных лабораторий.
Наиболее популярной альтернативой РИА-методам стало развитие ИФА, где в качестве меченого компонента используется пероксидаза хрена, щелочная фосфатаза и др. Несколько позднее были созданы флюоресцентные методы (меченый компонент — европий), метод усиленной люминесценции (меченый компонент — люминол или акридин).
В настоящее время широко используются автоматизированные высокопроизводительные системы определения самых разных гормонов, включая Т. Многие коммерческие диагностические компании используют технологии люминесцентного анализа с регистрацией усиленного люминесцентного сигнала. Все вышеназванные неизотопные методы являются «прямыми», т. е. определение об. Т проводится непосредственно в сыворотке, без предварительной экстракции его органическими растворителями, что увеличивает возможность одновременного определения и других стероидов, близких по химической структуре к молекуле Т.
Проведенный в последнее время целенаправленный анализ результатов определения Т в сыворотке крови с помощью автоматизированных систем по сравнению с референсным методом масс- спектрометрии показал наличие систематической ошибки анализаторов как в сторону завышения (в большинстве случаев), так и в сторону занижения уровня Т. В частности, обстоятельную работу опубликовали французские авторы [33], в ней проведена сравнительная характеристика 10 анализаторов с референсным методом масс-спектрометрии. Вывод авторов: использование вышеуказанной технологии прямых методов неприемлемо для определения низких концентраций Т у женщин и детей. Аналогичные результаты также опубликованы авторитетной группой авторов из США [41] и группой австралийских ученых [30]. Все авторы приходят к выводу о неприемлемости технологии прямых методов, включая ELISA, для определения низких концентраций Т, у мужчин и особенно у женщин и детей [17].
Аналогичные результаты были получены нами при сравнении 4 автоматизированных систем со стандартизированным РИА-методом [12]. Неприемлемое завышение результатов у мужчин было получено при определении концентрации об. Т ниже 10 нмоль/л (рис. 1). В результате принципиально снижается процент (до 20) выявления дефицита андрогенов, который, возможно, требует заместительной коррекции препаратами Т (рис. 2).
В 2004 г. в журнале «JCEM» была опубликована редакционная статья с аналогичными заключениями [22]. И, наконец, в начале 2007 г. напечатано официальное заявление Международной ассоциации эндокринологов о недопустимости использования прямых неэкстракционных методов для определения об. Т у женщин и детей, поскольку это
Рис. 1. Различия (в %) между концентрацией Т (медиана), полученной РИА- и неизотопными методами у мужчин с содержанием Т (по РИА) < 10 нмоль/л.
ведет к ошибкам в диагностике с последующим назначением неправильного лечения [27].
Методы масс-спектрометрии и их возможности
Любой из существующих методов иммуноанализа требует при его конструкции технологических разработок для каждого индивидуального гормона, включая основные компоненты, моноклональные антитела, с высокой специфичностью и чувствительностью. Особую сложность при создании тест- систем представляет класс стероидных гормонов и их активных метаболитов по химической структуре, многие из которых циркулируют в крови в очень низких концентрациях. Каждая диагностическая компания конструирует свой вариант метода, что затрудняет стандартизацию. Это одна из причин расхождения в результатах определения гормонов.
Появление и развитие современной технологии масс-спектрометрии в тандеме с высокоразрешающим жидкостным хроматографом, обеспечивающей высокую производительность, практически 100% специфичность, необходимую чувствительность и воспроизводимость, открывают новую эру в биохимии стероидов. В отличие от прежнего, технологически трудоемкого, комплекса газовый хро- матограф/масс-спектрометр (GCMS), современная тандем-масс-спектрометрия (TD-MS) не требуют трудоемкой процедуры подготовки исследуемого биологического материала. При наличии подготовленного специалиста TD-MS может быть использована и уже используется в развитых странах для рутинной диагностики в эндокринологических лабораториях. Сравнительно недавно группа авторов из США [14] опубликовала блестящую работу, в которой продемонстрированы возможности технологии TD-MS с использованием масс-спектрометра API-3000 одновременно определять за 11 мин в 0,2 мл сыворотки 12 основных стероидных гормонов: ДГЭА-С, альдостерон, кортизол, кортикостерон, 11-дезоксикортизол, андростендион, эстрадиол, Т, 17-гидроксипрогестерон, ДГЭА, прогестерон и 25-гидроксивитамин D. Четкое разделение близких по химической структуре стероидов с помощью газо-жидкостной хроматографии под высоким давлением (HPLC) было достигнуто всего за 11 мин. Продемонстрирована высокая надежность метода. Технология TD-MS высокопроизводительна и экономична по сравнению с современными автоматическими анализаторами, которые требуют больших затрат на постоянное приобретение дополнительных расходных материалов (Китов). В методе TD- MS расходные материалы сведены к минимуму. По всем вышеназванным параметрам MS-технология ближайшего будущего в гормональном анализе. Один подготовленный оператор может выполнять до 200 тестов в день. В настоящее время TD-MS получает широкое распространение, прежде всего в США для рутинной диагностики в эндокринологических лабораториях и прежде всего для определения основного спектра С21-, С19- и С18-стерои- дов, а также их многочисленных метаболитов. Уже в настоящее время в разных странах при выполнении скрининговых программ на выявление ВДКН у новорожденных с использованием в качестве маркера 17-альфа-гидроксипрогестерона метод TD-MS (API-3000) незаменим. Он выступает в качестве «арбитра» при наличии ложноположительных результатов, неизбежных при определении в кровяном пятне 17-альфа-гидроксипрогестерона методом флюоресцентного иммуноанализа (Дель- фия). При скрининге на каждый истинный случай ВДКН приходится до 200 ложноположительных результатов, которые требуют внесения ясности с использованием MS — API-3000.
В статье до кт. М. Kushnir и соавт. [20] представлен опыт использования метода TD-MS для определения низких концентраций Т у женщин и детей. По основным параметрам (чувствительность и специфичность) метод является высоконадежным и адекватным для оценки андрогенного баланса, практически исключает эффект матрикса, присущий всем прямым методам иммуноанализа автоматизированных систем. В приведенных табл. 1 и 2 авторы определяют физиологические колебания об. Т в зависимости от возраста мужчин и женщин
Рис. 2. Частота выявления андрогенного дефицита у 100 обследованных мужчин при сравнении с показателями Т, определенными РИА (1-я группа), и при использовании нормативов, указанных в инструкциях (2-я группа).
Таблица 1
Девочки: | |||||
TS 1 | 147 | 25-144 | < 0,588 | < 7,63 | 0,010-0,190 |
TS 2 | 66 | 13-106 | 0,138-1,35 | 1,39-15,61 | 0,042-0,519 |
TS 3 | 85 | 10-82 | 0,346-2,07 | 4,51-26,02 | 0,131-0,969 |
TS 4 | 77 | 12-147 | 0,277-2,18 | 3,82-53,78 | 0,097-1,35 |
TS 5 | 123 | 15-150 | 0,346-2,07 | 2,77-31,92 | 0,076-0,796 |
Мальчики: | |||||
TS 1 | 143 | 21-144 | < 0,657 | < 12,84 | 0,0104-0,450 |
TS 2 | 66 | 18-141 | 0,069-5,16 | 1,04-72,87 | 0,010-2,04 |
TS 3 | 65 | 11-87 | 0,242-26,37 | 3,47-339,95 | 0,066-10,24 |
TS4 | 98 | 9-50 | 5,71-29,54 | 121-586,24 | 1,38-16,78 |
TS 5 | 42 | 9-59 | 6,71-27,09 | 142-829,06 | 4,29-20,62 |
Содержание СССГ, об. Т, св. Т и био. Т у детей
Стадия по | п | СССГ, | Об. Т, | Св. Т, | Био. Т, |
Таннеру | нмоль/л | нмоль/л | пмоль/л | нмоль/л |
с использованием оптимальной выборки. Данные по содержанию св. Т. рассчитаны с использованием математической модели [37].
Приведенные показатели об. Т для мужчин молодого и среднего возраста, полученные методом TD-MS, противоречат общепринятым критериям нижней границы нормы, которая составляет 11 нмоль/л. Возможно, это связано с малой выборкой для данных возрастных групп. Вместе с тем величина пограничной точки отсчета норма -> дефицит Т остается открытым и дискуссионным.
В большой обзорной статье изложены достоинства, преимущества, надежность, реальные трудности и проблемы при использовании высокотехнологичного биоаналитического метода, каким является масс-спектрометрия в тандеме с высокоразрешающей жидкостной хроматографией [43].
Свободный тестостерон
Как указывалось выше, Т циркулирует в крови в комплексе со специфическим транспортным глобулином (СССГ) и неспецифическим белком альбумином, который имеет низкую аффинность, но большую емкость за счет высокой концентрации в крови. И только 1—2% Т циркулирует в крови в свободном виде. Константа ассоциации Т, связанная с СССГ, высокая (109 л/моль), тогда как с альбумином она намного ниже (3,6 • 104 л/моль). Приведенные параметры детерминируют и скорость диссоциации Т: с СССГ — около 20 с, а с альбумином — около 1 с, что определяет его биодоступность к тканям-мишеням при прохождении через стенку капилляра. Св. Т и связанный с альбумином Т обозначают как биологически активную форму гормона (био. Т).
Вопрос о биологической роли комплекса Т с СССГ остается открытым, большинство исследователей рассматривают его как буферную систему, препятствующую быстрой деградации Т в печени, а некоторые авторы допускают его биологическое негеномное действие через мембранные рецепторы клетки [29].
Соотношение между свободным и связанным с белками Т в физиологических условиях поддерживается на постоянном уровне. Однако при целом ряде патофизиологических ситуаций оно нарушается, прежде всего за счет изменения концентрации основного специфического транспорта белка СССГ. Стандартное обследование больного с подозрением на дефицит андрогенов начинается с определения об. Т, поэтому неизбежны ошибки в интерпретации полученных результатов, так как остается открытым вопрос о содержании св. Т и био. Т, которые определяют андрогенный статус пациента.
Биологическая значимость СССГ до настоящего времени до конца не раскрыта. Например, он продуцируется в печени только приматов (низших и человекообразных обезьян и человека). Его уровень не подчиняется суточному ритму, тогда как для уровня Т характерен такой ритм.
Поскольку концентрация циркулирующего СССГ влияет на содержание об. Т и св. Т и их соотношение, то необходимо помнить о наиболее значимых факторах, изменяющих содержание СССГ. Эндогенные и экзогенные эстрогены повышают его концентрацию, а андрогены, наоборот, снижают. Гормоны щитовидной железы увеличивают его продукцию, а при их недостатке концентрация циркулирующего СССГ уменьшается. Его содержание в крови детей выше, чем у взрослых. У мужчин старше 50 лет концентрация СССГ нарастает, в связи с этим снижается доля свободного биологически активного Т, усугубляя формирование возрастного гипогонадизма.
Согласно теории о свободных формах циркулирующих в крови гормонов, уровень св. Т отражает андрогенный статус более адекватно, чем содержание в крови об. Т [9]. Именно поэтому идентификация адекватных аналитических методов определения св. Т обеспечила бы наиболее оптимальную диагностику андрогенного статуса пациента. Комплекс св. Т/об. Т — термодинамическая система, в которой свободная фракция гормона зависит от концентрации как об. Т, так и связывающих бел-
Таблица 2
Содержание СССГ, об. Т, св. Т и био. Т в сыворотке у детей и взрослых разных возрастных групп
Возраст, годы | п | СССГ, нмоль/л | Об. Т, нмоль/л | Св. Т, пмоль/л | Био. Т, нмоль/л |
Женщины | |||||
7-9 | 103 | 31-143 | < 0,519 | < 6,25 | 0,0104 |
10-11 | 69 | 15-145 | 0,069-1,45 | 0,347-12,140,014-0,332 | |
12-13 | 69 | 10-108 | 0,208-2,21 | 3,12-23,60 | 0,059-0,650 |
14-15 | 70 | 11-106 | 0,311-1,70 | 4,16-26,02 | 0,104-0,990 |
16-17 | 70 | 16-160 | 0,277-2,18 | 4,16-34,35 | 0,114-0,990 |
18-30 | 55 | 18-203 | 0,381-2,04 | 2,78-25,68 | 0,076-0,713 |
31-40 | 43 | 20-126 | 0,381-1,90 | 4,51-31,92 | 0,142-0,882 |
41-51 | 18 | 26-110 | 0,311-1,9 | 3,82-20,13 | 0,097-0,571 |
50-62 (ме- | |||||
нопауза) | 16 | 18-97 | 0,208-0,865 | 2,08-13,19 | 0,052-0,325 |
Мужчины | |||||
7-9 | 105 | 24-170 | < 0,311 | < 3,12 | 0,010-0,097 |
10-11 | 68 | 20-133 | 0,069-1,97 | 0,35-21,86 | 0,003-0,619 |
12-13 | 69 | 15-114 | 0,242-25,85 | 1,73-340 | 0,048-9,96 |
14-15 | 70 | 8-71 | 1,14-20,24 | 10,41-479 | 0,329-11,66 |
16-17 | 70 | 8-50 | 6,40-30,66 | 132-600 | 1,21-17,61 |
18-30 | 20 | 8-54 | 6,88-27,13 | 236-770 | 5,85-19,10 |
31-52 | 19 | 12-49 | 7,58-22,35 | 194-489 | 4,81-12,25 |
ков, а также от уровня ассоциации и диссоциации комплекса, что в свою очередь определяется температурой и pH [23]. Традиционно отделение св. Т от Т, связанного с белками, проводят методом равновесного диализа или методом ультрафильтрации (УФ), который появился позднее. При этом необходим ультрачувствительный и высокоспецифичный метод определения низкой концентрации св. Т в фильтрате.
Технология УФ, которая была предложена рядом авторов, действительно позволяет точно выделить свободную форму Т и других стероидов [15, 19]. Однако доступная в то время технология РИА не позволяла определять низкие концентрации св. Т с достаточной степенью точности.
В частности G. Hammond и соавт. [15] приводят результаты определения свободных стероидов (в % от общей фракции) с использованием комбинации УФ с диализом: у мужчин — эстрадиол 2,4, Т 1,97, прогестерон 2,76; у женщин в фолликулярной фазе эстрадиол 1,57, Т 0,9, прогестерон 2,85, в латентной фазе эстрадиол 1,52, Т 0,85, прогестерон 2,54.
Позже коммерческие диагностические компании разработали прямой безэкстракционный метод определения св. Т в сыворотке, который используется в ряде эндокринологических лабораторий, несмотря на обоснованные и аргументированные заявления о недопустимости его применения для оценки андрогенного статуса [25].
Долгое время метод равновесного диализа для определения св. Т и других стероидов рассматривался как «золотой стандарт». Однако с 2003 г. Европейский комитет по стандартизации диагностических систем и их компонентов принял решение о замене термина «золотой стандарт» определением «референсная измерительная процедура» (RMP). Для стероидных гормонов должна быть использована в качестве референсного метода TD-MS [31]. Принцип данного метода гарантирует точность, специфичность и снижение эффекта матрикса при количественном измерении Т или любого другого стероида. А для разделения комплекса об. Т/св. Т предложено использовать технологию УФ или равновесного диализа. Группа авторов, выполнив большое сравнительное исследование, рекомендовала использовать в качестве метода, разделяющего св. Т/об. Т, прямую, более простую технологию УФ вместо диализа с последующим количественным измерением концентрации св. Т референсным методом масс-спектрометрии [34]. При такой комбинации методов содержание св. Т в сыворотке мужчин составляло 1,8% от об. Т, а при использовании диализа 2,2%.
Определение свободного тестостерона в слюне
Неудовлетворительные и зачастую неприемлемые результаты определения об. Т автоматизированными системами послужили для нас основанием поиска альтернативных технологий и прежде всего прямого и доступного метода определения св. Т, как наиболее адекватного маркера андрогенного статуса как у мужчин, так и у женщин.
Однако прямое определение св. Т в крови сопряжено с технологическими трудностями, поэтому мы обратились к альтернативной биологической жидкости — слюне, куда поступают только свободные формы стероидов, включая Т.
Слюна как биологическая жидкость привлекла внимание исследователей почти 50 лет назад, так как слюнные железы обладают особенным свойством: в слюнной проток проникают соединения только с низкой молекулярной массой (< 400 Д), к которым относится и Т, не связанный с альбумином и специфическим глобулином. Концентрация жирорастворимых свободных стероидов, таких как Т, не зависит от скорости выделения слюны и соответствует уровню несвязанной формы стероида в сыворотке крови [35]. Если измерить адекватными методами концентрацию св. Т, который доступен тканям-мишениям и оказывает свое биологическое действие в этой форме, то его уровень в слюне мог бы стать идеальным маркером для определения андрогенного статуса как у мужчин, так и у женщин и детей, у которых уровень Т во много раз ниже.
Сбор слюны прост, не инвазивен и имеет большие преимущества перед традиционными методами определения стероидов в венозной крови, взятие которой требует квалифицированного персонала и само по себе является добавочным стрессор- ным фактором, способным искажать показатели гормонального статуса.
Необходимо отметить, что в процессе развития методов гормонального анализа неоднократно предпринимались попытки использования слюны в качестве биологической среды для диагностики гормональных нарушений. Однако РИА-методы, а в последующем и традиционные иммунофермент- ные методы не обеспечивали достаточной чувствительности, необходимой для определения низких концентраций свободных стероидов в слюне. Поэтому для анализа были необходимы большие объемы слюны (до 3 мл), после сбора слюны следовала процедура экстракции диэтиловым эфиром, который является огне- и взрывоопасным растворителем. В результате такую технологию было сложно адаптировать для рутинного использования в гормональных лабораториях для клинической диагностики.
Таблица 3
Характеристика исследуемых групп (медиана и 10/90-й процентили)
Группы мужчин | п | Возраст, годы | Об. T, нмоль/л | СССГ, нмоль/л | Вычисленный св. Т, пмоль/л |
Здоровые | 35 | 38 (25-52) | 18,8 (12,4-26,1) | 36,1 (21-54) | 374 (225-544) |
С андрогенным дефицитом | 30 | 35 (21-54) | 6,7 (1,2-10,8) | 33,0 (14,7-104,1) | 135 (9,3-215) |
Р | 0,2242 | 0,0002 | 0,3958 | 0,0002 |
пмоль/л
700-1
600-
500-
400-
300-
200-
100-
————————— 1—————————
День Вечер
0-I——————
Утро
Рис. 3. Суточная динамика св. Т в слюне у здоровых мужчин.
- — медиана, достоверность различий между угром и вечером р — 0,0012, между днем и вечером — р = 0,0006.
Диагностические наборы для прямого измерения свободных стероидов, в особенности в крови, пока не пригодны для диагностического исследования и могут использоваться лишь в научных целях [26, 33]. Как известно, группой A. Vermeulen [37] предложена формула для расчета концентрации св. Т на основе определения об. Т и СССГ в крови. В этом случае корректное определение концентрации св. Т в крови основано на четком знании истинной концентрации об. Т. Реально это непростая проблема, так как современные автоматизированные технологии для измерения об. Т дают совершенно разные результаты [12, 30, 33, 41]. Кроме того, требуется также оптимальный метод для определения СССГ, что значительно повышает стоимость вычисления концентрации св. Т.
Лишь появление современной технологии иммуноанализа, основанной на усиленной хемолюминесценции [4], сочетающей ультрачувствительность и высокую специфичность, сделало возможным определение свободных, не связанных с белками, стероидных гормонов в очень малых объемах слюны прямым методом (без экстракции). Высокая аналитическая (6,2 пмоль/л) и функциональная (17,3 пмоль/л) чувствительность позволяет количественно определять очень низкие (2—3 пг в пробе) концентрации Т в слюне, что особенно важно для диагностики андрогенного статуса у женщин и детей.
В наших исследованиях [2, 13] показано, что концентрация св. Т в слюне хорошо коррелирует и отражает концентрацию несвязанного Т в крови и является дополнительным существенным диагностическим критерием для определения андрогенного статуса мужчин. Были обследованы 35 здоровых мужчин в возрасте 21 года—57 лет и 30 мужчин с различными формами андрогенной недостаточности в возрасте 22 года—68 лет. Один пациент транссексуал-женщина (женщина -> мужчина) — сбор слюны осуществлялся утром до и после внутримышечного введения сустанона.
Процедура сбора слюны
Чтобы исследовать колебания концентрации Т, 3 порции слюны собирали в течение 1 ч трижды в день. Порции слюны собирали по следующей схеме: образец 1 — в 8 ч 30 мин; образец 2 — в 9 ч; образец 3 — в 9 ч 30 мин; образец 4 — в 15 ч 30 мин; образец 5 — в 16 ч; образец 6 — в 16 ч 30 мин; образец 7 — в 22 ч; образец 8 — в 22 ч 30 мин; образец 9 — в 23 ч.
Наш опыт показал, что правильный сбор слюны — ключевой момент в достижении точных и воспроизводимых результатов измерения св. Т. Для этого мы разработали детальную процедуру сбора слюны.
Образцы слюны необходимо собирать в специальные контейнеры (SaliCaps®, IBL) с трубочкой, изготовленные из материала, который не сорбирует стероиды. Слюна должна быть собрана не менее чем через 30 мин после еды, питья, чистки зубов или жевания жвачки. Требовалось примерно 2 мин, чтобы собрать необходимое количество слюны (0,6—0,8 мл). Образцы с небольшим окрашиванием из-за контаминации кровью необходимо исключить. Все образцы были помечены специальным маркером (имя пациента, дата, время). Собранная слюна могла храниться до 5 дней при 20°С, 10 дней при 2—8°С и 6 мес и более при —20°С. Св. Т измеряли в 50 мкл слюны в дубликатах.
Ниже приведены некоторые приемы для быстрого и простого сбора слюны:
- При сборе слюны не рекомендуется делать перерыв и удалять трубочку изо рта и/или из пробирки.
- Сбор слюны становится легче, если вы слегка сжимаете зубами верхний конец трубочки.
- Рекомендуется собирать слюну перед зеркалом, чтобы контролировать процесс наполнения пробирки.
Параллельно проводили определение содержания об. Т и СССГ в сыворотке крови.
Таблица 4
Суточная динамика св. Т в слюне (в пмоль/л) у здоровых мужчин и мужчин с андрогенным дефицитом (медиана и 10—90-й процентили)
Время сбора слюны, ч
мужчин | 8.30 | 9.00 | 9.30 | 15.00 | 15.30 | 16.00 | 22.00 | 22.30 | 23.00 |
Здоровые | 371 | 364 | 374 | 322 | 329 | 288 | 212 | 295 | 343 |
С андроген- | (260-562) | (277-531) | (263-541) | (225-502) | (208-440) | (225-440) | (146-423) | (222-430) | (164-475) |
ным дефи- | 205 | 209 | 218 | 201 | 240 | 169 | 131 | 157 | 145 |
цитом | (76-250) | (36-267) | (52-302) | (21-319) | (35-416) | (51-347) | (45-364) | (66-305) | (42-316) |
р | 0,0001 | 0,0001 | 0,0001 | 0,0147 | 0,0926 | 0,0037 | 0,0083 | 0,0019 | 0,0056 |
пмоль/л
500-)
он—————————- 1—————— 1———————— 1
Утро День Вечер
Рис. 4. Суточная динамика св. Т в слюне больных мужчин с андрогенным дефицитом.
♦ — медиана, достоверность различий между утром и вечером р = 0,583, между днем и вечером р = 0,0006.
Определение св. Т проводили люминесцентным LIA-методом (фирма «IBL-Гамбург», Германия), основанном на принципе конкурентного связывания. Регистрацию люминесцентного сигнала осуществляли на мультианализаторе Victor (фирма «Wallac”, Финляндия). Определение об. Т в образцах крови проводили методом усиленной хемолюминесценции с помощью автоматизированного анализатора Vitros ECi («Ortho-Clinical Diagnostics», «J&J», Великобритания) как наиболее адекватного метода [12].
Определение содержания глобулина, связывающего половые стероиды (СССГ), проводили методом отсроченной по времени флюоресценции с помощью автоматизированной системы Аи- todelfia (фирма «Wallac», Финляндия). Вычисление концентрации св. Т в крови осуществляли с помощью математической формулы, использующей показатели в крови об. Т и СССГ и описанной в работе A. Vermeulen [37] (калькулятор расчетного св. Т в Интернете http://www.issam.ch/ freetesto.htm).
Рис. 5. Сравнение показателей расчетного св. Т в крови и св. Т в слюне в утренние часы у здоровых мужчин.
Рис. 6. Сравнение показателей расчетного св. Т в крови (7) и св. Т в слюне (7) в утренние часы у пациентов с андрогенным дефицитом.
Статистическая обработка результатов. Полученные данные были обработаны с помощью программы Statistica 6 Windows, StatSoft, Inc. Результаты представлены в виде медианы и 10/90-го процентилей. Для выявления достоверности различий между сравниваемыми параметрами был использован тест Манна—Уитни. Для оценки связи между различными показателями применяли ранговый тест Спирмена и линейный регрессионный анализ. При р < 0,05 различия считали статистически достоверными.
Концентрация об. Т, уровень СССГ, вычисленный св. Т в крови и средний возраст здоровых мужчин представлены в табл. 3.
Обнаружено, что сопоставимые по возрасту мужчины и мужчины с андрогенным дефицитом имели сравнимый уровень СССГ (медиана соответственно 36,1 и 33,0 нмоль/л). Однако уровень об. Т был значительно выше в группе здоровых
пмоль/л 800-1
700-
CV»9±7%
Недели
600-
500-
Рис. 7. Воспроизводимость концентрации св. Т в слюне в группе здоровых мужчин в течение 5 нед (сбор образцов слюны 1 раз каждую неделю).
Рис. 8. Динамика св. Т в слюне у транссексуала (женщина -> мужчина).
мужчин (18,8 и 6,7 нмоль/л соответственно). Концентрация вычисленного св. Т в крови у здоровых мужчин также была в 3 раза выше, чем у пациентов с андрогенным дефицитом (374 и 135 пмоль/л соответственно).
Средняя концентрация Т в слюне у здоровых мужчин (по 3 утренних образца от каждого, в 8 ч 30 мин—9 ч 30 мин) составляла 380 (270—544) пмоль/л, средняя концентрация днем и вечером — соответственно 80 ±15 и 71 ± 21 % от утренней концентрации (рис. 3, табл. 4).
В отличие от здоровых мужчин суточная динамика св. Т в слюне у больных с андрогенным дефицитом выражена менее заметно. Концентрации св. Т утром и днем практически не различались, статистически достоверное различие было обнаружено только вечером — 68 ± 29% от утреннего уровня (рис. 4, см. табл. 4).
Концентрация св. Т в слюне и расчетная концентрация св. Т в крови у здоровых мужчин практически не различались: 380 (270—544) и 374 (225— 544) пмоль/л (р = 0,111) (рис. 5), тогда как у пациентов с андрогенным дефицитом концентрация св. Т часто отличалась от вычисленной концентрации св. Т в крови. Медиана св. Т в трех утренних образцах слюны была выше (215 пмоль/л, разброс 55—249 пмоль/л), чем вычисленная концентрация св. Т в крови — 135 пмоль/л (разброс 9,3— 215 пмоль/л; рис. 6).
Чтобы изучить воспроизводимость концентрации св. Т в слюне во времени, мы собирали слюну в группе здоровых мужчин в течение 5 нед (1 раз в неделю, утром). В начале исследования (1-я неделя) концентрация св. Т у обследуемых была в пределах 180—745 пмоль/л. Последующие определения Т (2—5-я недели) показали высокую повторяемость результатов (коэффициент вариации 9%, разброс от 5 до 23%; рис. 7).
Следующий важный аспект — мониторинг заместительной терапии андрогенами по уровню св. Т в слюне. Мы проводили мониторинг определения св. Т в слюне у транссексуала (женщина -> мужчина) после лечения сустаноном. До лечения уровень общего и вычисленного св. Т в крови был очень низок (соответственно 3,9 нмоль/ и 42,3 пмоль/л). Через 1 нед после инъекции сустанона уровень об. Т в крови вырос на 29%, концентрация вычисленного св. Т в крови — на 140%, тогда как содержание св. Т в слюне увеличилось утром на 275% и вечером на 527% (рис. 8).
Мониторинг заместительной терапии андрогенами более адекватен при определении св. Т в слюне с помощью люминесцентного иммунного анализа (ЛИА-технологии). С этим методом достаточно просто изучать фармакокинетику в каждом отдельном случае, чтобы подбирать оптимальную дозу препарата и пути его введения.
Таким образом, с введением в практику очень чувствительной и специфичной ЛИА-технологии концентрация Т в слюне может быть широко использована как объективный и адекватный гормональный критерий в диагностике различных форм гипогонадизма у мужчин, а его определение ЛИА- методом может служить методом выбора для целого ряда научных исследований, мониторинга и лечения гонадальных дисфункций, включая изучение фармакокинетики производных Т при заместительной терапии.
ситилаб тестостерон
Ключевые теги: ок при повышенном тестостероне, где купить ситилаб тестостерон, тестостерон энантат в москве.
продукты повышающие уровень тестостерона в организме мужчины, женский тестостерон, курс на сушку тестостерон, общий или свободный тестостерон сдавать женщине, признаки нехватки тестостерона
Описание
Первый раз был с девушкой, поэтому сильно боялся. Наклеивал себе сразу 2 пластыря, чтобы все стояло, а не падало. Еще инструкции на ютубе смотрел, что делать. Все здорово! Секс был на уровне. Девушка оценила мои способности. При нестабильной потенции мужчина перестаёт получать удовольствие от интимной близости, на фоне чего очень сильно страдает психоэмоциональный фон. Виной тому может быть снижение уровня тестостерона в организме.
Официальный сайт ситилаб тестостерон
Состав
СДАТЬ АНАЛИЗ тестостерон в федеральной сети независимых клиникодиагностических лабораторий СИТИЛАБ. Лабораторная диагностика в Москве. СДАТЬ АНАЛИЗ Тестостерон по доступной цене в СИТИЛАБ (Москва). Быстрые и точные результаты. Расшифровка анализов. Онлайн кабинет. СДАТЬ АНАЛИЗ Тестостерон свободный по доступной цене в СИТИЛАБ (Москва). Быстрые и точные результаты. Расшифровка анализов. Анализ на тестостерон. 19.00 лева Тестостерон (Testosteron) . Материал: периферическая / венозная кровь. Продолжительность: в течение рабочего дня.(ЛГ) Фолликулостимулирующий гормон (ФСГ) Пролактин Прогестерон Эстрадиол (Е2) Эстриол свободный (Е3) Тестостерон Тестостерон свободный. Тестостерон (Testosterone). У мужчин тестостерон играет ключевую роль в развитии и поддержании репродуктивной и половой функции. Анализ на тестостерон в Москве — цены, описание, расшифровка результата. Тестостерон – стероидный гормон, ответственный за половую функцию и развитие вторичных половых признаков, основной андроген мужского организма. Смартлаб (Ситилаб). Нажми, чтобы запомнить или распечатать: ×. Анализ на общий тестостерон у мужчин назначают при признаках гипогонадизма, когда можно предполагать снижение уровня тестостерона. Тестостерон. Мы сотрудничаем с лучшими лабораториями, которые проводят разные гематологические анализы это СитиЛаб г. Москва и ДНКклиника г. Ярославль: коагулографические исследования (коагулограмма). Тестостерон. Наименование на латинском языке. Testosterone Summa. Тестостерон андрогенный гормон, ответственный за вторичные половые признаки у мужчин. Тестостерон поддерживает сперматогенез, стимулирует. Тестостерон свободный. Ситилаб. 1100 р. Тестостерон свободный Лаборатории Ситилаб Цена 1100 р. Готовность, дней от 1 до 4.
Эффект от применения
Пластырь важно правильно прикрепить — на конкретные места, указанные в инструкции, и на предварительно очищенную сухую кожу, чтобы контакт был плотным, без складок и воздушных пузырей. Начинает действовать уже в 1-й час и работает до 24-х часов. Чтобы вернуть здоровье и сексуально активную жизнь, специалисты рекомендуют использовать Testonormin. Он восстанавливает гормональный баланс и усиливает потенцию. Несмотря на то, что на рынке сегодня существует огромное количество возбуждающих средств, тестостероновый пластырь можно назвать одним из лучших ввиду его щадящего воздействия и безопасности.
Мнение специалиста
Все мужчины, кто пробовал Тестонормин, заявляют, что смогли добиться с его помощью значительного улучшения сексуальной жизни. Они избавились от преждевременной эякуляции, и получили возможность проводить по несколько половых актов подряд. Это в свою очередь привело к положительным изменениям в отношениях с женщинами, к укреплению брака. Кроме того, мужчины отметили, что у них улучшилось самочувствие, наблюдается прилив сил и энергии. Все это является результатом нормализации гормонального фона и повышения тестостерона.
Дневной цикл Таких циклов два. Первый прост как мычание с утра уровень тестостерона находится на высшем уровне, к вечеру падает. Самые длинные циклы, которые были замечены ученными у мужчин – это сезонные гормональные циклы. Сезонные колебания тестостерона были зарегистрированы во многих проведенных исследованиях [18], но Р. Смит и коллеги. Вы здесь: Главная Инстинкты Manstruation: сколько дней длится мужской цикл. 5Лайки. Автор текста: Тестостерон. Инстинкты. 17.01.2019. Тестостеро́н (от тестикулы, стерол и кетоны) — основной мужской половой гормон, андроген. Синтезируется из холестерина клетками Лейдига семенников. Цикл у мужчин: 24часовой мужской гормональный цикл. Как он сказывается на самочувствии, здоровье, настроении и работоспособности мужчины. Как цикл тестостерона Enanthate Как: что мы должны делать для начинающего, промежуточного, расширенного цикла энантата тестостерона? Мужчины тоже проходят через гормональные циклы. Затем тестостерон понижается в течение дня, но могут происходить отдельные всплески ввиду. Тестостерон – это особый половый гормон, отвечающий за развитие вторичных половых. Где вырабатывается гормон. Норма тестостерона в разные дни цикла. Изменение нормы у женщин. Причины изменения уровня. Тестостерон – это мужской половой гормон, который производится из холестерина и играет значимую роль в половом развитии не только мужчин, но и женщин. NEWS: НОВОЕ ОБНОВЛЕН. Поделиться. Южаков Антон Тестостерон описание препарата. Тестостеро́н — основной мужской половой гормон, андроген , обладает выраженными анаболическими свойствами : увеличивает мышечную массу, ускоряет синтез белка Секретирует.
Назначение
Очень боялась, что сильное средство для потенции спровоцирует у мужа инфаркт или что-то плохое. Сочетание Тонгката Али с экстрактом имбиря и хорошо известного в китайской медицине жгун-корня Моннье меня заинтересовало. Применение в виде пластыря, когда можно сразу отменить если что не так (снять пластырь и не продолжать курс) обнадежило еще больше. Потом пришлось докупить, так как эффект был к концу 3-й недели очень приличный, муж сам захотел все продолжить.
Как заказать?
Заполните форму для консультации и заказа ситилаб тестостерон. Оператор уточнит у вас все детали и мы отправим ваш заказ. Через 1-10 дней вы получите посылку и оплатите её при получении.
ситилаб тестостерон. кофе и тестостерон. Отзывы, инструкция по применению, состав и свойства.
Официальный сайт ситилаб тестостерон
Купить-ситилаб тестостерон можно в таких странах как:
Россия, Беларусь, Казахстан, Киргизия, Молдова, Узбекистан, Украина Армения
При нестабильной потенции мужчина перестаёт получать удовольствие от интимной близости, на фоне чего очень сильно страдает психоэмоциональный фон. Виной тому может быть снижение уровня тестостерона в организме. Тестостерон и его эфиры. Плюсы и минусы эфиров и период полураспада. Когда начинать ПКТ после тестостерона. Как комбинировать различные эфиры. Какой тестостерон выбрать? ТОП 3 лучших тестостеронов для мужчин и женщин. Для чего нужен тестостерон при занятиях спортом и в течение какого времени его. NEWS: Поделиться. Анализ данных показывает, что современных и безопасных стероидов не существует. За последнее время не было разработано новых препаратов за исключением отдельного класса SARMs.но чтобы узнать, какой производитель тестостерона пропионата лучше. Второе место среди лучших производителей пропионата без раздумий отдано Тайланду. Список лучших способов для повышения тестостерона. Сравнительная таблица препаратов, эффективные рецепты народной медицины и роль андрогена для. Каким препаратом лучше лечить пониженный тестостерон?. В какой форме выпускаются средства для повышения тестостерона? Прогормоны, Жиросжигание. Пептиды. Какой стероидный курс лучше выбрать новичку?. 1. Сольное использование самого чистого экзогенного тестостерона. Тестостерон – это главный мужской гормон, показатель его мужской силы. Тут лучше обратиться за помощью к знающим людям, чтобы выяснить список продуктов. Но знаю, что кофе помогает сбавить уровень гормона. Так что, можете. Спортивные добавки для стимулирования выработки тестостерона, ускорения прироста мышечной массы, повышения показателей силы и полового влечения, снижения эстрогена называют бустерами тестостерона. Пластырь важно правильно прикрепить — на конкретные места, указанные в инструкции, и на предварительно очищенную сухую кожу, чтобы контакт был плотным, без складок и воздушных пузырей. Начинает действовать уже в 1-й час и работает до 24-х часов.
Первый раз был с девушкой, поэтому сильно боялся. Наклеивал себе сразу 2 пластыря, чтобы все стояло, а не падало. Еще инструкции на ютубе смотрел, что делать. Все здорово! Секс был на уровне. Девушка оценила мои способности.
Тестостероновые пластыри Тестонормин для мужчин предназначены для обеспечения твердой и продолжительной эрекции, а также улучшения качества сексуальной жизни. Ниже представлен подробный обзор данного средства, состав, способ применения, мнение специалистов, а также информация о том, где купить Testonormin по цене производителя.
После проделанного действия с вами свяжется работник компании и предложит всевозможные акции. Благодаря бонусам можно немного сэкономить на покупке. Менеджер фирмы предоставит подробную информацию и после подтверждения запроса вышлет посылку на указанное почтовое отделение. Производители не работает по предоплате. Оплата осуществляет только при получении пластырей для усиления потенции.
Развенчиваем мифы о тестостероне. Роберт Сапольски «Биология добра и зла».
Издательство Альпина нон-фикшен издала книгу нейробиолога Роберта Сапольски «Биология добра и зла» о природе хороших и плохих поступков и факторах, влияющих на наше поведение. Перевели с английского Юлия Аболина и Елена Наймарк.
Это высококачественная научно-популярная литература авторства настоящего ученого: Роберт Сапольски — американский нейроэндокринолог, профессор биологии, неврологии и нейрохирургии в Стэнфордском университете, исследователь и автор книг. Кроме того, он является научным сотрудником в Национальном музее Кении.
Сапольски автор отличных книг:
Сапольски, Р. Психология стресса = Why Zebras Don’t Get Ulcers.
Сапольски, Р. Записки примата: необычайная жизнь ученого среди павианов = A Primate’s Memoir: A Neuroscientist’s Unconventional Life Among the Baboons.
Сапольски, Р. Кто мы такие? Гены, наше тело, общество = Monkeyluv: And Other Essays on Our Lives as Animals.
Именно такие книги надо читать, чтобы не жить среди сказок и мифов о природе человека, часто сложенных тысячи и тысячи лет назад.
Здорово, что есть в России издательства, вкладывающееся в качественный науч-поп.
Читайте умные книги.
Вот отрывок из книги Роберта Сапольски «Биология добра и зла» про ТЕСТОСТЕРОН — один из самых популярных гормонов среди спортсменов.
Василий ПАРНЯКОВ
Майя ГУСЕЙНОВА
У самцов, в том числе мужчин, тестостерон выделяется семенниками в результате каскада влияний по оси гипоталамус — гипофиз — яички, а семенники — последнее звено этого нисходящего каскада. При этом тестостерон воздействует на клетки всего тела (включая, естественно, нейроны). И как только дело касается агрессии, то главным обвиняемым гормоном становится тестостерон.
Сопоставления и причины
Почему считается, что самцы, а в частности мужчины (причем во всех культурах), ответственны за агрессию и насилие? Так как насчет тестостерона и связанных с ним гормонов? (Все эти гормоны называют общим словом «андрогены», и я для простоты буду использовать именно этот термин в качестве синонима тестостерону, если только мне не понадобится что-то специально уточнить.) У самцов почти всех видов тестостерона больше, чем у самок (здесь некоторое количество андрогенов выделяется надпочечниками). К тому же агрессия у самцов более выражена при высоком уровне тестостерона (например, в подростковом возрасте или у видов с сезонной цикличностью в период спаривания).
Таким образом, тестостерон и агрессия связаны. Заметим далее, что в миндалине особенно много тестостероновых рецепторов; также их много и на «перевалочной станции» (в ядре ложа конечной полоски), через которую миндалина связана с другими частями мозга, и в основных областях, находящихся в зоне ее влияния (гипоталамусе, центральном сером веществе, лобной коре). Но это не более чем сопоставления. Чтобы доказать, что тестостерон является причиной агрессии, понадобятся эксперименты по типу «удаления» и «замещения».
«Удаление» — вариант кастрации самца. Снижается ли при этом уровень агрессии? Да, снижается (и у людей тоже). Это говорит о том, что нечто, поступающее из семенников, вызывает агрессию. Является ли это нечто тестостероном? Проведем замещение — добавим кастрату недостающий гормон. Достигнет ли при этом агрессия докастрационного уровня? Да, достигнет (и у людей тоже). Вывод — тестостерон является причиной агрессии. А теперь посмотрим, до какой степени это неверно.
Сложности начинаются, как только мы беремся измерить уровень агрессии сразу после кастрации: средние показатели у всех видов обваливаются, но — и это существенно — не до нуля. Может быть, мы произвели кастрацию неаккуратно и удалили семенники не полностью? Или некоторое небольшое количество андрогенов выделяется надпочечниками для поддержания агрессии? Но нет, даже когда тестостерон и все андрогены полностью устранены, агрессивное поведение в том или ином виде все же остается. А значит, какая-то часть агрессии у самцов не зависит от тестостерона. [1]
Данное заключение надежно подтверждается мониторингом мужчин, которых за преступления на сексуальной почве приговаривают именно к кастрации, как это принято в некоторых американских штатах. В качестве законного наказания за сексуальные преступления там используют «химическую кастрацию»: осужденным дают принудительно препараты, которые либо подавляют выделение тестостерона, либо блокируют тестостероновые рецепторы. [2]
В результате у преступников с сильными, неудержимыми, патологическими сексуальными позывами кастрация снижает уровень сексуального напряжения. Но при этом уровень рецидивов у них не снижается. Как утверждается в одном исследовании, основанном на анализе широкого массива данных, «если преступление на сексуальной почве мотивировано демонстрацией ярости или власти, то таким злостным насильникам бесполезно давать [антиандрогеновые] препараты».
Эти наблюдения ведут к чрезвычайно важному заключению: если самец часто выражал агрессию до кастрации, он и после нее будет продолжать в том же духе. Другими словами, такому самцу для поддержания агрессии не слишком нужен тестостерон, она является следствием социального научени
Перейдем к следующему пункту, ставящему под сомнение главенство тестостерона. Как индивидуальный уровень этого гормона соотносится с агрессией? Если у одного человека средний уровень тестостерона выше, чем у другого, или на этой неделе у него он выше, чем на прошлой, значит ли это, что данный индивид более агрессивный? Казалось бы, на все эти вопросы следует ответить утвердительно, т. к. исследования показывают корреляцию между индивидуальным уровнем тестостерона и более высокими показателями агрессии. Но ведь агрессия сама стимулирует выделение этого андрогена; так что неудивительно, что у более агрессивных личностей и тестостерон повышен. Извечную проблему курицы и яйца подобным образом не решить.
Мозг и агрессия
Лучше поставим вопрос так: можно ли по индивидуальным различиям в уровне тестостерона предсказывать агрессию? Оказывается, что для птиц, рыб, млекопитающих и — это особенно важно — приматов ответ в целом отрицателен: нет, не можем. Для человека тоже проводили великое множество аналогичных исследований, при этом в расчет брались самые разные показатели агрессии. Ответ был во всех случаях ясный. Вот цитата из итогового обзора 2006 г. британского эндокринолога Джона Арчера: «Связь между уровнем тестостерона и агрессией у взрослых [людей] очень слабая и нестабильная, и… у добровольцев при приеме тестостерона она не увеличивается». Мозг не замечает изменений в уровне тестостерона, если колебания происходят в пределах нормы. Другое дело, если количество гормона повышают сверх физиологической нормы и его становится больше того уровня, который свойственен обычной работе организма. Тут мы оказываемся в мире спортсменов и бодибилдеров, злоупотребляющих тестостероноподобными стероидами-анаболиками; в этом случае риск агрессии действительно повышается. Однако и тут есть два «но»: обычный человек не станет принимать такие препараты, а те люди, которые выбирают этот путь, и без того предрасположены к агрессивному поведению; у них дополнительный прием андрогенов вызывает тревогу и паранойю, и агрессия может быть побочным результатом этих синдромов.
Таким образом, агрессия скорее говорит о социальном научении, нежели о тестостероне. Разный уровень этого гормона не объясняет, почему одни более агрессивны, чем другие. Как же все-таки тестостерон влияет на поведение?
Действие тестостерона в подробностях
Когда мы видим у кого-то на лице очень ярко выраженную эмоцию, мы чуточку копируем это выражение сами; тестостерон же снижает способность к подобному «эмпатическому» копированию. [3] Вдобавок этот андроген ухудшает качество распознавания эмоций по глазам, из-за него незнакомые лица — в отличие от знакомых — вызывают более сильную активацию миндалины и воспринимаются более насторожено.
Тестостерон укрепляет уверенность в себе и повышает оптимизм, умеряет страх и тревогу. Этим объясняется эффект победителя у лабораторных животных: победа в драке повышает аппетит к другим подобным стычкам и, соответственно, количество последующих побед. Частично такой успех свидетельствует о том, что выигрыш стимулирует выработку гормона, который, в свою очередь, увеличивает поставку глюкозы в ткани мышц животного и ускоряет метаболизм, а из-за этого феромоны победителя пахнут более «угрожающе».
Кроме того, выигрыш увеличивает количество тестостероновых рецепторов в ядре ложа конечной полоски («промежуточной станции», через которую миндалина сообщается с остальным мозгом). А это, как мы знаем, повышает чувствительность к данному гормону. Любой успех — в спорте, шахматах или бизнесе — поднимет уровень тестостерона.
Ну что же, уверенность и оптимизм — это прекрасно. Именно к ним призывают нас бесконечные ряды книжек по саморазвитию. Но коварный гормон делает нас слишком самонадеянными, слишком оптимистичными, что может иметь нехорошие последствия. В одном эксперименте участникам в парах предлагали советоваться друг с другом, прежде чем принимать решение. Под влиянием тестостерона испытуемые считали правильным собственное решение и не обращали внимания на суждение напарников. Этот андроген превращает людей в хамов, эгоистов и нарциссов.
Истоки человеческой агрессии
Тестостерон добавляет людям импульсивности, заставляет рисковать, принимать глупейшие решения в простых ситуациях. А получается так из-за того, что он снижает активность префронтальной коры и ухудшает ее функциональную связь с миндалиной, одновременно активируя взаимодействие последней с таламусом, — а это, как мы уже знаем, есть короткий путь сенсорной информации к миндалине. Таким образом, право решающего голоса получают мгновенные неточные импульсы, а рациональные «остановись-и-подумай» сигналы от лобной коры играют подчиненную роль.
Человек, испытывающий бесстрашие, уверенность в себе и безграничный оптимизм, чувствует себя прекрасно. Поэтому неудивительно, что тестостерон воспринимается благожелательно. Крысы будут стараться изо всех сил (нажимать на рычаг), чтобы получить порцию тестостерона; они демонстрируют «условно-рефлекторный выбор места», т. е. возвращаются в тот угол клетки, где им вводили андроген. Они как будто говорят: «Не знаю почему, но я себя так замечательно чувствую, стоит мне постоять в том углу».
Нейробиологическая основа точно соответствует этим наблюдениям. Чтобы выработался условный рефлекс «места», необходим дофамин, а тестостерон как раз увеличивает активность области вентральной покрышки, откуда исходят мезолимбические и мезокортикальные дофаминовые аксоны. Кроме того, условный рефлекс «места» вырабатывается в том случае, если тестостерон доставляется напрямую в прилежащее ядро — т. е. куда приходит большинство проекций из вентральной покрышки. Когда крыса побеждает в драке, в вентральной покрышке и прилежащем ядре увеличивается количество тестостероновых рецепторов, вследствие чего чувствительность к гормону и к «тестостероновой радости» возрастает.
Итак, в действии этого андрогена на наше поведение есть масса тонких моментов. Но при этом никаких жестких выводов мы сделать не в состоянии, т. к. любое наше наблюдение можно истолковать и так и этак. Тестостерон повышает тревогу — вы чувствуете страх и, реагируя на это, становитесь агрессивным. Тестостерон снижает тревогу — и вы делаетесь наглым, самонадеянным и, соответственно, агрессивным заранее. Тестостерон усиливает желание рискнуть: «Эгей, я положусь на удачу и одолею соседа!» Или так: «Эгей, я положусь на удачу и договорюсь с ним миром!» Из-за тестостерона вам становится лучше: «Я только что с таким шиком победил, а ну-ка еще раз подерусь». Или так: «Давайте все помиримся и пожмем друг другу руки».
Так что результат воздействия данного гормона в огромной степени зависит от ситуации — вот это и есть важнейший вывод.
Сопряженный эффект тестостерона
Зависимость от ситуации, контекста означает, что тестостерон не является причиной поступка Х, а скорее усиливает действенность чего-то еще, что и есть причина Х.
Для иллюстрации этого утверждения приведем классическое исследование 1977 г. самцов карликовых мартышек талапойн. Самцам, находившимся где-то посредине иерархической лестницы группы (скажем, на ступени 3 из 5), вводили тестостерон, увеличивая уровень агрессии. И что же? Наши «на тестостероненные» друзья кинулись нападать на вожаков — самцов ступеней 1 и 2? Вовсе нет. Вместо этого они сделались кошмарными хамами по отношению к несчастным сородичам ступеней 4 и 5. Гормон не привел к возникновению новых агрессивно-нагруженных социальных связей, он только укрепил уже существующие.
Исследования показали, что у человека тестостерон не повышает базовую активность миндалины; он подогревает ее реакцию и усиливает сердечную деятельность при виде угрожающих лиц (но не нейтральных или радостных). Похожим образом тестостерон не делал испытуемых эгоистичнее в ситуации экономических игр; зато они становились более мстительными в ответ на несправедливость, у них повышалась, если можно так выразиться, реваншистская реактивная агрессия.
Зависимость от контекста проявляется и на уровне нейробиологии. Этот гормон укорачивает рефрактерный период (период невозбудимости) нейронов в миндалине, а также в гипоталамусе, куда из нее приходят отростки. Примем во внимание, что рефрактерный период наступает в нейроне после потенциала действия. В этот момент потенциал нейрона характеризуется гиперполяризацией (т. е. нейрон несет больший отрицательный заряд, чем обычно), приводящей к тому, что он оказывается менее возбудим; в результате после потенциала действия следует период покоя. Поэтому более короткий рефрактерный период означает повышенную частоту потенциалов действия.
Спросим себя: что повышает частоту потенциалов действия — тестостерон? Нет. Тестостерон заставляет нейроны возбуждаться чаще, если на них действует еще какой-то стимул. Именно так наш гормон усиливает ответ миндалины на страшные лица, но ни на какие другие. Итак, вот что мы имеем: если миндалина уже реагирует на некий социальный стимул, то тестостерон увеличивает силу реакции.
Ключевое обобщение: гипотеза «вызова» Да, существующую склонность к агрессии тестостерон усугубит, но не создаст ее из ничего, т. е. действие его сопряженное и усиливающее. С оглядкой на это правило была предложена воодушевляющая гипотеза «вызова», в рамки которой прекрасно укладывается вся имеющаяся информация о действии андрогена. Джон Уингфилд, блестящий эндокринолог-бихевиорист, и его коллеги из Калифорнийского университета в Дэвисе высказали в 1990 г. интересную мысль. Их идея заключалась в том, что повышение уровня тестостерона усиливает агрессию только в ситуации «вызова». Именно так все и происходит.
Эта гипотеза объясняет, почему базовый уровень тестостерона не влияет на последующее проявление агрессии, а также почему увеличение количества гормона в период полового созревания, половой стимуляции и в начале брачного сезона тоже не вызывает ее роста.
Но когда судьба бросает вызов, все меняется. У многих приматов уровень тестостерона повышается в те моменты, когда в группе устанавливается новая иерархия доминирования или перестраивается старая. У людей его количество возрастает, например, во время спортивных соревнований, причем как в командных, так и в индивидуальных видах спорта — баскетболе, теннисе, регби, дзюдо и борьбе. То же наблюдается и перед соревнованиями, и (в еще большей степени) после них, особенно среди победителей. [4] Знаменательно, что уровень тестостерона поднимается и у болельщиков, когда они становятся свидетелями победы любимой команды; это означает, что не мышечная активность, а скорее психология доминирования, социальной идентификации и самооценки увязана с увеличением количества этого андрогена.
Самое здесь важное — повышение уровня тестостерона после того или иного испытания делает агрессивное поведение более вероятным. Вот подумайте: количество тестостерона увеличилось, и он попал в мозг. Если это произошло в конфликтной ситуации, вы направите пристальное внимание в сторону источника агрессии. Если тестостерон поднялся из-за того, что дни стали длиннее и приближается сезон спаривания, кое-кто отправляется за тысячу миль искать себе пару. Если же количество гормона взлетело, потому что возраст подошел, вы станете глупо хихикать в присутствии девчонки-кларнетистки из музыкального класса. Зависимость от контекста поразительна! [5]
У гипотезы «вызова» есть и вторая часть. Подъем уровня тестостерона после испытания не провоцирует агрессию. Вместо этого он ведет к тому поведению, которое необходимо для поддержания социального статуса. А это меняет все.
Ну, может, и не совсем все: ведь у самцов-приматов сохранение статуса требует агрессивного поведения или по крайней мере угрозы агрессии — от жестокого нападения на противника до устрашающего взгляда типа «ты-даже-не-представляешь-с-кем-связался».
Роль мужского мозга в размножении
А теперь расскажем об ошеломительном открытии. Что будет, если поддержание статуса потребует быть… хорошим? Именно такой вопрос задали себе исследователи Кристоф Айзенеггер и уже упоминавшийся Эрнст Фер из Цюрихского университета. Участники эксперимента играли в игру «Ультиматум», где нужно было решить, сколько денег оставить себе, а сколько предложить игроку-противнику. Соперник мог принять или отвергнуть такое решение, и если он не принимал предложенный дележ, то ни один из игроков не получал ничего. Предыдущие исследования показали, что первый игрок в случае отказа от своего предложения чувствует себя оскорбленным, отодвинутым на второй план, особенно если об отклоненном предложении становится известно в следующих раундах. Другими словами, по этому сценарию статус и репутация держатся на честности и справедливости.
Что же случится, если испытуемым предварительно дать тестостероновые препараты? Участники становятся щедрее. Гормон заставит вас делать именно то, что в данном социальном контексте будет считаться сексуально привлекательным. А это требует довольно-таки затейливой системы нейронно-эндокринных связей, тонко реагирующих на социальное обучение. Поистине трудно найти другое подобное исследование, которое так надежно лишит тестостерон «агрессивной» репутации! В этом исследовании был еще один любопытнейший аспект, который еще дальше отодвинул миф о тестостероне от реального положения вещей.
Как и во всех подобных слепых экспериментах, участники не знали, что им дают — в данном случае это были либо физиологический раствор, либо тестостерон. Тот, кто считал, что получил тестостерон (независимо от того, что ему ввели в действительности), в игре делал менее щедрые предложения. Другими словами, бесстыжим вы становитесь не от собственно гормона, а от веры в то, что причина хамства — море тестостерона.
Дополнительное исследование показало, что в должной ситуации этот андроген способствует просоциальному поведению. В одном из срежиссированных случаев, когда гордость за себя должна была основываться на честности, тестостерон уменьшал количество эпизодов жульничества в игре.
В другом случае, где игроки сколько-то денег должны были оставить себе, а сколько-то положить в «общий котел», тестостерон понуждал большинство также к просоциальным решениям.
Что все это означает? А то, что благодаря тестостерону мы сильнее стремимся всеми допустимыми способами получить и поддерживать социальный статус. И ключевым в этой фразе является словосочетание «допустимыми способами».
Создайте правильные социальные условия и при увеличении уровня гормона люди помчатся, обгоняя друг друга, совершать добрые поступки. В нашем мире, где агрессия мужчин встречается на каждом шагу, проблема не в том, что тестостерон увеличивает агрессивность. Проблема в том, как часто мы эту агрессию поощряем.
Источник: Постнаука
Сезонное изменение тестостерона — AskMen
Взломайте гормоны, чтобы оставаться счастливым, здоровым и сильным в течение всего года
Как говорится в Игра престолов , приближается зима. Или, точнее, он уже здесь. Зима обычно приносит с собой лютые холода и печальную реальность того, что футбольный сезон подходит к концу. Оба этих удручающих факта заставляют жизнь казаться немного более скучной по сравнению с весенними цветами и тыквенным пивом осенью.
Каждую зиму, осознаем мы это или нет, мы обычно становимся немного более раздражительными, быстрее хватаемся за близких и в целом разочаровываемся в большей степени.Это могло быть из-за сильного холода и того бариста, который испортил ваш заказ на кофе. Или это может быть связано с сезонными колебаниями тестостерона.
Ага, вы все правильно прочитали. Женщины — не единственные люди, которым приходится иметь дело с гормональным циклом. И, как и у женщин, гормональные циклы мужчин могут сильно повлиять.
Оказывается, времена года удивительным образом влияют на уровень тестостерона, а это, в свою очередь, влияет на наше сексуальное влечение, способность сжигать жир, наращивать мышцы и в целом чувствовать себя мужчиной.
Чтобы понять почему, нам нужно немного узнать о тестостероне.
Тестостерон — половой гормон, вырабатываемый в основном яичками. Это то, что делает мужчину мужчиной. Тестостерон — это гормон, связанный с агрессией, сексуальным желанием и способностью нарастить больше мышц.
Когда дело доходит до мужчины, тестостерон чертовски важен. Возможно, более важен, чем любой другой индивидуальный гормон, производимый вашим организмом.
Большинство из нас считает, что наш уровень тестостерона более или менее установлен и неуклонно снижается с возрастом.По большей части это правда. Мы действительно остаемся в пределах этого диапазона, и этот диапазон действительно начинает двигаться на юг по мере того, как мы стареем.
Но внутри этого диапазона мы можем видеть некоторые довольно серьезные колебания, колебания, которые происходят в течение дня, недели или в течение года.
Годовые колебания тестостерона обычно называют сезонными колебаниями тестостерона. По сути, уровень тестостерона меняется в течение всего года, достигая пика в конце осени и в начале зимы и достигая нижней точки в июне.
Ученые еще не совсем уверены, почему это так, и многое можно сказать о том, имеет ли это вообще большое значение.
Я спросил Спенсера Надольски, Д.О. за его мысли о сезонных изменениях тестостерона. Вот что он сказал:
«С этими сезонными изменениями тестостерона мы не знаем, действительно ли это клинически значимо, особенно если кто-то попадает в средний диапазон. Это может иметь клинические последствия, если кто-то находится на более низком уровне, а затем падает ниже в зимние месяцы »
Мы можем не знать значения сезонных изменений тестостерона, но мы знаем, что примерно через 9 месяцев после пика тестостерона рождается больше детей. .Когда будет больше тестостерона, обязательно будет больше детей.
В тренажерном зале можно не только родить больше детей, но и поправиться.
Именно здесь сезонные уровни тестостерона проходят полный цикл. Как вы можете воспользоваться этими изменениями, чтобы стать сильнее, сбросить больше жира и лучше выглядеть голым?
Как мы уже говорили, тестостерон является важным гормоном, когда речь идет о наращивании мышечной массы. Это одна из основных причин, почему у мужчин обычно больше мышечной массы, чем у женщин.Если вы хотите нарастить больше мышц, использование этих сезонных максимумов может быть чрезвычайно важным.
Чтобы извлечь выгоду из сезонного повышения уровня тестостерона, вот несколько вещей, которые вам следует делать этой зимой:
- Не снижайте слишком много жиров. Жир — необходимый макроэлемент для здоровья и жизненной силы, особенно если вы хотите поддерживать высокий уровень тестостерона.
- Поднимайте тяжелые, жесткие и частые. Это не лицензия, чтобы каждый день пытаться устанавливать новый максимум.Вместо этого, если вы присматривались к определенной программе набора массы, сейчас самое время заняться ею.
- Получайте много витамина D. Уровни витамина D и тестостерона связаны в ряде исследований. Если вы не проводите хотя бы 20-30 минут на улице каждый день, попробуйте принимать добавки с витамином D. В идеале ищите дозу около 3000 МЕ — так как это исследование показало, что, когда мужчины принимают примерно столько же в течение года, они заканчивают. на 25% больше тестостерона.
Самое прекрасное в этих предложениях то, что они могут работать так же хорошо, когда летом уровень тестостерона самый низкий, и вы хотите немного поднять его.Правильное питание и много упражнений являются ключом к правильному уровню тестостерона. Если вы соберете все три под контроль, есть большая вероятность, что вы нарастите больше мышц, сбросите больше жира и станете лучше выглядеть, создав собственных детей.
границ | Сезонные изменения сывороточных гонадотропинов и тестостерона у мужчин, выявленные на основе большого набора данных реальных наблюдений за девять лет
Введение
Жизнь строго встроена в циклические изменения, и некоторые организмы разработали циркадные и околгодовые часы, чтобы адаптировать свои физиологические функции к изменениям внешней среды.Соответственно, люди разработали циркадные часы для синхронизации биологических функций с ритмами окружающей среды (1, 2). Хотя имеется множество данных о суточной ритмичности, о круглогодичных часах известно меньше. В частности, ось гипоталамус-гипофиз-гонад, по-видимому, чрезвычайно чувствительна к ритмичности окружающей среды (3), поскольку годовые колебания гормонов необходимы нескольким животным для оптимизации времени воспроизводства (4). Этот физиологический механизм имеет генетический субстрат, и несколько генов часов регулируют ритмичность циркадных гормонов у большого числа организмов, включая млекопитающих (5–9).Эти гены экспрессируются в гипоталамусе человека, который можно рассматривать как стимулятор оси гипоталамус-гипофиз-гонад, и, по-видимому, имеют отношение не только к циркадной ритмичности, но и к сезонным колебаниям. Действительно, несколько испытаний подтверждают ключевую роль часовых генов как в фертильности человека, так и в сезонности тестостерона (10). Однако, в отличие от большинства других животных, люди размножаются в течение всего года, будучи в состоянии защитить себя от суровых условий окружающей среды. Таким образом, сезонность половых гормонов у человека в течение года не могла быть строго обязательной с точки зрения эволюции.
Циркулярная ритмичность некоторых гормонов человека до сих пор оценивалась. Среди них гонадотропины, тестостерон и пролактин являются наиболее исследуемыми гормонами для выявления возможной устойчивости гормональной сезонности. Для оценки ритмичности секреции гормонов, зависящей от окружающей среды, изучались различные периоды жизни человека, такие как препубертатный период или зрелость (11), с противоречивыми результатами. Хотя эффективность гормонов часто зависит от временного характера секреции (11), что подтверждается несколькими моделями на животных, роль этого наследственного эволюционного механизма у людей неясна.
Имея это в виду, это исследование было разработано для изучения сезонности репродуктивных гормонов у людей. В частности, мы применили подход с большими данными, чтобы выделить возможную круглогодичную секрецию ключевых гормонов гипоталамо-гипофизарно-гонадной оси у мужчин в реальных условиях. Действительно, общая оценка всей эндокринной системы гонад, включая гонадотропины и тестостерон, необходима для всесторонней оценки того, сохраняется ли сезонность у мужчин.Более того, этот подход может пролить новый свет на иерархическую организацию, регулирующую колебания выработки половых гормонов. Хотя по этой теме было опубликовано несколько статей, это первое исследование, основанное на подходе к большим данным, на сборе реальных данных и с учетом очень большого набора данных, собранных за последовательный 8-летний период.
Материалы и методы
Ретроспективный наблюдательный анализ хранилища данных был проведен на пациентах, проживающих в провинции Модена, Италия.Все лабораторные исследования, проведенные с января 2010 г. по январь 2019 г. в отделении клинической патологии (Ospedale Civile of Baggiovara, Modena, Italy), были включены в большую базу данных, содержащую 990 904 591 запись. Это хранилище данных было запрошено, и были извлечены данные всех мужчин старше 18 лет, у которых был тестостерон, лютеинизирующий гормон (ЛГ) и фолликулостимулирующий гормон (ФСГ), измеренные в одном образце. Все анализы проводились на венозном образце, взятом утром после ночного голодания.Для каждой записи регистрировали возраст пациентов и клинический диагноз. После извлечения данных клинические данные каждого рассматриваемого пациента оценивались в соответствии с критериями включения и исключения. После этого у пациентов, включенных в базу данных, проводился поиск сывороточного пролактина (ПРЛ). Таким образом, только в подгруппе включенных пациентов наблюдались уровни тестостерона, гонадотропинов и ПРЛ.
Полученный набор данных был проанализирован, вычислен доверительный интервал 95% (95% ДИ) для тестостерона, ЛГ и ФСГ.Только данные, включенные во все три 95% ДИ, были включены в окончательную базу данных.
Критериями исключения были: любой вид гипогонадизма, как первичный (например, синдром Клайнфельтера, односторонняя и / или двусторонняя орхиэктомия по любой причине), так и вторичный (например, синдром Каллмана, андрогенная депривационная терапия рака простаты, гиперпролактинемия, полный или частичный гипопитуитаризм. ). Пациенты, проходившие заместительную терапию андрогенами, были исключены из набора данных. Более того, если причина направления не была известна, соответствующие данные исключались из анализа.
Гормональные анализы
Уровни общего тестостерона в сыворотке измеряли с помощью иммуноанализа на хемилюминесцентных микрочастицах (Architect, Abbott, Dundee, UK) с коэффициентами вариации между анализами и внутри анализов (CV) 5,2 и 5,1% соответственно. ФСГ и ЛГ измеряли с помощью иммуноанализа на хемилюминесцентных микрочастицах (Architect, Abbott, Longford, Ирландия) с CV между анализами и внутри анализов 4,1 и 3,1% для ЛГ и 4,6 и 4,2% для ФСГ, соответственно. ПРЛ измеряли с помощью хемилюминесцентного иммуноанализа (Beckman Coulter, Бреа, Калифорния, США) с CV между и внутри анализа, равным 4.2 и 1,6% соответственно.
Лабораторные референсные диапазоны составляли 2,2–8,7 нг / дл для тестостерона, 1–9 МЕ / л для ЛГ, 1–12 МЕ / л для ФСГ и 3–13 нг / мл для ПРЛ. Используемые методы и наборы анализов не менялись с годами для всех рассматриваемых гормонов.
Анализ спермы
Запрошено хранилище данных для извлечения доступных анализов спермы пациентов с полной гормональной оценкой гипофизарно-гонадной оси. Анализ спермы проводился в соответствии с последними рекомендациями Всемирной организации здравоохранения (ВОЗ) (12).Были включены следующие семенные параметры: объем (мл), общее количество сперматозоидов (миллионы), концентрация сперматозоидов (миллионы / мл), процент нормальных / аномальных форм (%), процент подвижных сперматозоидов (%) и pH.
Сезонная оценка
Влияние сезонных изменений учитывалось при связывании гормональных данных с влажностью и максимальной, минимальной и средней дневной температурой, зарегистрированной в день забора крови. Данные о температуре были получены с использованием метеорологической модели CALMET, разработанной Гидрометеорологической службой Агентства по охране окружающей среды Эмилии-Романьи (ARPA) (https: // www.arpae.it). Сайты оценки температуры окружающей среды использовались для локализации записывающего устройства и подключения его к месту проживания каждого пациента. Чтобы учесть суточный ритм, количество световых часов было рассчитано с использованием календаря восхода-захода солнца программы SunEarthTools (https://sunrise-sunset.org/api).
Статистический анализ
Распределение данных оценивали с помощью теста Колмогорова-Смирнова. Корреляции между данными выполнялись с помощью тестов Пирсона или Спирмена для нормальных и ненормальных распределенных параметров соответственно.Учитывая, что обычный статистический анализ может быть смещен в большом наборе данных, для подтверждения регрессионного анализа были применены методы повторной выборки. Для этого был выбран k-кратный метод перекрестной проверки (13, 14). Мы случайным образом разделили все данные на 5 частей, затем использовали 4 раза для обучения и 1 крат для проверки результата. Этот внутренний пятикратный перекрестный проверочный тест был повторен 100 раз. В конце концов, средние регрессии, полученные с помощью каждой модели, сравнивали с обычным статистическим подходом.
Распределение тестостерона, ЛГ и ФСГ оценивалось с учетом даты обследования с помощью автокорреляционного анализа. Автокорреляционные функции были сначала рассчитаны как лаг 1, который представляет собой корреляцию между соседними наблюдениями во временном ряду (15, 16). Функция автокорреляции представляет собой статистический подход к измерению линейной зависимости между наблюдением в определенное время и наблюдениями в предыдущие моменты времени. Поскольку наш набор данных включал большое количество данных, функции автокорреляции повторялись, увеличивая значение задержки с 1 (по умолчанию) до 100.Впоследствии частичные автокорреляционные функции были рассчитаны путем корреляции преобразованных временных рядов с целью определения порядка авторегрессионной модели. Тест Бокса-Люнга использовался для проверки автокорреляций между остатками и для определения сезонной модели (17).
Когда автокорреляционные функции предполагали сезонность, применялась сезонная декомпозиция. Для определения сезонности использовался знаковый ранговый тест Вилкоксона (18). После того, как была предложена сезонность, была использована модель авторегрессионного интегрированного скользящего среднего (ARIMA) для количественной оценки обнаруженной модели сезонности.ARIMA — это обобщение модели авторегрессионного скользящего среднего (ARMA), созданное для лучшего понимания распределения данных ряда. Модели ARIMA определялись тремя буквами (p, d, q), где параметры p, d и q — неотрицательные целые числа, p — порядок (количество временных лагов) модели авторегрессии, d — степень разности. (количество раз, когда из данных вычитались прошлые значения), а q — порядок модели скользящего среднего. Функция auto-ARIMA использовалась для выбора наилучшей модели, которая будет применяться для описания распределения временных рядов.Поскольку модели ARIMA могут иметь недостатки при применении к большому набору данных (с более чем 200 данными), мы повторно протестировали модель ARIMA с учетом последнего года наблюдения, уменьшив размер выборки. Метод Холта Винтерса использовался для определения коэффициента альфа для коррекции распределения. Прогноз сезонности учитывался для коэффициента альфа от 0,01 до 0,30. Наконец, тест Льюнга – Бокса ( h = 50) использовался для обнаружения сезонности, учитывая, отлична ли какая-либо из группы автокорреляций временного ряда от нуля (19–21).
Чтобы выяснить, можно ли обнаружить сезонные пики, весь исходный набор данных был разделен на четыре группы в зависимости от сезона, в который были взяты пробы крови: зима, весна, лето и осень. Для определения четырех сезонов использовались следующие даты солнцестояний и равноденствий: 21 июня, 22 декабря, 20 марта и 23 сентября. Средние значения тестостерона, ЛГ и ФСГ сравнивали по сезонам с помощью теста Краскала-Уоллиса. Post hoc анализы были выполнены с помощью теста Тьюки.Более того, чтобы оценить роль возраста в вариациях половых гормонов, вся когорта была разделена на квартили в соответствии с возрастным распределением. Таким образом, распределение тестостерона, ЛГ и ФСГ по сезонам оценивалось в каждом квартиле возраста пациента. Чтобы оценить, сохранялось ли сезонное распределение, учитывая только гормональные показатели в пределах лабораторных эталонных диапазонов, пациенты были разделены на 3 подгруппы: (i) ниже, (ii) в пределах и (iii) выше лабораторных эталонных диапазонов.Эти диапазоны используются для исключения выбросов из анализа.
Чтобы оценить роль окружающей среды на половые гормоны, были выполнены двумерные корреляции между тестостероном, ЛГ и ФСГ с одной стороны и с максимальной, минимальной и средней температурой, влажностью и продолжительностью светового дня с использованием корреляции Спирмена Ро. В этой настройке в подгруппе пациентов с доступными измерениями ПРЛ оценивались сезонные изменения ПРЛ. Таким образом, тестостерон и гонадотропины коррелировали с уровнями ПРЛ в сыворотке с использованием корреляции Спирмена Ро.
Статистический анализ был выполнен с использованием программного обеспечения «Статистический пакет для социальных наук» (версия 25.0; SPSS Inc., Чикаго, Иллинойс) [идентификатор исследовательских ресурсов (RRID): SCR_002865] и RStudio Server Open Source Edit Version 0.99.902 2016 и Программное обеспечение для программирования R (RRID: SCR_000432). Для всех сравнений, значения p <0,05 считались статистически значимыми.
Этическое заявление
Все процедуры выполнялись в соответствии с этическими стандартами Хельсинкской декларации 1975 года, пересмотренной в 2013 году.Учитывая ретроспективный дизайн исследования, было невозможно получить информированное согласие всех участников, включенных в исследование, но все исследования были одобрены руководством больницы, поскольку данные были собраны анонимно.
Результаты
Из 17 650 строк, извлеченных первым, 14 131 данных остались после оценки критериев включения и исключения. В окончательную общую базу данных было включено 12 033 данных, что составляет 7 491 мужчина (средний возраст 47,46 ± 13,51 года, минимум 18, максимум 91 год).Средние уровни тестостерона в сыворотке крови варьировались от 1,70 до 15,80 нг / дл (в среднем 5,34 ± 2,06 нг / дл), ЛГ — от 1,00 до 15,00 МЕ / л (в среднем 4,64 ± 2,54 МЕ / л), а ФСГ — от 0,40 до 16,30 МЕ / л ( среднее 5,51 ± 3,24 МЕ / л). Три параметра не имели нормального распределения ( p <0,001).
Анализ спермы был доступен только у 2,6% когорты (317 пациентов) со средней концентрацией сперматозоидов 55,83 ± 26,48 миллионов / мл, прогрессирующей подвижностью 35,75 ± 22,44%, непрогрессивной подвижностью 9,22 ± 8.11%, типичные формы 3,99 ± 3,09% и средний объем 3,64 ± 1,93 мл. Уровни ПРЛ в сыворотке были доступны у 31,8% когорты (3830 пациентов) со средним значением 11,50 ± 6,36 нг / мл (минимум 0,30 и максимум 62,20 нг / мл).
Сезонная декомпозиция
Автокорреляционная функция была применена к распределению тестостерона, идентифицируя два значимых пика, за которыми следует длинный экспоненциальный хвост, типичный для исторических рядов (пик 1: 0,178, стандартная ошибка 0,009, коэффициент 380,13, тест Бокса-Люнга, p <0.001; пик 2: 0,045, стандартная ошибка 0,009, коэффициент 490,64, тест Бокса-Люнга, p <0,001). Этот двойной пик предполагает наличие сезонной составляющей в годовом периоде. Предполагая ежемесячное изменение, была применена сезонная декомпозиция с установкой поправочных коэффициентов для сезонности. Знаковый ранговый тест Вилкоксона подтвердил сезонное распределение ( p = 0,001). Модели ARIMA применялись для количественной оценки сезонного паттерна тестостерона. Тест auto-ARIMA выбрал ARIMA (2,0,9) как наиболее подходящую модель со средним значением 4.59 и стандартная ошибка 0,50, отображающие следующие коэффициенты: сигма 2 оценивается 2,78 с логарифмической вероятностью = -18,78, информационным критерием Акаике (AIC) = 41,55 и байесовским информационным критерием (BIC) = 42,16 (рисунок 1). Этот результат был подтвержден, учитывая только последний год наблюдений (сигма 2 , оценка 2,82 с логарифмической вероятностью = -17,02). Анализ распределения показал, что тестостерон показал значительную тенденцию по годам (Рисунок 1B) вместе с сезонным распределением (Рисунок 1A), подтвержденным тестом Бокса-Люнга (X-квадрат = 10.989, степеней свободы = 8, p -значение = 0,022). Параметр d = 0 представляет собой стационарный временной ряд, что не было подтверждено нашими результатами (рисунок 1B). Таким образом, мы запускаем модель ARIMA (1,1,1), в которой d = 1 представляет компонент стохастического тренда, подтверждая ранее сообщенную сезонность (среднее значение 1,84 и стандартная ошибка 0,10, сигма 2 оценивается 1,84 с логарифмической вероятностью = 38,4, AIC = 61,39 и BIC = 75,18). Для выявления зенита был проведен анализ разницы тестостерона между сезонами.Уровни тестостерона в сыворотке значительно различались в зависимости от сезона ( p = 0,013), с более высокими уровнями летом по сравнению с осенью ( p = 0,008) (таблица 1, рисунок 2).
Рисунок 1 . Анализ распределения уровня тестостерона в сыворотке с использованием модели авторегрессионного интегрированного скользящего среднего (ARIMA). (A) Показывает распределение данных по годам с указанием возможных пиков и надира. (B) Показывает тенденцию данных, собранных за годы наблюдения.
Таблица 1 . Уровни гормонов в сыворотке за четыре сезона в годы исследования.
Рисунок 2 . Сравнение средних уровней тестостерона в сыворотке крови по сезонам. Сравнение проводилось с помощью теста Краскела-Уоллиса. * Определяет самые высокие уровни тестостерона в сыворотке при апостериорном тесте Тьюки .
Автокорреляционная функция была применена к распределению LH, идентифицируя два значимых пика, за которыми следует длинный экспоненциальный хвост, типичный для исторических рядов (пик 1: 0.216, стандартная ошибка 0,009, коэффициент 562,7, тест Бокса-Люнга, p <0,001; пик 2: 0,108, стандартная ошибка 0,009, коэффициент 1928,0, тест Бокса-Люнга, p <0,001). Этот двойной пик был подтвержден с использованием критерия знакового ранга Уилкоксона ( p = 0,001), подтверждающего сезонное распределение ЛГ. Сезонная декомпозиция была применена с ARIMA (0,0,0), обнаружив среднее значение 3,91 и стандартную ошибку 0,54, сигма 2 оценила 3,29 с логарифмической вероятностью = -19,62, AIC = 43.23 и BIC = 43,84. LH не показал каких-либо значимых тенденций в течение многих лет (Рисунок 3B). Этот результат был подтвержден, учитывая только последний год наблюдений (сигма 2 , оценка 3,11 с логарифмической вероятностью = -18,30). Было очевидно сезонное распределение (рис. 3А) с двумя годовыми пиками. Средние уровни ЛГ подтвердили различное распределение по сезонам ( p <0,001), с двумя пиками в год, весной и осенью, соответственно (Рисунок 4, Таблица 1). Действительно, уровни ЛГ в сыворотке крови были значительно выше весной по сравнению с летом и зимой ( p = 0.004 и p <0,001 соответственно) и осенью по сравнению с зимой и летом ( p = 0,044 и p <0,001 соответственно) (рисунок 4, таблица 1).
Рисунок 3 . Анализ распределения уровней лютеинизирующего гормона (ЛГ) с использованием модели авторегрессионного интегрированного скользящего среднего (ARIMA). (A) Показывает распределение данных по годам с указанием возможных пиков и надира. (B) Показывает тенденцию данных, собранных за годы наблюдения.
Рисунок 4 . Сравнение средних уровней лютеинизирующего гормона (ЛГ) в сыворотке по сезонам. Сравнение проводилось с помощью теста Краскела – Уоллиса. * Определяет самые высокие уровни ЛГ в сыворотке при апостериорном тесте Тьюки .
Что касается ФСГ, автокорреляционные функции не обнаружили значимых пиков. В качестве подтверждения, ARIMA не выделила какого-либо сезонного распределения ФСГ (среднее значение 3,82, стандартная ошибка 0,44, оценка сигма 2 2,14, логарифм правдоподобия = -17.47, AIC = 38,93 и BIC = 39,54), а тест Бокса-Люнга не обнаружил какого-либо значимого сезонного распределения (X-квадрат = 9,44, степени свободы = 8, p = 0,306). Различия средних уровней ФСГ между сезонами подтвердили отсутствие сезонности ( p = 0,202) (Таблица 1).
С учетом возраста пациентов были созданы следующие квартили: (i) от 18 до 35 лет (группа 1 — данные 3145), (ii) от 35,1 до 48 лет (данные группы 2 2880), (iii) от 48,1 до 57 лет. лет (группа 3 — данные 3310) и (iv) старше 57 лет.1 год (группа 4 — данные 2698). В первой группе ЛГ и тестостерон не различались по сезонам ( p = 0,773 и p = 0,301 соответственно). Во 2-й группе уровень ЛГ значительно различается в зависимости от сезона ( p <0,001), подтверждая самые высокие уровни весной и осенью ( p <0,001 и p = 0,005, соответственно). Однако годовой пик тестостерона не подтвердился ( p = 0,060). В группе 3 подтверждены сезонные различия как тестостерона, так и ЛГ ( p = 0.004 и p = 0,002 соответственно). При апостериорном анализе самые высокие уровни тестостерона были обнаружены летом ( p = 0,002), а самые высокие уровни ЛГ весной и осенью ( p = 0,004 и p = 0,006, соответственно). Наконец, в группе 4 не было обнаружено сезонных различий ни для тестостерона, ни для ЛГ ( p = 0,155 и p = 0,080 соответственно).
Что касается анализа спермы, для оценки сезонности использовалась концентрация сперматозоидов.Функция автокорреляции не обнаружила значимых пиков, и в тесте Бокса-Люнга не было обнаружено сезонности ( p = 0,402). Наконец, PRL не показал никаких сезонных колебаний ( p = 0,421), без значительных различий между сезонами ( p = 0,181).
Корреляции между гормонами
Возраст пациентов был обратно пропорционален уровню тестостерона в сыворотке ( R = -0–148, p <0,001) и напрямую связан с ЛГ ( R = 0.185, p <0,001) и ФСГ ( R = 0,281, p <0,001). Как и ожидалось, уровни общего тестостерона в сыворотке были напрямую связаны с ЛГ ( R = 0,147, p <0,001), но не с ФСГ ( R = -0,006, p = 0,482). Наконец, ЛГ был напрямую связан с ФСГ ( R = 0,538, p <0,001). Метод внутренней 5-кратной перекрестной проверки подтвердил значительный результат, полученный обычным статистическим анализом.Корреляции между параметрами спермы и половыми гормонами не обнаружено.
Влияние окружающей среды на сезонность
Уровни тестостерона в сыворотке крови находились в пределах лабораторного эталонного диапазона (2,2–8,7 нг / дл) у 10 905 пациентов (90,6%), в то время как у 311 пациентов (2,6%) и 817 пациентов (6,8%) уровень тестостерона был ниже или выше эталонного диапазона. . Хотя сезонность тестостерона оставалась статистически значимой, учитывая только данные в пределах референсного диапазона, значительный зенит не был обнаружен по средним различиям между сезонами ( p = 0.288) (Таблица 2), предполагая, что значительная сезонная изменчивость очевидна, включая значения, которые выходят за пределы лабораторного референсного диапазона. Напротив, сезонность ЛГ была подтверждена для данных в пределах контрольного диапазона (1–9 МЕ / л), а более высокие уровни были подтверждены весной и осенью (Таблица 2) ( p = 0,001).
Таблица 2 . Уровни гормонов в сыворотке за четыре сезона в годы исследования с учетом только гормонов в пределах лабораторных эталонных диапазонов.
Уровни
ПРЛ в сыворотке не коррелировали ни с тестостероном (Rho: 0,002, p = 0,804), ни с ЛГ (Rho: 0,005, p = 0,665), ни с ФСГ (Rho: 0,006, p = 0,734). Общий тестостерон в сыворотке был напрямую связан с максимальной, минимальной и средней дневной температурой (Rho: 0,019– p = 0,041, Rho: 0,023– p = 0,011 и Rho: 0,021– p = 0,024, соответственно) (рис. 5), но не влажности (Rho: -0,009, p = 0,340). Более того, уровень тестостерона напрямую зависит от продолжительности светового дня (Rho: 0.021— р = 0,020). LH был напрямую связан с минимальными температурами (Rho: -0,022— p = 0,018), но не с максимальными и средними температурами, влажностью и продолжительностью светового дня (Rho: 0,012— p = 0,173, Rho: 0,016— p ). = 0,089, Rho: 0,012– p = 0,202 и Rho: 0,007– p = 0–467 соответственно). Метод перекрестной проверки подтвердил значительную корреляцию, помимо корреляции между LH и минимальными температурами. Действительно, после перекрестной проверки эта корреляция отсутствовала, что позволяет предположить, что большой объем данных смещает эту корреляцию.ФСГ не был связан с параметрами окружающей среды. Наконец, после сезонного разложения температуры окружающей среды (максимальная, минимальная и средняя температуры) показали значительную тенденцию к повышению с течением времени ( p <0,001). В частности, средняя годовая температура снизилась с 13,13 ± 8,28 ° C в 2010 году до 14,61 ± 7,81 ° C в 2018 году. Таким образом, тенденция к увеличению, обнаруженная в распределении тестостерона, может быть связана с повышением температуры окружающей среды.
Рисунок 5 .Линейная регрессия между уровнем тестостерона в сыворотке и максимальными температурами окружающей среды.
Обсуждение
Мы демонстрируем явные сезонные колебания как ЛГ, так и тестостерона в большой выборке взрослых мужчин. Как и ожидалось, тестостерон напрямую связан с ЛГ, но годовые колебания этих двух гормонов не синхронны. ЛГ показывает двухгодичные колебания, с двумя пиками, достигаемыми весной и осенью, в то время как тестостерон показывает только один летний пик. Более того, годовое изменение тестостерона демонстрирует более широкую изменчивость годовых значений по сравнению с ЛГ, что очевидно, включая уровни ниже и выше лабораторных эталонных диапазонов, в то время как колебания ЛГ остаются независимо от эталонного диапазона.Интересно, что зенит тестостерона достигается по крайней мере через 3 месяца после пика ЛГ, что является возможным поздним следствием весеннего пика ЛГ. Однако, если эта ритмичность отражает связь между гипофизом и яичком, мы должны обнаруживать два пика тестостерона каждый год. Скорее всего, на сезонные колебания тестостерона может в основном влиять окружающая среда. В частности, мы показываем здесь тенденцию к увеличению температуры окружающей среды за годы наблюдений, связанную с повышением уровня тестостерона в сыворотке крови.Более того, когда температура в течение года выше, а световой день самый длинный (например, лето), уровни тестостерона в сыворотке достигают годового зенита. Напротив, сезонность ЛГ, по-видимому, не зависит от окружающей среды, и может быть задействован центральный механизм, возможно, регулирующий сезонные колебания гипоталамического гонадотропин-рилизинг-гормона (ГнРГ). Хорошо известно, что секреция ЛГ является результатом пульсации ГнРГ, регулируемой генами гипоталамических часов, с одной стороны (22), и пульсирующей секрецией кисспептина, с другой стороны (23), который является основным регуляторным механизмом секреции ГнРГ у позвоночных. (24, 25).У сезонно размножающихся животных циркадная и фотопериодическая регуляция нейроэндокринной системы в значительной степени влияет на суточный и полулунный ритм нереста (23). Точно так же у человека предполагается комплексное регулирование гормональной сезонности с участием генератора импульсов эпифиза (26). В частности, секреторный циклический паттерн мелатонина, по-видимому, достаточен для компенсации физиологического секреторного паттерна, который отсутствует у мужчин с врожденным дефицитом ГнРГ (26). Наше исследование не показывает какого-либо влияния продолжительности светового дня на секрецию ЛГ, что предполагает механизм, вероятно, не зависящий от мелатонина.
В литературе 15 клинических испытаний изучали сезонность тестостерона (таблица 3). В 10 исследованиях были обнаружены колебания тестостерона в течение года (66,7%) (28–30, 35–41), причем в большинстве случаев выделен годовой график секреции тестостерона, а двухгодичный характер выявлен только в 3 из 10 исследований (таблица 3), а 5 — нет (27, 31–34). Почти все предыдущие исследования оценивали небольшие группы мужчин, и только 3 исследования рассматривали более тысячи субъектов. Более того, в две из самых многочисленных казуистов по отдельности включались мужчины старшего возраста (32) и моложе (30), тогда как в нашем исследовании мы охватываем всю продолжительность жизни после полового созревания, от 18 до 91 года.Только Свартберг и др. оценили большую когорту, включающую мужчин всех возрастов старше 25 лет (41). Однако сезонная оценка ограничивалась уровнем тестостерона в сыворотке. Для всесторонней оценки сезонной ритмики гипофизарно-гонадной оси требуется не только большое количество взрослых пациентов без возрастных ограничений, но и наличие всех задействованных гормонов. В нашем исследовании мы смогли оценить влияние возраста на сезонные гормональные изменения. Действительно, разделив всю когорту пациентов по возрасту, мы выделяем сезонные изменения у мужчин в возрасте от 35 до 57 лет, тогда как для мужчин моложе 35 лет и старше 57 лет сезонный эффект не проявляется.Это открытие является новым и может объяснить расхождения результатов, представленных в более ранней литературе. Сезонность гормонов теряется через 57 лет, когда происходит прогрессирующее снижение уровня тестостерона, что, вероятно, ограничивает годовые изменения (42).
Таблица 3 . Опубликованы испытания сезонности тестостерона.
Сезонная изменчивость может быть связана с влиянием окружающей среды на репродуктивную систему (4). Доступные исследования, оценивающие колебания тестостерона, неравномерно распределены по всему миру, и до сих пор изучено лишь несколько широт.В этом контексте отсутствие солнечного света в течение длительного периода года, наблюдаемое в странах с высокими широтами (34, 39, 41), может представлять собой смешивающий фактор при оценке гормональной сезонности. Действительно, уже в 1930-х годах было продемонстрировано, что дневные часы солнечного света, минимальная и максимальная температура и влажность влияют на годовые ритмы воспроизводства человека (4), и была высказана предположение о взаимосвязи между секрецией тестостерона и мелатонина (43). Однако после индустриализации люди все больше и больше защищаются как от продолжительности светового дня за счет работы в помещении, так и от температуры окружающей среды за счет отопления и кондиционирования воздуха.Эти изменения в жизненных привычках могут привести к «десезонизации» воспроизводства человека и, возможно, к колебаниям тестостерона. Однако, как показано на примере большинства исследованных на данный момент промышленно развитых групп населения, мы подтверждаем постоянство годового графика колебаний тестостерона. Более того, мы подтверждаем корреляцию между тестостероном и температурой окружающей среды, учитывая максимальные, минимальные и среднесуточные значения. При повышении температуры окружающей среды тестостерон повышается, достигая максимальных значений летом.В этих условиях имеется множество доказательств пагубного влияния местного тепла на активность и выживаемость клеток Лейдига в моделях на животных (44, 45). В частности, тепловое повреждение яичек опосредуется активацией определенных путей апоптоза в моделях на животных (46, 47). Однако о возможном влиянии температуры окружающей среды на активность клеток Лейдига у человека известно меньше. Здесь мы обнаруживаем прямую линейную корреляцию между тестостероном и температурой окружающей среды, предполагая, что низкие температуры окружающей среды могут быть менее благоприятными для стероидогенеза яичек.
Помимо сезонных колебаний, тестостерон демонстрировал значительную тенденцию к увеличению в течение многих лет, с 2010 по 2018 год. Эту тенденцию можно объяснить повышением температуры окружающей среды, зарегистрированным в годы исследования. Действительно, мы продемонстрировали прямую связь между тестостероном и температурой окружающей среды в нашей когорте. Соответственно, температура окружающей среды повысилась за 9-летний интервал исследования, в среднем на 1,48 ° C. Это повышение происходит вместе со средним повышением тестостерона на 0.44 нг / дл обнаружено после 9 лет оценки.
В нашей когорте уровень ФСГ не колеблется, и сезонное изменение параметра сперматозоидов не обнаружено. Однако анализ спермы был доступен только у 2,6% от всей группы, что ограничивает статистическую мощность. Действительно, увеличивая размер выборки (5 573 анализа спермы), мы ранее выявили сезонность спермы с более высоким количеством сперматозоидов зимой / весной по сравнению с летом / осенью (48). Более того, в этой предыдущей работе была очевидна значимая корреляция между анализом спермы и параметрами окружающей среды (48).Таким образом, необходим более крупный набор данных, содержащий как анализ спермы, так и оценку гормонов, чтобы полностью понять влияние окружающей среды на воспроизводство в разные сезоны.
У нашего исследования есть свои сильные стороны. Мы оценили (i) большое количество мужчин, (ii) живущих на одной и той же широте, (iii) в течение длительного временного интервала, (iv) без известных заболеваний, влияющих на ось гипоталамус-гипофиз-гонад, и (v) учитывая уровни тестостерона и гонадотропинов в сыворотке крови. Однако следует учитывать несколько ограничений.Во-первых, пациенты оценивались только один раз, поэтому продольная оценка изменений тестостерона у одного и того же пациента невозможна. Во-вторых, уровни тестостерона в сыворотке определялись с использованием имеющихся в продаже наборов, а не тандемной масс-спектрометрии жидкостной хроматографии (ЖХ-МС / МС), соответствующей золотому стандарту. В-третьих, нет информации о функции печени. Таким образом, мы не можем рассматривать возможные изменения глобулина, связывающего половые гормоны (ГСПГ), и, следовательно, отражаются ли эти колебания в сезонном изменении биодоступного тестостерона.Наконец, анализ спермы был доступен только в небольшой подгруппе пациентов, и общая оценка сезонности ФСГ и параметров спермы вместе не допускается. Точная оценка сезонного влияния на сперматогенез может пролить свет на возможную остаточную роль воздействия окружающей среды с точки зрения репродуктивного преимущества. В этом контексте могут быть задействованы одновременные колебания андрогенов, которые могут влиять на либидо для оптимизации зачатий.
Выводы
В заключение, наши результаты демонстрируют двухгодичные / годовые колебания сывороточного ЛГ и тестостерона, предполагая сезонное влияние на гипофизарно-гонадную ось у человека.Ежегодные колебания тестостерона и ЛГ, возможно, подвержены различным механизмам регуляции (центральным для ЛГ по сравнению с окружающей средой для тестостерона). Учитывая ограниченную амплитуду колебаний тестостерона и ЛГ в течение года, отсутствие сезонности в самых молодых и старших возрастных группах и меньшее воздействие факторов окружающей среды в индустриальную эпоху, мы могли бы предположить, что предковый секреторный паттерн адаптируется к сезонам в различные виды животных (постепенно?) исчезают в человеке.
Заявление о доступности данных
Данные, подтверждающие выводы этого исследования, доступны по запросу у соответствующего автора. Данные не являются общедоступными из-за конфиденциальности или этических ограничений.
Заявление об этике
Этическое одобрение не было предоставлено для этого исследования с участием людей, поскольку, учитывая ретроспективный дизайн исследования с использованием больших данных, было невозможно получить информированное согласие от всех участников, включенных в исследование, но все исследования были одобрены Управлением больницы Баггиовары. , поскольку данные были собраны анонимно.Письменное информированное согласие на участие не требовалось для этого исследования в соответствии с национальным законодательством и институциональными требованиями.
Авторские взносы
DS задумал исследование, проанализировал данные и написал рукопись. GS проанализировал данные и написал рукопись. MSe координировала извлечение данных. ST и TT провели лабораторные исследования. AG и MSi написали рукопись. Все авторы отредактировали рукопись или критически отредактировали ее с учетом важного интеллектуального содержания и одобрили окончательный вариант.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
1. Несовершеннолетние Д.С., Уотерхаус Дж. М.. Зафиксируйте сон как синхронизатор ритмов ненормального распорядка. Int J Chronobiol. (1981) 7: 165–88.
Google Scholar
2. Несовершеннолетние Д.С., Уотерхаус Дж. М.. Эндогенные и экзогенные компоненты циркадных ритмов при 21-часовом дне. Int J Chronobiol. (1981) 8: 31–48.
Google Scholar
3. Wehr TA. Фотопериодизм у людей и других приматов: доказательства и последствия. Дж Биол Ритмы . (2001) 16: 348–64. DOI: 10.1177 / 07487300112
60
CrossRef Полный текст | Google Scholar
4. Роеннеберг Т., Ашофф Дж. Годовой ритм воспроизводства человека: II. Корреляции с окружающей средой J Biol Rhythms . (1990) 5: 217–39. DOI: 10.1177 / 0748730400304
CrossRef Полный текст | Google Scholar
6.Дой М., Хираяма Дж., Сассоне-Корси П. Циркадный регулятор ЧАСОВ — это гистонацетилтрансфераза. Ячейка . (2006) 125: 497–508. DOI: 10.1016 / j.cell.2006.03.033
CrossRef Полный текст | Google Scholar
7. Хираяма Дж., Сахар С., Гримальди Б., Тамару Т., Такамацу К., Накахата Ю. и др. CLOCK-опосредованное ацетилирование BMAL1 контролирует циркадную функцию. Природа . (2007) 450: 1086–90. DOI: 10.1038 / nature06394
CrossRef Полный текст | Google Scholar
8.Дибнер Ч., Шиблер У., Альбрехт У. Система циркадного времени млекопитающих: организация и координация центральных и периферических часов. Анну Рев Физиол . (2010) 72: 517–49. DOI: 10.1146 / annurev-Physiol-021909-135821
CrossRef Полный текст | Google Scholar
9. Li Y, Li G, Wang H, Du J, Yan J. Анализ генного регуляторного каскада, опосредующего циркадный ритм у рыбок данио. PLoS Компьютер Биол . (2013) 9: e1002940. DOI: 10.1371 / journal.pcbi.1002940
CrossRef Полный текст | Google Scholar
10.Кованен Л., Саарикоски С.Т., Аромаа А., Лоннквист Дж., Партонен Т. Варианты генов ARNTL (BMAL1) и NPAS2 способствуют фертильности и сезонности. PLoS ONE. (2010) 5: e10007. DOI: 10.1371 / journal.pone.0010007
CrossRef Полный текст | Google Scholar
11. Урбански Х.Ф. Роль циркадных нейроэндокринных ритмов в контроле поведения и физиологии. Нейроэндокринология . (2011) 93: 211–22. DOI: 10.1159 / 000327399
CrossRef Полный текст | Google Scholar
12.КТО. Лабораторное руководство ВОЗ по исследованию и обработке спермы человека. ВОЗ (2010).
Google Scholar
13. Дженсен Р.Л., Кляйн Г.М. Метод перекрестной проверки передискретизации в науке о физических упражнениях: моделирование силы гребли. Медико-спортивные упражнения . (1994) 26: 929–33. DOI: 10.1249 / 00005768-19
00-00019
CrossRef Полный текст | Google Scholar
14. Шимодаира Х. Перекрестная проверка корреляционного анализа сопоставления путем повторной выборки сопоставимых весов. Нейронная сеть . (2016) 75: 126–40. DOI: 10.1016 / j.neunet.2015.12.007
CrossRef Полный текст | Google Scholar
15. Ke Z, Zhang ZJ. Проверка автокорреляции и частичной автокорреляции: асимптотические методы в сравнении с методами повторной выборки. Br J Math Stat Psychol . (2018) 71: 96–116. DOI: 10.1111 / bmsp.12109
CrossRef Полный текст | Google Scholar
16. Батт Р.Д., Исон Т., Гарместани А. Временной масштаб потери устойчивости: последствия для управления критическими изменениями качества воды. PLoS ONE. (2019) 14: e0223366. DOI: 10.1371 / journal.pone.0223366
CrossRef Полный текст | Google Scholar
17. Box GE, Jenkins GM. Анализ временных рядов: прогнозирование и управление . Энглвудские скалы: Прентис-холл (1994).
Google Scholar
18. Кордер Г.В., Бригадир Д.И. Непараметрическая статистика: Пошаговый подход . Хобокен, Нью-Джерси (2014).
Google Scholar
19. Джайн Р.К., Шарма Р.Д., Джайн С.Применение модели ARIMA для корректировки сезонных и несезонных колебаний рождаемости в Онтарио. Род. (1985) 41: 127–33.
Google Scholar
20. Дженсен Л. Руководство по применению моделей ARIMA во временных рядах. Рес Нурс Здоровье . (1990) 13: 429–35. DOI: 10.1002 / nur.4770130611
CrossRef Полный текст | Google Scholar
21. Делавари Форутаге М., Мохаммадзаде Могхаддам А., Факур В. Временные тенденции в гендерной заболеваемости дорожно-транспортными травмами в Иране. PLoS ONE. (2019) 14: e0216462. DOI: 10.1371 / journal.pone.0216462
CrossRef Полный текст | Google Scholar
22. Simoni M, Montanini V, Fustini MF, Del Rio G, Cioni K, Marrama P. Циркадный ритм тестостерона в плазме у мужчин с идиопатическим гипогонадотропным гипогонадизмом до и во время пульсирующего введения гонадотропин-высвобождающего гормона. Clin Endocrinol. (1992) 36: 29–34. DOI: 10.1111 / j.1365-2265.1992.tb02899.x
CrossRef Полный текст | Google Scholar
23.Андо Х., Огава С., Шахджахан М., Икегами Т., Дои Х., Хаттори А. и др. Суточные и циркадные колебания в экспрессии генов кисспептина, рецептора кисспептина и гонадотропин-рилизинг-гормона 2 у травянистого фугу, полулунно-синхронизированного производителя. Дж. Нейроэндокринол . (2014) 26: 459–67. DOI: 10.1111 / jne.12165
CrossRef Полный текст | Google Scholar
24. Хуссейн М.А., Сонг В.Дж., Вулф А. Есть кисспептин — и еще есть кисспептин. Тенденции Эндокринол Метаб .(2015) 26: 564–72. DOI: 10.1016 / j.tem.2015.07.008
CrossRef Полный текст | Google Scholar
25. Андо Х., Шахджахан М., Китахаши Т. Периодическая регуляция экспрессии генов кисспептина, гормона, ингибирующего гонадотропин, и их рецепторов в травяной фугу: влияние на сезонные, суточные и лунные ритмы воспроизводства. Gen Comp Эндокринол . (2018) 265: 149–53. DOI: 10.1016 / j.ygcen.2018.04.006
CrossRef Полный текст | Google Scholar
26.Любошицкий Р., Херер П., Лави П. Пульсирующие паттерны секреции мелатонина у пациентов с дефицитом гонадотропин-рилизинг-гормона: эффекты лечения тестостероном. Дж. Шишковидная рез. . (1997) 22: 95–101. DOI: 10.1111 / j.1600-079X.1997.tb00309.x
CrossRef Полный текст | Google Scholar
27. Abbaticchio G, de Fini M, Giagulli VA, Santoro G, Vendola G, Giorgino R. Циркулярные ритмы репродуктивных функций мужчин, корреляции между гормонами и гормонозависимыми параметрами. Андрология . (1987) 19: 353–61. DOI: 10.1111 / j.1439-0272.1987.tb02314.x
CrossRef Полный текст | Google Scholar
28. Bellastella A, Criscuolo T, Mango A, Perrone L, Sinisi AA, Faggiano M. Циркулярные ритмы плазменного лютеинизирующего гормона, фолликулостимулирующего гормона, тестостерона, пролактина и кортизола в препубертатном периоде. Clin Endocrinol. (1983) 19: 453–9. DOI: 10.1111 / j.1365-2265.1983.tb00019.x
CrossRef Полный текст | Google Scholar
29.Bellastella G, Pane E, Iorio S, De Bellis A, Sinisi AA. Сезонные колебания уровней гонадотропина, пролактина и тестостерона в плазме при первичном и вторичном гипогонадизме: доказательства независимой роли яичек. Дж Эндокринол Инвест . (2013) 36: 339–42. DOI: 10.3275 / 8620
CrossRef Полный текст | Google Scholar
30. Dabbs JM Jr. Возраст и сезонные колебания концентрации тестостерона в сыворотке у мужчин. Chronobiol Int. (1990) 7: 245–9. DOI: 10.3109/0742052
56982
CrossRef Полный текст | Google Scholar
31. Dai WS, Kuller LH, LaPorte RE, Gutai JP, Falvo-Gerard L, Caggiula A. Эпидемиология уровней тестостерона в плазме у мужчин среднего возраста. Am J Epidemiol . (1981) 114: 804–16. DOI: 10.1093 / oxfordjournals.aje.a113251
CrossRef Полный текст | Google Scholar
32. Ли Д.М., Тахар А., Пай С.Р., Бунен С., Вандершуерен Д., Буйон Р. и др. Связь гипогонадизма со статусом витамина D: Европейское исследование мужского старения. евро J Эндокринол . (2012) 166: 77–85. DOI: 10.1530 / EJE-11-0743
CrossRef Полный текст | Google Scholar
33. Маес М., Моммен К., Хендрикс Д., Петерс Д., Д’Хонд П., Ранджан Р. и др. Компоненты биологической изменчивости, включая сезонность, в концентрациях в крови ТТГ, ТТ3, FT4, ПРЛ, кортизола и тестостерона у здоровых добровольцев. Clin Endocrinol. (1997) 46: 587–98. DOI: 10.1046 / j.1365-2265.1997.1881002.x
CrossRef Полный текст | Google Scholar
34.Мартикайнен Х., Тапанайнен Дж., Ваккури О., Леппалуото Дж., Хухтаниеми И. Циркулярные концентрации мелатонина, гонадотропинов, пролактина и гонадных стероидов у мужчин в географической области с большими годовыми колебаниями дневного света. Acta Endocrinol. (1985) 109: 446–50. DOI: 10.1530 / acta.0.10
CrossRef Полный текст | Google Scholar
35. Meriggiola MC, Noonan EA, Paulsen CA, Bremner WJ. Годовые показатели лютеинизирующего гормона, фолликулостимулирующего гормона, тестостерона и ингибина у нормальных мужчин. Репродукция Человека . (1996) 11: 248–52. DOI: 10.1093 / HUMREP / 11.2.248
CrossRef Полный текст | Google Scholar
36. Николау Г. Ю., Хаус Е., Лакатуа Д. Д., Богдан С., Сакет-Лундин Л., Попеску М. и др. Циркадные и суточные колебания ФСГ, ЛГ, тестостерона, дегидроэпиандростерона сульфата (ДГЭА-S) и 17-гидроксипрогестерона (17 ОН-прог) у пожилых мужчин и женщин. Эндокринология . (1985) 23: 223–46.
Google Scholar
37. Перри HMIII, Миллер Д.К., Патрик П., Морли Дж. Э..Тестостерон и лептин у пожилых афроамериканских мужчин: отношение к возрасту, силе, функциям и сезону. Метаболизм . (2000) 49: 1085–91. DOI: 10.1053 / мета.2000.7710
CrossRef Полный текст | Google Scholar
38. Рейнберг А., Смоленский М. Х., Халлек М., Смит К. Д., Стейнбергер Э. Годовые колебания характеристик спермы и уровней гормонов в плазме у мужчин, перенесших вазэктомию. Фертил Стерил . (1988) 49: 309–15. DOI: 10.1016 / S0015-0282 (16) 59721-0
CrossRef Полный текст | Google Scholar
39.Sawhney RC, Malhotra AS, Prasad R, Pal K, Kumar R, Bajaj AC. Гипофизарно-гонадные гормоны при длительном проживании в Антарктиде. Инт Дж. Биометеорол . (1998) 42: 51–4. DOI: 10.1007 / s004840050083
CrossRef Полный текст | Google Scholar
40. Smals AG, Kloppenborg PW, Benraad TJ. Круговой цикл уровня тестостерона в плазме у человека. Дж Клин Эндокринол Метаб . (1976) 42: 979–82. DOI: 10.1210 / jcem-42-5-979
CrossRef Полный текст | Google Scholar
41.Свартберг Дж., Хорде Р., Сундсфьорд Дж., Бонаа К. Х., Барретт-Коннор Э. Сезонные колебания тестостерона и соотношения талии и бедер у мужчин: исследование Тромсё. Дж Клин Эндокринол Метаб . (2003) 88: 3099–104. DOI: 10.1210 / jc.2002-021878
CrossRef Полный текст | Google Scholar
42. Зиркин Б.Р., Теновер Ж.Л. Старение и снижение уровня тестостерона: прошлое, настоящее и надежды на будущее. Дж Андрол . (2012) 33: 1111–8. DOI: 10.2164 / jandrol.112.017160
CrossRef Полный текст | Google Scholar
43.Любошицкий Р., Леви М., Шен-Орр З., Блюменфельд З., Херер П., Лави П. Длительное введение мелатонина не влияет на секрецию гипофизарно-гонадных гормонов у нормальных мужчин. Репродукция Человека . (2000) 15: 60–5. DOI: 10.1093 / humrep / 15.1.60
CrossRef Полный текст | Google Scholar
44. Кантер М., Актас С. Влияние гипертермии мошонки на клетки Лейдига в долгосрочной перспективе: гистологическое, иммуногистохимическое и ультраструктурное исследование на крысах. Дж Молистол . (2009) 40: 123–30.DOI: 10.1007 / s10735-009-9222-5
CrossRef Полный текст | Google Scholar
45. Ким Дж. Х., Пак С. Дж., Ким Т. С., Ким Дж. М., Ли Д.С. Продукция тестостерона опухолевой клеточной линией Лейдига подавляется вызванным гипертермией стрессом эндоплазматического ретикулума у мышей. Наука о жизни . (2016) 146: 184–91. DOI: 10.1016 / j.lfs.2015.12.042
CrossRef Полный текст | Google Scholar
46. Yin Y, DeWolf WC, Morgentaler A. Экспериментальный крипторхизм индуцирует апоптоз тестикулярных зародышевых клеток с помощью p53-зависимых и -независимых путей у мышей. Биол Репрод . (1998) 58: 492–6. DOI: 10.1095 / biolreprod58.2.492
CrossRef Полный текст | Google Scholar
47. Yin Y, Stahl BC, DeWolf WC, Morgentaler A. P53 и Fas являются последовательными механизмами апоптоза половых клеток яичка. Дж Андрол . (2002) 23: 64–70. DOI: 10.1002 / jand.2002.23.1.64
CrossRef Полный текст | Google Scholar
48. Санти Д., Маньяни Э., Микеланджели М., Грасси Р., Векки Б., Педрони Г. и др. Сезонные колебания параметров спермы коррелируют с температурой окружающей среды и загрязнением воздуха: анализ больших данных за 6 лет. Загрязнение окружающей среды . (2018) 235: 806–13. DOI: 10.1016 / j.envpol.2018.01.021
CrossRef Полный текст | Google Scholar
СЕЗОННЫХ ИЗМЕНЕНИЙ ПОЛОВОЙ АКТИВНОСТИ И УРОВНЕЙ ЛГ И ТЕСТОСТЕРОНА СЫВОРОТКИ В ФИНСКИХ ЛАНДРЕСАХ И СУФФОЛКЕ
% PDF-1.7
%
1 0 объект
> / Metadata 2 0 R / Outlines 6 0 R / Pages 3 0 R / StructTreeRoot 7 0 R / Type / Catalog / Viewer Настройки >>>
эндобдж
5 0 obj
> / Шрифт >>> / Поля [11 0 R] >>
эндобдж
2 0 obj
> поток
application / pdf
Prince 12.5 (www.princexml.com) AppendPDF Pro 6.0 Linux Kernel 2.6 64bit 18 мая 2016 Библиотека 10.1.0Appligent AppendPDF Pro 6.02019-10-25T01: 44: 01-07: 002019-10-25T01: 44: 01-07: 002019 -10-25T01: 44: 01-07: 001uuid: e430081c-acca-11b2-0a00-58f1b0000000uuid: e430081e-acca-11b2-0a00-a01696ccfe7f
конечный поток
эндобдж
6 0 obj
>
эндобдж
3 0 obj
>
эндобдж
7 0 объект
>
эндобдж
22 0 объект
>
эндобдж
23 0 объект
>
эндобдж
26 0 объект
> 1] / P 45 0 R / Pg 14 0 R / S / Ссылка >>
эндобдж
27 0 объект
> 2] / P 24 0 R / Pg 14 0 R / S / Ссылка >>
эндобдж
28 0 объект
>> 3 4] / P 24 0 R / Pg 14 0 R / S / Ссылка >>
эндобдж
36 0 объект
> 14] / P 35 0 R / Pg 14 0 R / S / Ссылка >>
эндобдж
39 0 объект
> 18] / P 38 0 R / Pg 14 0 R / S / Ссылка >>
эндобдж
42 0 объект
> 24] / P 40 0 R / Pg 14 0 R / S / Ссылка >>
эндобдж
40 0 объект
>
эндобдж
14 0 объект
> / MediaBox [0 0 612 792] / Parent 3 0 R / Resources> / Font> / ProcSet [/ PDF / Text / ImageC] / XObject >>> / StructParents 0 / Tabs / S / Type / Page >>
эндобдж
54 0 объект
[44 0 R 47 0 R 49 0 R 50 0 R 51 0 R 52 0 R 53 0 R]
эндобдж
55 0 объект
> поток
xXmoGίX} 7b
-ƩQp6`pHr / qT s {3 ‘y5 ~ zHk> -7ɛ7imnU / zFw | Hi’t’iuL͛E 鄌 hpFw ٴ ьV8y «; 2nWUZQe)
CrFb / vYov $ D’S «d2`E @ ‡ ‘LI ۅ Q ؍ $ w
Сезонные колебания уровня тестостерона в плазме и суточной активности песен у свободно живущих самцов больших сисек
Реферат
Годовой курс уровня тестостерона (Т) плазмы и Активность песни в течение дня была исследована у свободноживущих самцов большой синицы ( Parus major ) в течение одного года и в одной популяции.Мы проводим первое исследование этого вида, изучающее плазму T в течение сезона размножения между стадиями размножения и внутри них. Как и ожидалось для моногамных видов умеренной зоны, уровни тестостерона в плазме продемонстрировали ярко выраженный пик в марте в начале сезона размножения и быстро снижались после этого до умеренных уровней в родительской фазе. Пиковые уровни T в плазме совпадали с периодом интенсивной территориальности, но не поддерживались в период откладки яиц, что позволяет предположить, что годовой пик T больше связан с территориальностью, чем с фертильностью самца или утренней песней.После базальных уровней T в плазме летом и осенью, уровни T начали расти с декабря, что, возможно, связано с повторным появлением территориальности и парообразования в начале зимы. На стадии кормления самцы, размножающиеся в конце сезона, имели более низкие уровни Т, чем самцы, размножающиеся раньше, независимо от возраста птенцов, состояния самцов или процента фертильных самок в популяции. Кроме того, на стадии птенцов уровни тестостерона увеличивались по мере того, как птенцы становились старше, при этом учитывались время сезона, состояние тела самцов и наличие фертильных самок.Годовой T-образный график сильно коррелировал с годовым графиком дневной активности песни в популяции. Однако небольшое возобновление осенью дневной певческой активности в популяции не сопровождалось заметным увеличением Т в плазме отловленных самцов. Пиковые уровни T в плазме не наблюдались на стадии кладки яиц, когда активность утренней песни максимальна, что позволяет предположить, что между ними нет сильной причинно-следственной связи.
Ключевые слова
Parus major
Большая синица
Тестостерон
Песня
Сезонность
Годовой цикл
Половой отбор
Рекомендуемые статьи Цитирующие статьи (0)
Copyright © 2003 Elsevier Science (США).Все права защищены.
Рекомендуемые статьи
Цитирующие статьи
Сезонные изменения сывороточных гонадотропинов и тестостерона у мужчин, выявленные на основе большого набора данных реальных наблюдений за девять лет | ECE2020 | 22-й Европейский Конгресс эндокринологов
1 Отделение эндокринологии, Отделение медицинских специальностей, Azienda Ospedaliero-Universitaria of Modena, Ospedale Civile Baggiovara, Модена, Италия; 2 Служба клинической инженерии, Azienda Ospedaliero-Universitaria, Модена, Модена, Италия; 3 Отделение лабораторной медицины и анатомической патологии, Azienda USL Модены, Модена, Италия; 4 Отделение эндокринологии, Отделение биомедицинских, метаболических и невральных наук, Университет Модены и Реджио-Эмилия, Модена, Италия
Предпосылки: Ритмичность окружающей среды, по-видимому, может влиять на ось гипоталамус-гипофиз-гонад у животных для достижения репродуктивных преимуществ.Однако противоречивые результаты были получены при оценке зависящей от окружающей среды ритмичности секреции репродуктивных гормонов у людей.
Цель исследования: это исследование было разработано для оценки сезонных колебаний основных гормонов, участвующих в системе гипоталамус-гипофиз-гонад у мужчин, с использованием подхода больших данных.
Методы: было проведено наблюдательное, ретроспективное исследование с использованием больших данных, включая все измерения тестостерона, лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ), проведенные в одной лаборатории в период с января 2010 по январь 2019 года с использованием иммунохемилюминесцентного иммуноанализа .Субъекты, представившие какой-либо известный фактор, влияющий на ось гипоталамус-гипофиз-гонад, были исключены из анализов. Однако, согласно подходу с использованием больших данных, информация об истории болезни субъектов отсутствовала, а была доступна только диагностическая причина для биохимических исследований. Тенденции и сезонные распределения были проанализированы с использованием моделей авторегрессионного интегрированного скользящего среднего (ARIMA).
Результаты: Всего 12,033 данных, что составляет 7,491 мужчин (средний возраст 47,46 ± 13 лет).51 год, диапазон 18–91 год). Средние уровни тестостерона в сыворотке (5,34 ± 2,06 нг / дл, диапазон 1,70–15,80 нг / дл) показали сезонное распределение с более высокими уровнями летом ( P = 0,008). Прямая зависимость между уровнем тестостерона и максимальной, минимальной и средней температурой (Rho: 0,019, P = 0,041; Rho: 0,023, P = 0,011; Rho: 0,021, P = 0,024, соответственно) и продолжительностью светового дня ( Rho: 0,021, P = 0,020) был выделен. LH (среднее значение 4.64 ± 2,54 МЕ / л, диапазон 1,00–15,00 МЕ / л) имели два пика секреции осенью и весной ( P = 0,001 и P = 0,001 соответственно), независимо от параметров окружающей среды. Сезонного распределения не наблюдалось, учитывая уровни сывороточного ФСГ (в среднем 5,51 ± 3,24 МЕ / л).
Выводы: явные сезонные колебания как ЛГ, так и тестостерона были продемонстрированы в большой когорте взрослых мужчин, хотя годовая сезонность гипоталамо-гипофизарно-гонадных гормонов у людей не могла быть строго эволюционно необходимой.Сезонность тестостерона кажется независимой от колебаний ЛГ, которые могут регулироваться циклической экспрессией центральных генов, и более чувствительна к температуре окружающей среды и продолжительности светового дня.
Сезонные колебания эстрадиола, фолликулостимулирующего гормона и дегидроэпиандростерона сульфата у женщин и мужчин | Журнал клинической эндокринологии и метаболизма
Аннотация
Контекст: Сезонные колебания дневного света регулируют воспроизводство у животных, живущих на более высоких широтах, но влияние сезона на половые гормоны у людей остается неясным.
Цель, план и участники: Популяционное исследование в Тромсё, Норвегия (70 ° с.ш.) включало 1651 женщину и 1540 мужчин в возрасте от 25 до 84 лет. Циркулирующий общий эстрадиол (и рассчитанные свободные уровни), ФСГ и дегидроэпиандростерон сульфат (ДГЭАС) были измерены в период с сентября 1994 года по сентябрь 1995 года и предоставили уникальную возможность изучить влияние экстремальных сезонных колебаний дневного света на уровни гормонов в арктической популяции.
Основной показатель результата: Были измерены циркулирующие общий и свободный эстрадиол, ФСГ и ДГЭАС.
Результаты: Общий и свободный эстрадиол показали различия между среднемесячными средними значениями, с пиком в июне у женщин в постменопаузе ( P <0,001) и в мае у мужчин ( P = 0,002 и P <0,001). ковариационный анализ. По данным косинор-анализа сезонные колебания общего и свободного эстрадиола были очевидны у женщин ( P = 0,02 и P = 0,03) и мужчин ( P = 0,004 и P = 0,001), но только 0,2–0,9 % вариации общего и свободного эстрадиола объясняется сезоном.ФСГ и ДГЭАС не показали явных сезонных колебаний у обоих полов.
Выводы: Сезонные колебания следует учитывать при разработке исследований и интерпретации результатов измерений эстрадиола, чтобы избежать систематической ошибки в сравнительных исследованиях.
ПОЛОВЫХ ГОРМОНОВ участвуют в патофизиологии распространенных заболеваний, таких как хрупкие переломы и рак (1, 2), поэтому важно понимать факторы, влияющие на их уровни. Для всех гормонов характерна некоторая ритмичная секреция, и уровень их может меняться в течение года.Сезонные колебания дневного света регулируют воспроизводство у животных, живущих на более высоких широтах (3, 4), тогда как влияние сезона на половые гормоны у людей остается неясным (5-8).
Если половые гормоны систематически различаются по сезонам в некоторых регионах или для некоторых субъектов, это может вызвать ошибочную классификацию в сравнительных исследованиях. Однако в большинстве исследований, связанных с измерением гормонов, время измерения не учитывается при планировании исследований или интерпретации результатов (9).Имеется мало информации о сезонных колебаниях уровней эстрадиола, ФСГ и дегидроэпиандростерона сульфата (ДГЭАС) у обоих полов. Несмотря на продольный дизайн, который придает им определенную силу, предыдущие исследования либо небольшие (n = 10–27), либо основаны на выбранной популяции больниц, а результаты противоречивы (10–17). Насколько нам известно, сезонные колебания циркулирующих эстрадиола, ФСГ или ДГЭАС не изучались в популяционных исследованиях.
Тромсё, Норвегия, расположен на 70 ° с.ш., и здесь наблюдаются резкие колебания дневного света.Солнце находится за горизонтом с 28 ноября по 15 января и не заходит с 17 мая по 26 июля. Таким образом, это исследование предоставило уникальную возможность проверить гипотезу о том, что экстремальные сезонные колебания дневного света влияют на уровень половых гормонов в организме человека. женщины и мужчины, живущие на высоких широтах.
Объекты и методы
Субъекты
Исследование остеопороза в Тромсё (TROST) является частью исследования в Тромсё, одноцентрового популяционного проспективного исследования города Тромсё на севере Норвегии.В период с сентября 1994 г. по сентябрь 1995 г. TROST измерил плотность костной ткани у 7948 человек в возрасте от 25 до 84 лет (процент ответа 78%) (18). Среди них для анализа гормонов была отобрана случайная выборка из 3684 человек, и у 3514 из них были образцы крови, доступные для анализа (19). В эту выборку также были включены участники семейного исследования, которые не рассматривались как репрезентативные для населения в целом (20). Однако исключение этих 155 избыточных участников Семейного исследования не повлияло на результаты, поэтому они были сохранены в анализах.Мы исключили 323 участника из-за приема гормональных препаратов (n = 240), беременности (n = 4), статуса перименопаузы (n = 32) или отсутствия значений гормонов (n = 47). Все участники дали информированное письменное согласие. Региональный комитет по этике исследований и Норвежская инспекция данных одобрили исследование.
Были даны ответы на две самостоятельные анкеты. Мы включили информацию о текущем статусе курения, а также о потреблении кофе и алкоголя. Оценка физической активности производилась путем сложения часов умеренной и тяжелой физической активности в неделю, в результате чего часы с тяжелой нагрузкой удваивались: оценка = умеренная + 2 тяжелая.Чтобы максимизировать количество наблюдений, наше определение статуса менопаузы было основано на данных о менструации и возрасте, о которых сообщают пациенты (19). Вкратце, женщины, у которых был менструальный цикл в течение последних 3 месяцев (n = 205) или были моложе 45 лет с отсутствующими данными (n = 25), были определены как пременопаузальные. Женщины, у которых менструация прекратилась более года назад (n = 989) или были в возрасте 54 лет и старше с отсутствующими данными (n = 432), были определены как женщины в постменопаузе. Эти 432 женщины имели средний возраст 70 лет (диапазон 54–83), и 92% из них были в возрасте 60 лет и старше.Таким образом, в исследование были включены 230 женщин в пременопаузе, 1421 женщина в постменопаузе и 1540 мужчин. Никого не пригласили к участию в июле из-за летних каникул (таблица 1).
ТАБЛИЦА 1.
Число участников по месяцам измерения: исследование Тромсё, 1994–1995 гг.
| . | Женщины в пременопаузе . | Женщины в постменопаузе . | Мужчины . | ||
|---|---|---|---|---|---|
| январь | 21 | 142 | 143 | ||
| февраль | 12 | 161 | 162 | ||
| март | 16 | 107 | 115 | ||
| май | 13 | 127 | 142 | ||
| июнь | 8 | 127 | 136 | ||
| 136 | 80 | ||||
| Август | 18 | 148 | 151 | ||
| Сентябрь | 78 | 101 | 88 | ||
| Октябрь | 10 | 152 | 137 | ||
| D декабрь | 16 | 68 | 105 |
| . | Женщины в пременопаузе . | Женщины в постменопаузе . | Мужчины . | ||
|---|---|---|---|---|---|
| январь | 21 | 142 | 143 | ||
| февраль | 12 | 161 | 162 | ||
| март | 16 | 107 | 115 | ||
| май | 13 | 127 | 142 | ||
| июнь | 8 | 127 | 136 | ||
| 136 | 80 | ||||
| Август | 18 | 148 | 151 | ||
| Сентябрь | 78 | 101 | 88 | ||
| Октябрь | 10 | 152 | 137 | ||
| D декабрь | 16 | 68 | 105 |
ТАБЛИЦА 1.
Число участников по месяцам измерения: исследование Тромсё, 1994–1995 гг.
| . | Женщины в пременопаузе . | Женщины в постменопаузе . | Мужчины . | ||
|---|---|---|---|---|---|
| январь | 21 | 142 | 143 | ||
| февраль | 12 | 161 | 162 | ||
| март | 16 | 107 | 115 | ||
| май | 13 | 127 | 142 | ||
| июнь | 8 | 127 | 136 | ||
| 136 | 80 | ||||
| Август | 18 | 148 | 151 | ||
| Сентябрь | 78 | 101 | 88 | ||
| Октябрь | 10 | 152 | 137 | ||
| D декабрь | 16 | 68 | 105 |
| . | Женщины в пременопаузе . | Женщины в постменопаузе . | Мужчины . | ||
|---|---|---|---|---|---|
| январь | 21 | 142 | 143 | ||
| февраль | 12 | 161 | 162 | ||
| март | 16 | 107 | 115 | ||
| май | 13 | 127 | 142 | ||
| июнь | 8 | 127 | 136 | ||
| 136 | 80 | ||||
| Август | 18 | 148 | 151 | ||
| Сентябрь | 78 | 101 | 88 | ||
| Октябрь | 10 | 152 | 137 | ||
| D декабрь | 16 | 68 | 105 |
Измерения
Норвежский метеорологический институт предоставил записи о среднемесячных температурах.Средние часы светового дня в Тромсё в течение периода исследования были рассчитаны как часы между восходом и заходом солнца 15 числа каждого месяца (рис. 1).
Рис. 1.
Среднемесячные геометрические значения с 95% доверительными интервалами общего и свободного эстрадиола, ФСГ и ДГЭАС, скорректированные с учетом возраста, индекса массы тела, курения, употребления алкоголя и кофе, физической активности и избирательного округа ANCOVA в 1421 женщина в постменопаузе и 1540 мужчин. Использовались среднемесячная температура и световой день в середине месяца.Данные взяты из исследования Тромсё за 1994–1995 гг.
Рис. 1.
Среднемесячные геометрические средние с 95% доверительными интервалами общего и свободного эстрадиола, ФСГ и ДГЭАС, скорректированные ANCOVA на возраст, индекс массы тела, курение, употребление алкоголя и кофе, физическую активность и избирательный округ в постменопаузе 1421 женщина и 1540 мужчин. Использовались среднемесячная температура и световой день в середине месяца. Данные взяты из исследования Тромсё за 1994–1995 гг.
Рост и вес измерялись в легкой одежде без обуви, а индекс массы тела рассчитывался как вес, деленный на квадрат роста (килограммы на квадратный метр).
Образцы крови без голодания были взяты между 08:00 и 16:00, и сыворотка хранилась при -70 ° C в течение 6-7 лет до первого размораживания в 2001 году. Все гормоны и ГСПГ были измерены на Immulite 2000 (Diagnostic Products Corp., Лос-Анджелес, CA). Измерения эстрадиола и ДГЭАС были основаны на конкурентных иммуноанализах, тогда как измерения ФСГ и ГСПГ были основаны на иммунометрических анализах.
Коэффициенты вариации эстрадиола и DHEAS во время и между анализами составляли от 4 до 15%. Коэффициенты вариации ФСГ и ГСПГ во время и между исследованиями составляли от 2 до 9%.Нижние пределы обнаружения составляли 10 пмоль / литр для эстрадиола, 0,5 МЕ / литр для ФСГ, 1,0 мкмоль / литр для ДГЭАС и 1,0 нмоль / литр для ГСПГ. Образцам со значениями ниже пределов обнаружения было присвоено среднее значение между нулем и пределом обнаружения: эстрадиол (333 женщины, 60 мужчин) и DHEAS (364 женщины, 84 мужчины). Все анализы проводились с интервалом в несколько недель друг от друга с использованием одной и той же партии реагентов и наборов для анализа. Мы использовали метод Vermeulen и др. . (21) для расчета свободного эстрадиола из общего эстрадиола и SHBG.Недавняя проверка Ринальди и др. . (22) нашли этот метод простым и надежным.
Статистический анализ
Пакет программного обеспечения SAS (версия 8.2; Институт SAS, Кэри, Северная Каролина) использовался как для управления данными, так и для анализа. Данные были проанализированы отдельно для женщин в пременопаузе и постменопаузе и для мужчин. Уровень значимости был выбран на уровне P <0,05 и P значения двусторонние. Из-за асимметрии распределения мы использовали логарифмически преобразованные гормоны во всех статистических анализах.Однако представленные ежемесячные средние значения и доверительные интервалы были преобразованы обратно в исходные единицы.
Ковариационный анализ (ANCOVA) использовался для исследования вариации среднемесячных значений и проверки общих различий между среднемесячными средними значениями в течение года. Месяцы использовались в качестве категориальной объясняющей переменной. Мы сделали поправку на возраст, индекс массы тела, текущее курение (да / нет), употребление алкоголя (да / нет), употребление кофе и физическую активность, которая, как известно, связана с половыми гормонами (19).Поскольку участники из центра города и сельской местности собирались в разное время года, мы также скорректировали избирательные округа, чтобы избежать взаимосвязи между социально-экономическим статусом и местом проживания.
Косинор-анализы использовались для проверки сезонности значений гормонов (23). Мы использовали индивидуальные значения логарифмически трансформированных гормонов и скорректировали для всех вышеупомянутых ковариат. Суть метода состоит в том, чтобы соответствовать модели линейной регрессии, в которой некоторое плавное изменение во времени моделируется паттернами, состоящими из синусов и косинусов.Этот анализ обеспечивает оценки среднего значения гормона и амплитуды нелинейных параметров (расстояние от среднего до пика кривой) и акрофазы (время пика). Сезонность значений гормонов оценивалась путем проверки нулевой гипотезы о нулевой амплитуде (24). Вариация гормонов, объясняемая сезонностью, была рассчитана на основе R 2 в косинор-анализе.
Результаты
У женщин в пременопаузе пик общего и свободного эстрадиола приходился на июнь (425 и 8.4 пмоль / литр), самым низким месяцем был ноябрь (76 и 1,6 пмоль / литр), но не было общей значимости различий между среднемесячными средними значениями ( P = 0,08) (данные не показаны). ФСГ и ДГЭАС не показали различий в среднемесячных значениях в ANCOVA. В анализах косинора общий и свободный эстрадиол не показали сезонных колебаний. ФСГ показал небольшой пик в июне ( P = 0,04), а DHEAS показал сезонность ( P = 0,004) с пиком в январе (таблицы 2 и 3).
ТАБЛИЦА 2.
Характеристики 230 женщин в пременопаузе, 1421 женщины в постменопаузе и 1540 мужчин: исследование Тромсё, 1994–1995 гг.
| . | Женщины в пременопаузе . | Женщины в постменопаузе . | Мужчины . | |||
|---|---|---|---|---|---|---|
| Среднее . | SD . | Среднее . | SD . | Среднее . | SD . | |
| Возраст (лет) | 38,6 | 7,1 | 64,1 | 6,4 | 60,1 | 10,0 |
| Индекс массы тела (кг / м²) | 237854 | 237 | 4,5 | 26,1 | 3,4 | |
| Кофе (кол-во чашек в день) | 5,0 | 3,3 | 4,9 | 2,8 | 6,0 | 3.8 |
| Оценка физической активности a | 4,2 | 2,6 | 2,7 | 2,1 | 3,7 | 2,5 |
| Текущие курильщики (%) | 38784 | 38784 | 38784 | 38784 | 38784 | |
| Трезвенники (%) | 8,3 | 32,7 | 12,8 | |||
| . | Женщины в пременопаузе . | Женщины в постменопаузе . | Мужчины . | ||||
|---|---|---|---|---|---|---|---|
| Среднее . | SD . | Среднее . | SD . | Среднее . | SD . | ||
| Возраст (лет) | 38,6 | 7,1 | 64,1 | 6.4 | 60,1 | 10,0 | |
| Индекс массы тела (кг / м²) | 23,9 | 3,9 | 26,4 | 4,5 | 26,1 | 3,4 | |
| 5,0 | 3,3 | 4,9 | 2,8 | 6,0 | 3,8 | ||
| Оценка физической активности a | 4,2 | 2,6 | 2,7 | 2,1 | 3,1 | 7 | 2,5 |
| Текущие курильщики (%) | 38,3 | 29,3 | 35,6 | ||||
| 32785 | 9078 9078 9078 | 8,3 | |||||
| . | Среднее b . | 95% ДИ c . | Среднее b . | 95% ДИ c . | Среднее b . | 95% ДИ c . |
|---|---|---|---|---|---|---|
| Гормоны | ||||||
| Общий эстрадиол (пмоль / литр) | 172 5 2178 | 172 57 | 12,7–194 | |||
| Свободный эстрадиол (пмоль / литр) | 3.6 | 0,5–25,1 | 0,4 | 0,1–3,1 | 1,2 | 0,3–4,6 |
| ФСГ (МЕ / литр) | 6,8 | 1,3–34,7 | 66,1 | 1,9–29,5 | ||
| DHEAS (мкмоль / л) | 3,3 | 1,1–10,0 | 1,3 | 0,3–5,5 | 2,8 | 0,7–11,0 | Среднее b . | 95% ДИ c . | Среднее b . | 95% ДИ c . | Среднее b . | 95% ДИ c . |
| Гормоны | ||||||
| Общий эстрадиол (пмоль / литр) | 172 | 23–81 | 3,1–145 | 49,6 | 12,7–194 | |
| Свободный эстрадиол (пмоль / литр) | 3,6 | 0,5–25,1 | 0,4 | 0,1–3,1 | 1,2 | |
| ФСГ (МЕ / литр) | 6,8 | 1,3–34,7 | 66,1 | 29,7–147 | 7,5 | 1,9–29,5 |
| 1,3 | 0,3–5,5 | 2,8 | 0,7–11,0 |
ТАБЛИЦА 2.
Характеристики 230 женщин в пременопаузе, 1421 женщины в постменопаузе и 1540 мужчин: исследование Тромсё, 1994–1995 гг.
043
| . | Женщины в пременопаузе . | Женщины в постменопаузе . | Мужчины . | |||
|---|---|---|---|---|---|---|
| Среднее . | SD . | Среднее . | SD . | Среднее . | SD . | |
| Возраст (лет) | 38,6 | 7,1 | 64,1 | 6,4 | 60,1 | 10,0 |
| Индекс массы тела (кг / м²) | 237854 | 237 | 4,5 | 26,1 | 3,4 | |
| Кофе (нет.чашек / день) | 5,0 | 3,3 | 4,9 | 2,8 | 6,0 | 3,8 |
| Оценка физической активности a | 4,2 | 2,6 | 2,1 | |||
| Текущие курильщики (%) | 38,3 | 29,3 | 35,6 | |||
| Трезвенники (%) | 8.3 | 32,7 | 12,8 | |||
| . | Женщины в пременопаузе . | Женщины в постменопаузе . | Мужчины . | |||
|---|---|---|---|---|---|---|
| Среднее . | SD . | Среднее . | SD . | Среднее . | SD . | |
| Возраст (лет) | 38,6 | 7,1 | 64,1 | 6,4 | 60,1 | 10,0 |
| Индекс массы тела (кг / м²) | 237854 | 237 | 4,5 | 26,1 | 3,4 | |
| Кофе (кол-во чашек в день) | 5,0 | 3,3 | 4,9 | 2,8 | 6,0 | 3.8 |
| Оценка физической активности a | 4,2 | 2,6 | 2,7 | 2,1 | 3,7 | 2,5 |
| Текущие курильщики (%) | 38784 | 38784 | 38784 | 38784 | ||
| Трезвенники (%) | 8,3 | 32,7 | 12,8 | |||
| . | Среднее b . | 95% ДИ c . | Среднее b . | 95% ДИ c . | Среднее b . | 95% ДИ c . |
|---|---|---|---|---|---|---|
| Гормоны | ||||||
| Общий эстрадиол (пмоль / литр) | 172 | 23–81 | 3,1–145 | 49,6 | 12,7–194 | |
| Свободный эстрадиол (пмоль / литр) | 3,6 | 0,5–25,1 | 0,4 | 0,1–3,1 | 1,2 | |
| ФСГ (МЕ / литр) | 6,8 | 1,3–34,7 | 66,1 | 29,7–147 | 7,5 | 1,9–29,5 |
| 1,3 | 0,3–5,5 | 2,8 | 0,7–11,0 |
| . | Среднее b . | 95% ДИ c . | Среднее b . | 95% ДИ c . | Среднее b . | 95% ДИ c . |
|---|---|---|---|---|---|---|
| Гормоны | ||||||
| Общий эстрадиол (пмоль / литр) | 172 | 23–81 | 3,1–145 | 49,6 | 12,7–194 | |
| Свободный эстрадиол (пмоль / литр) | 3,6 | 0,5–25,1 | 0,4 | 0,1–3,1 | 1,2 | |
| ФСГ (МЕ / литр) | 6,8 | 1,3–34,7 | 66,1 | 29,7–147 | 7,5 | 1,9–29,5 |
| 1,3 | 0,3–5,5 | 2,8 | 0,7–11,0 |
ТАБЛИЦА 3.
Характеристики ритма логарифмически преобразованного общего и свободного эстрадиола, ФСГ и ДГЭАС с помощью косинор-анализов a у 230 женщин в пременопаузе и 1421 женщин в постменопаузе и 1540 мужчин: исследование Тромсё 1994–1995 гг.
.
.
.
.
.
28 b
907
7 9078 9085 9085 9085 9085 мар 24
7 9078
| . | Общий эстрадиол (пмоль / литр) . | Свободный эстрадиол (пмоль / литр) . | ФСГ (МЕ / литр) . | DHEAS (мкмоль / литр) . | ||||
|---|---|---|---|---|---|---|---|---|
| Женщины в пременопаузе | ||||||||
| Значения P b | 0,14 | 0,14 | 0,26 0,07 907 907 907 907 907 907 907 907 | 0,555 | 0,835 | 0,516 | ||
| Амплитуда d | 0.135 | 0,110 | 0,080 | 0,068 | ||||
| Акрофаза e | 28 марта | 30 марта | 8 июня | 10 января | ||||
| P значений | 0,09 | 0,21 | 0,60 | 0,89 | ||||
| Среднее | 1,325 | −0.368 | 1,820 | 0,125 | ||||
| Амплитуда | 0,059 | 0,049 | 0,012 | 0,007 | ||||
| Acrophase Men | мар 24 | марта | ||||||
| P значения | 0,004 | 0,001 | 0,43 | 0.19 | ||||
| Среднее значение | 1,696 | 0,066 | 0,875 | 0,440 | ||||
| Амплитуда | 0,055 | 0,058 | 0,023 |
ТАБЛИЦА 3.
Характеристики ритма логарифмически преобразованного общего и свободного эстрадиола, ФСГ и ДГЭАС по анализу косинора a у 230 пременопаузальных и 1421 постменопаузальных женщин и 1540 мужчин: исследование Тромсё 1994–1995
| . | Общий эстрадиол (пмоль / литр) . | Свободный эстрадиол (пмоль / литр) . | ФСГ (МЕ / литр) . | DHEAS (мкмоль / литр) . | |||||
|---|---|---|---|---|---|---|---|---|---|
| Женщины в пременопаузе | |||||||||
| Значения P b | 0,14 | 0,26 0,07 | 0,555 | 0,835 | 0,516 | ||||
| Амплитуда d | 0,135 | 0,110 | 0,080 | 0,068 | |||||
| Mar7 | Mar7 | Янв 10 | |||||||
| Женщины в постменопаузе | |||||||||
| P значения | 0.09 | 0,21 | 0,60 | 0,89 | |||||
| Среднее значение | 1,325 | −0,368 | 1,820 | 0,125 | |||||
| Амплитуда | 0,05977 9085 | 0,059 | 24 марта | 27 марта | |||||
| Мужчины | |||||||||
| P значения | 0.004 | 0,001 | 0,43 | 0,19 | |||||
| Среднее значение | 1,696 | 0,066 | 0,875 | 0,440 | |||||
| Амплитуда | 0,07 9085 9085 | 0,055 9085 9085 | 0,055 9085 9085 | 0,055 9085 9085 | 0,055 | 14 мая | 20 мая |
| . | Общий эстрадиол (пмоль / литр) . | Свободный эстрадиол (пмоль / литр) . | ФСГ (МЕ / литр) . | DHEAS (мкмоль / литр) . | |||||
|---|---|---|---|---|---|---|---|---|---|
| Женщины в пременопаузе | |||||||||
| Значения P b | 0,14 | 0,14 | 0,26 0,07 907 907 907 907 907 907 907 907 | 0.555 | 0,835 | 0,516 | |||
| Амплитуда d | 0,135 | 0,110 | 0,080 | 0,068 | |||||
| 54 Acrophase 3078 9078 мар7 9078 9085 мар7 9085 9085 мар7 9085 10 | |||||||||
| Женщины в постменопаузе | |||||||||
| P значения | 0.09 | 0,21 | 0,60 | 0,89 | |||||
| Среднее значение | 1,325 | −0,368 | 1,820 | 0,125 | |||||
| Амплитуда | 0,05977 9085 | 0,059 | 24 марта | 27 марта | |||||
| Мужчины | |||||||||
| P значения | 0.004 | 0,001 | 0,43 | 0,19 | |||||
| Среднее значение | 1,696 | 0,066 | 0,875 | 0,440 | |||||
| Амплитуда | 0,07 9085 9085 | 0,055 9085 9085 | 0,055 9085 9085 | 0,055 9085 9085 | 0,055 | 14 мая | 20 мая |
У женщин в постменопаузе общий и свободный эстрадиол показали различия между среднемесячными средними значениями ( P <0.001) с пиком в июне (29,1 и 0,6 пмоль / л) и надиром в октябре (14,8 и 0,3 пмоль / л) соответственно в ANCOVA (рис. 1). Пик ФСГ пришелся на март (70,8 МЕ / литр), а надир наступил в мае (61,3 МЕ / литр), но изменение по месяцам было небольшим ( P = 0,03). В анализе косиноров не было обнаружено сезонных изменений, когда мы включили всех женщин в постменопаузе (таблица 3). Однако, когда мы повторили анализ после исключения женщин в возрасте 54 лет и старше с отсутствующими данными о менопаузе (n = 432), сезонные колебания общего и свободного эстрадиола были значительными ( P = 0.02 и P = 0,04), а сезонность составляла 0,2 и 0,3% вариации общего и свободного эстрадиола (данные не показаны). ФСГ и ДГЭАС не показали заметной сезонности.
У мужчин пик общего и свободного эстрадиола пришелся на май (63,0 и 1,5 пмоль / литр), а самый низкий уровень пришелся на октябрь (38,0 и 0,9 пмоль / литр), соответственно, в ANCOVA ( P = 0,002 и P < 0,001) (рис.1). ФСГ и ДГЭАС не показали заметных различий в среднемесячных значениях. В анализе косинора общий и свободный эстрадиол показали очень значимую сезонность с пиком в мае ( P = 0.004 и P = 0,001), а сезонность составляла 0,7 и 0,9% вариации общего и свободного эстрадиола, соответственно.
Обсуждение
Основным результатом этого исследования были сезонные колебания эстрадиола у женщин и мужчин, но только 0,2–0,9% колебаний эстрадиола объяснялись сезонностью. Эстрадиол показал различия между среднемесячными средними показателями у женщин и мужчин в постменопаузе. Однако косинор-анализ — лучший способ проверки сезонности по сравнению с традиционным тестированием ANOVA, в котором любой порядок месяцев дает тот же результат.
Большинство исследований вариаций репродуктивных гормонов по сезонам проводится в Северной Европе с участниками моложе 50 лет (10–15). Уровни эстрадиола показали сезонность в исследованиях на женщинах в пременопаузе (10, 11). В этом исследовании изменчивость в циклическом характере гормональных измерений у женщин в пременопаузе и небольшое количество в течение большей части месяцев может способствовать неспособности выявить значительные различия в уровне эстрадиола в этой группе. По тем же причинам мы считаем, что значительная сезонность DHEAS в этой группе может быть ложной находкой.В этом исследовании эстрадиол показал сезонность у женщин в постменопаузе, когда мы включили только женщин, которые сообщили о возрасте наступления менопаузы. Эта слабая связь была притуплена, когда мы использовали нечеткое определение менопаузы и включили 432 женщины в возрасте 54 лет и старше, у которых отсутствовали данные о менопаузе. В предыдущем исследовании с участием 14 пожилых женщин уровень эстрадиола не был сезонным (17). В остальном мало что известно о сезонности гормонов у пожилых женщин.
Насколько нам известно, ранее не сообщалось об интересном открытии совпадения сезонности уровней эстрадиола у мужчин и женщин в постменопаузе.В соответствии с результатами продольного исследования 24 мужчин из северной Финляндии (13), в котором продолжительность светового дня летом и в середине зимы сопоставима с Тромсё, уровни эстрадиола достигли пика в мае и достигли самого низкого уровня в октябре. Другие сообщили об отсутствии сезонности эстрадиола среди мужчин (14) или женщин (17). Влияние сезонных колебаний дневного света может быть ослаблено количеством искусственного света в современном обществе. Хотя уровни гормонов достигли пика в месяцы повышенного дневного света (весна и начало лета), нижние уровни не были обнаружены в самое темное время года.
У животных, живущих в более высоких широтах, сезонные изменения дневного света регулируют репродуктивную функцию, изменяя секрецию мелатонина шишковидной железой (3, 4). Люди не являются сезонными заводчиками. Тем не менее, сообщается о ритмичных сезонных колебаниях показателей рождаемости и зачатия (25, 26). Хотя время зачатия человека в основном зависит от социальных факторов, биологические сезонные компоненты все еще существуют. Исследования, проведенные в более высоких широтах, выявили более высокие уровни мелатонина или более длительную секрецию мелатонина в темное время года по сравнению с светлым сезоном (11–13, 27).На более низких широтах этого не было (7, 8). В северной Финляндии репродуктивные гормоны демонстрируют значительные сезонные колебания у мужчин (13) и женщин (10, 11), с увеличением функции гипофизарно-гонадной функции в конце весны и в начале лета. Однако эти различия были небольшими. Дополнительное доказательство того, что биологические факторы способствуют повышению плодородия весной, получены из исследований оплодотворения in vitro (28, 29). Ясно, что шишковидная железа человека сохранила способность реагировать на продолжительность светового дня, хотя функциональное значение этого механизма остается неопределенным (7, 30).Многие другие факторы, помимо продолжительности дня, могут привести к небольшим изменениям уровня эстрадиола, и одно из возможных объяснений состоит в том, что этому способствует температура. В этом исследовании нельзя было проверить, является ли сезонность эстрадиола эффектом дневного света, опосредованным уровнями мелатонина, поскольку мелатонин не измерялся.
Эпидемиологические данные указывают на низкий риск рака груди и простаты в арктических регионах, а зимняя темнота и более высокие уровни мелатонина могут иметь защитный эффект против гормонально-зависимых опухолей (6, 31).Сообщается, что в более высоких широтах продолжительность секреции мелатонина больше зимой, чем летом, но не в более низких широтах (7, 8). Мелатонин может действовать как природный антиэстроген, что продемонстрировано на in vivo моделях опухолей молочной железы животных, а также на in vitro раковых клетках груди человека (32–34). Эта гипотеза мелатонина может объяснить более низкий уровень эстрадиола в самое темное время года в арктических регионах. Если уровни эстрадиола у норвежского населения ниже, чем у людей в более низких широтах, это может объяснить высокую частоту переломов из-за хрупкости в Норвегии (35).Эта гипотеза была подтверждена нашими данными о сезонности уровней эстрадиола у женщин и мужчин среди населения Тромсё. Нам нужны сравнительные исследования среди людей из разных географических регионов, чтобы прояснить этот вопрос.
Это исследование имеет некоторые ограничения. Хотя мы использовали анализ с низким пределом обнаружения, значения эстрадиола были ниже предела у 23% женщин в постменопаузе. Однако результаты существенно не различались, независимо от того, были ли включены женщины со значениями ниже предела обнаружения.Ранее обсуждались отложенные анализы хранящихся образцов сыворотки и дневные вариации, и было обнаружено, что результаты вряд ли будут искажать наши результаты (19). Поправка на час отбора проб не повлияла ни на какие результаты. Характеристики подгруппы с измерениями гормонов сравнивались с общей популяцией TROST в предыдущей статье (19). Подгруппа женщин была на 1 год старше с более высокой распространенностью сердечно-сосудистых заболеваний, тогда как мужчины не различались никакими характеристиками. Поэтому предполагается, что вероятность систематической ошибки отбора невелика.Поперечные оценки сезонных колебаний уровней гормонов не являются истинными показателями продольных изменений, и индивидуальные вариации не могут быть идентифицированы. Предпочтительным было бы продольное проектирование с участием одних и тех же участников в течение года. Однако можно ожидать, что истинные сезонные колебания будут очевидны в этом исследовании из-за большого размера выборки, несмотря на поперечный дизайн.
Слабые, но значительные сезонные колебания эстрадиола, особенно у мужчин, указывают на то, что сезонность может быть источником систематической ошибки в сравнительных исследованиях среди населения более высоких широт.Поэтому при планировании исследований, анализе и интерпретации результатов измерений эстрадиола следует учитывать возможные сезонные колебания. Желательно, чтобы в клинических случаях и в контрольной группе измеряли гормоны в одно и то же время года, а также регистрировали время забора крови, чтобы можно было внести поправки в анализы во избежание систематической ошибки. Необходимы дальнейшие исследования, желательно продольные, чтобы подтвердить наши выводы в популяциях на аналогичных широтах и проверить достоверность этих результатов для других широт.
Благодарности
Мы благодарим Национальную службу проверки здоровья и участников исследования Тромсё за их помощь. Авторы благодарят Тома Уилсгаарда за статистическую помощь.
Эта работа была поддержана грантами Исследовательского совета Норвегии, Норвежского фонда здравоохранения и реабилитации и Университетской больницы Северной Норвегии.
Заявление о раскрытии информации: авторам нечего раскрывать.
Сокращения:
ANCOVA,
DHEAS,
сульфат дегидроэпиандростерона;
TROST,
Исследование остеопороза в Тромсё.
1
Riggs
BL
,
Khosla
S
,
Melton
LJ
2002
Секс-стероиды и построение и сохранение скелета взрослого человека
.
Endocr Rev
23
:
279
—
302
2
Совместная группа по эндогенным гормонам и раку груди
2003
Индекс массы тела, половые гормоны сыворотки и риск рака груди у женщин в постменопаузе
.
J Natl Cancer Inst
95
:
1218
—
1226
3
Bittman
EL
,
Karsch
FJ
1984
Ночная продолжительность секреции пинеального мелатонина определяет репродуктивную реакцию длина в овце
.
Biol Reprod
30
:
585
—
593
4
Reiter
RJ
1991
Нейроэндокринные эффекты света
.
Int J Biometeorol
35
:
169
—
175
5
Reiter
RJ
1998
Мелатонин и воспроизводство человека
.
Ann Med
30
:
103
—
108
6
Rohr
UD
,
Herold
J
2002
Дефицит мелатонина у женщин
.
Maturitas
41
(
Suppl 1
):
S85
—
S104
7
Wehr
TA
2001
Фотопериодизм у людей и других приматов: доказательства и последствия
.
J Biol Rhythms
16
:
348
—
364
8
Bronson
EH
2004
Являются ли люди сезонными фотопериодическими?
J Biol Rhythms
19
:
180
—
192
9
Panico
S
,
Pisani
P
,
Muti
P
,
Recchione
Cavalleri
Cavalleri
Cavalleri
A
,
Totis
A
,
Berrino
F
1990
Суточные колебания тестостерона и эстрадиола: источник систематической ошибки в сравнительных исследованиях рака груди
.
J Endocrinol Invest
13
:
423
—
426
10
Kauppila
A
,
Pakarinen
A
,
Kirkinen
P
,
Makila
943
Влияние сезона на циркулирующие концентрации гормонов передней доли гипофиза, яичников и коры надпочечников и гормоносвязывающих белков в субарктической области: свидетельство повышенной активности гипофизарно-яичниковой оси весной
.
Gynecol Endocrinol
1
:
137
—
150
11
Kauppila
A
,
Kivela
A
,
Pakarinen
A
,
Vakkuri
Oakkuri
сезонная взаимосвязь между мелатонином и активностью яичников у людей в регионе с сильным сезонным контрастом яркости
.
J Clin Endocrinol Metab
65
:
823
—
828
12
Kivela
A
,
Kauppila
A
,
Ylostalo
P
,
Oppila
J
1988
Сезонные, менструальные и циркадные выделения мелатонина, гонадотропинов и пролактина у женщин
.
Acta Physiol Scand
132
:
321
—
327
13
Martikainen
H
,
Tapanainen
J
,
Vakkuri
O
,
Joto 900mi I
1985
Круговые концентрации мелатонина, гонадотропинов, пролактина и гонадных стероидов у мужчин в географической зоне с большими годовыми колебаниями дневного света
.
Acta Endocrinol
109
:
446
—
450
14
Андерссон
AM
,
Карлсен
E
,
Петерсен
JH
,
Skakkebaek
9430004
0 943000 NE 9004
0 в уровнях сывороточного ингибина B, тестостерона, эстрадиола, лютеинизирующего гормона, фолликулостимулирующего гормона и глобулина, связывающего половые гормоны, в ежемесячных пробах от здоровых мужчин в течение 17-месячного периода: возможные эффекты сезонов
.
J Clin Endocrinol Metab
88
:
932
—
937
15
Garde
AH
,
Hansen
AM
,
Skovgaard
LT
,
Christensen
3 9004 J
Сезонные и биологические колебания в крови концентраций общего холестерина, дегидроэпиандростерона сульфата, гемоглобина A (1c), IgA, пролактина и свободного тестостерона у здоровых женщин
.
Clin Chem
46
:
551
—
559
16
Meriggiola
MC
,
Noonan
EA
,
Paulsen
CA
,
Bremner
WJ
Годовой 1996
паттерны лютеинизирующего гормона, фолликулостимулирующего гормона, тестостерона и ингибина у нормальных мужчин
.
Hum Reprod
11
:
248
—
252
17
Nicolau
GY
,
Lakatua
D
,
Sackett-Lundeen
L
,
E4
E4
Циркадные и суточные ритмы гормональных переменных у пожилых мужчин и женщин
.
Chronobiol Int
1
:
301
—
319
18
Berntsen
GKR
,
Fønnebø
V
,
Tollan
A
,
Søgaard
Søgaard
2001
Минеральная плотность костной ткани предплечья по возрасту у 7620 мужчин и женщин: исследование Тромсё, популяционное исследование
.
Am J Epidemiol
153
:
465
—
473
19
Bjørnerem Å, Straume
B
,
Midtby
M
,
Fønnebø
V
00fjord 9000 43, 9000 Свартберг
J
,
Acharya
G
,
Øian
P
,
Berntsen
GKR
2004
Эндогенные половые гормоны в зависимости от возраста, пола, факторов образа жизни и хронических заболеваний в целом Население: исследование Тромсё
.
J Clin Endocrinol Metab
89
:
6039
—
6047
20
Кнутсен
SF
,
Кнутсен
R
1989
Исследование сердца Тромсё: семейный подход к вмешательству при ИБС. Возможность снижения факторов риска у лиц высокого риска — описание проекта
.
Scand J Soc Med
17
:
109
—
119
21
Vermeulen
A
,
Verdonck
L
,
Kaufman
JM
1999
Критическая оценка простых методов для оценки свободного тестостерона в сыворотке крови
.
J Clin Endocrinol Metab
84
:
3666
—
3672
22
Rinaldi
S
,
Geay
A
,
Déchaud
H
,
Biessy
43
C Jacquotte
A
,
Ахмедханов
A
,
Shore
RE
,
Riboli
E
,
Toniolo
P
,
Kaaks
R
Validity бесплатно и
от Validity определение свободного эстрадиола в образцах сыворотки женщин в постменопаузе теоретическими расчетами
.
Биомаркеры эпидемиологии рака Предыдущая
11
:
1065
—
1071
23
Cugini
P
1993
Хронобиология: принципы и методы
.
Ann Ist Super Sanita
29
:
483
—
500
24
Mikulich
SK
,
Zerbe
GO
,
Jones
RH
,
Crowley
3
3 TJ4
2003
Сравнение линейных и нелинейных смешанных модельных подходов к косинорному анализу
.
Stat Med
22
:
3195
—
3211
25
Roenneberg
T
,
Aschoff
J
1990
Годовой ритм воспроизводства человека: II. Экологические корреляции
.
J Biol Rhythms
5
:
217
—
239
26
Roenneberg
T
,
Aschoff
J
1990
Годовой ритм воспроизводства человека: I.Биология, социология или и то, и другое?
J Biol Rhythms
5
:
195
—
216
27
Stokkan
KA
,
Reiter
RJ
1994
Ритмы мелатонина у городских жителей Арктики
.
J Pineal Res
16
:
33
—
36
28
Ossenbuhn
S
1998
Экзогенные влияния на фертильность человека: колебания параметров спермы и результаты in vitro оплодотворения совпадают с зачатиями в нормальном населении
.
Hum Reprod
13
:
2165
—
2171
29
Рожанский
N
,
Benshushan
A
,
Meirsdorf
S
,
Lewin
A 9004
,
Safran
A
2000
Сезонная изменчивость показателей оплодотворения и качества эмбрионов у женщин, перенесших ЭКО
.
Fertil Steril
74
:
476
—
481
30
Macchi
MM
,
Брюс
JN
2004
Физиология эпифиза человека и функциональное значение мелатонина
.
Фронт нейроэндокринол
25
:
177
—
195
31
Эррен
TC
,
Пекарски
C
1999
Защищает ли зимняя темнота в Арктике от рака? Возвращение к гипотезе мелатонина
.
Med Hypotheses
53
:
1
—
5
32
Sanchez-Barcelo
EJ
,
Cos
S
,
Fernandez
R
,
Mediavilla
9430004
Mediavilla
943000 MD4
0
Мелатонин и рак молочной железы: краткий обзор
.
Endocr Relat Cancer
10
:
153
—
159
33
Blask
DE
,
Dauchy
RT
,
Sauer
LA
,
Krause
JA
, GC
2003
Рост и метаболизм жирных кислот ксенотрансплантатов рака груди человека (MCF-7) у голых крыс: влияние постоянного светового подавления ночного мелатонина
.
Лечение рака груди
79
:
313
—
320
34
Кифер
T
,
Ram
PT
,
юаней
L
,
Hill
SM
2002
Мелатонин подавляет трансактивацию рецепторов эстрогена и уровни цАМФ в клетках рака молочной железы
.
Лечение рака молочной железы Res Treat
71
:
37
—
45
35
Lofthus
CM
,
Osnes
EK
,
Falch
JA
,
Kaastadtian
TS
,
Kaastadtian
TS
IS
,
Nordsletten
L
,
Stensvold
I
,
Meyer
HE
2001
Эпидемиология переломов бедра в Осло, Норвегия
.
Кость
29
:
413
—
418
Авторские права © 2006 Эндокринное общество
Сезонные колебания в регуляции уровня тестостерона у восточной грязевой улитки (Ilyanassa obsoleta) по JSTOR
Abstract
Некоторые брюхоногие моллюски, по-видимому, используют стратегию регуляции уровня тестостерона, которая нетипична для таких процессов, выявленных у других многоклеточных животных. В то время как большинство животных превращают тестостерон в полярные производные, которые легко выводятся из организма, грязевая улитка Ilyanassa obsoleta превращает тестостерон в неполярные сложные эфиры тестостерона и жирных кислот, которые задерживаются в организме.В настоящем исследовании мы проверили гипотезу о том, что этерификация жирных кислот служит для накопления тестостерона и что накопленные пулы сложных эфиров тестостерона и жирных кислот меняются в течение репродуктивного цикла улитки. Эта гипотеза была проверена путем 1) модуляции уровня общего тестостерона у отдельных улиток и измерения количества гормона, хранящегося в виде сложного эфира жирной кислоты, относительно количества, удерживаемого в виде свободного стероида, и 2) измерения изменений этерифицированного тестостерона в полевой популяции улиток во время их репродуктивный цикл.У взрослых улиток экспериментально манипулировали, чтобы они содержали от ~ 36 до 300% уровня общего тестостерона, измеренного у необработанных особей. Количество сложного эфира тестостерона и жирной кислоты, присутствующего в этих организмах, увеличивалось прямо пропорционально уровню общего тестостерона, в то время как уровни свободного тестостерона оставались относительно постоянными. Эти наблюдения предполагают, что уровни свободного тестостерона у улиток регулируются процессами этерификации / деэтерификации жирных кислот. Среди улиток, отобранных в полевых условиях, тестостерон существовал преимущественно в свободной, неэтерифицированной форме в начале и в конце периода яйцекладки.В других случаях большая часть тестостерона выделялась в виде сложных эфиров жирных кислот. Это исследование предоставляет убедительные доказательства того, что уровень свободного тестостерона в грязевой улитке регулируется посредством процессов этерификации / деэтерификации жирных кислот, и эта регулирующая функция способствует сезонным колебаниям уровня свободного тестостерона.
Journal Information
Invertebrate Biology (IB) представляет оригинальные исследования и обзорные статьи по всем аспектам биологии беспозвоночных — морфологии и ультраструктуре; генетика, филогенетика и эволюция; физиология и экология; нейробиология, поведение и биомеханика; размножение и развитие; клеточная и молекулярная биология — и на всех типах беспозвоночных: простейших и многоклеточных, водных и наземных, свободноживущих и симбиотических.Все материалы проходят тщательную экспертную оценку. Журнал, издаваемый Американским микроскопическим обществом (AMS), входит в число старейших непрерывно публикуемых журналов в Соединенных Штатах и существует с 1880 года. В течение 100 лет (1895–1995) его название было «Труды Американского микроскопического общества»; с тех пор он был опубликован под названием «Биология беспозвоночных», чтобы отразить его нынешний широкий охват биологии беспозвоночных животных. Отдел зоологии беспозвоночных Общества интегративной и сравнительной биологии присоединяется к AMS в продвижении журнала, который публикуется совместно с Blackwell Publishing.
Информация для издателя
Wiley — глобальный поставщик контента и решений для рабочих процессов с поддержкой контента в областях научных, технических, медицинских и научных исследований; профессиональное развитие; и образование. Наши основные направления деятельности выпускают научные, технические, медицинские и научные журналы, справочники, книги, услуги баз данных и рекламу; профессиональные книги, продукты по подписке, услуги по сертификации и обучению и онлайн-приложения; образовательный контент и услуги, включая интегрированные онлайн-ресурсы для преподавания и обучения для студентов и аспирантов, а также для учащихся на протяжении всей жизни.Основанная в 1807 году компания John Wiley & Sons, Inc. уже более 200 лет является ценным источником информации и понимания, помогая людям во всем мире удовлетворять свои потребности и воплощать в жизнь их чаяния. Wiley опубликовал работы более 450 лауреатов Нобелевской премии во всех категориях: литература, экономика, физиология и медицина, физика, химия и мир.
Wiley поддерживает партнерские отношения со многими ведущими мировыми сообществами и ежегодно издает более 1500 рецензируемых журналов и более 1500 новых книг в печатном виде и в Интернете, а также базы данных, основные справочные материалы и лабораторные протоколы по предметам STMS.Благодаря растущему предложению открытого доступа, Wiley стремится к максимально широкому распространению и доступу к публикуемому контенту, а также поддерживает все устойчивые модели доступа. Наша онлайн-платформа, Wiley Online Library (wileyonlinelibrary.com), является одной из самых обширных в мире междисциплинарных коллекций онлайн-ресурсов, охватывающих жизнь, здоровье, социальные и физические науки и гуманитарные науки.
.
