причины возникновения, подходы к диагностике и лечению » Акушерство и Гинекология
ФГБУ Эндокринологический научный центр Минздравсоцразвития России, Москва, Россия; ГБУЗ МО Московский Областной научно-исследовательский клинический институт им. М.Ф. Владимирского, Москва, Россия
Формирующийся в результате нарушения синтеза и/или секреции гонадотропинов гипогонадотропный гипогонадизм может быть органическим (т.е. формирующимся в результате анатомо-функциональных расстройств гипоталамо-гипофизарной области при различных новообразованиях хиазмально-селлярной локализации) или функциональным, приобретенным или врожденным (мутации гена рецептора ГнРГ, β-субъединицы ФСГ; генов SF-1, DAX-1, нарушения в генах рецепторов ЛГ и ФСГ и пр.). В формировании функциональных нарушений принимают участие нейропептид Y (NPY), кортикотропин-рилизинг-гормон (КРГ), лептин, грелин и β-эндорфин. Диагностика заболевания включает определение гонадотропинов, исключение гиперпролактинемии и других эндокринных расстройств, ультразвуковое исследование матки и яичников, магнитно-резонансную томографию головного мозга. При длительности аменореи более года показано исследование плотности костной ткани. При выявлении причин гипогонадотропного гипогонадизма в первую очередь необходимо их устранение (например, ликвидация стресса, исключение физических нагрузок, восстановление нормальной массы тела, или лечение опухолей гипофиза и т.д.), что может приводить к восстановлению менструальной функции и фертильности. Однако в большинстве случаев при стойкой гипоэстрогении у пациенток с гипогонадотропным гипогонадизмом показана эстроген-гестагенная терапия в циклическом режиме, для длительного применения эффективной и безопасной является комбинация 17β-эстрадиола 2 мг и дидрогестерона 10 мг.
При длительности аменореи более года показано исследование плотности костной ткани. При выявлении причин гипогонадотропного гипогонадизма в первую очередь необходимо их устранение (например, ликвидация стресса, исключение физических нагрузок, восстановление нормальной массы тела, или лечение опухолей гипофиза и т.д.), что может приводить к восстановлению менструальной функции и фертильности. Однако в большинстве случаев при стойкой гипоэстрогении у пациенток с гипогонадотропным гипогонадизмом показана эстроген-гестагенная терапия в циклическом режиме, для длительного применения эффективной и безопасной является комбинация 17β-эстрадиола 2 мг и дидрогестерона 10 мг.
гипогонадизм
гипоэстрогенемия
эстроген-гастагенная терапия
«Гипогонадотропным» (или «центральным», «вторичным») называют гипогонадизм, формирующийся в результате нарушения синтеза и/или секреции гонадотропинов. Гипогонадотропный гипогонадизм может быть приобретенным или врожденным заболеванием, органическим или функциональным. Приобретенные органические формы гипогона-дотропного гипогонадизма развиваются в результате анатомо-функциональных расстройств гипоталамо-гипофизарной области при различных новообразованиях хиазмально-селлярной локализации (опухолях гипофиза, краниофарингиомах, и пр.) или других повреждениях (например, при формировании «пустого» турецкого седла) [1]. При этом могут возникать как органические нарушения нейронных путей гипоталамуса, так и изменения непосредственно в клетках аденогипофиза, что, в конечном счете, проявляется развитием функциональной несостоятельности гонадотрофов с нарушением секреции гонадотропинов. Снижение синтеза и секреции гонадотропинов может наблюдаться при геморрагических и ишемических инфарктах гипофиза, гранулематозных и инфильтративных заболеваниях с поражением гипоталамо-гипофизарной области (саркаидозе, туберкулезе, гистиоцитозе Х и др.). Кроме того, возможно развитие аутоиммунного поражения ткани гипофиза – так называемый лимфоцитарный гипофизит [2], при котором происходит диффузная инфильтрация ткани гипофиза лимфоцитами и лимфоидными элементами с развитием деструкции нормальных гипофизарных клеток.
Приобретенные органические формы гипогона-дотропного гипогонадизма развиваются в результате анатомо-функциональных расстройств гипоталамо-гипофизарной области при различных новообразованиях хиазмально-селлярной локализации (опухолях гипофиза, краниофарингиомах, и пр.) или других повреждениях (например, при формировании «пустого» турецкого седла) [1]. При этом могут возникать как органические нарушения нейронных путей гипоталамуса, так и изменения непосредственно в клетках аденогипофиза, что, в конечном счете, проявляется развитием функциональной несостоятельности гонадотрофов с нарушением секреции гонадотропинов. Снижение синтеза и секреции гонадотропинов может наблюдаться при геморрагических и ишемических инфарктах гипофиза, гранулематозных и инфильтративных заболеваниях с поражением гипоталамо-гипофизарной области (саркаидозе, туберкулезе, гистиоцитозе Х и др.). Кроме того, возможно развитие аутоиммунного поражения ткани гипофиза – так называемый лимфоцитарный гипофизит [2], при котором происходит диффузная инфильтрация ткани гипофиза лимфоцитами и лимфоидными элементами с развитием деструкции нормальных гипофизарных клеток.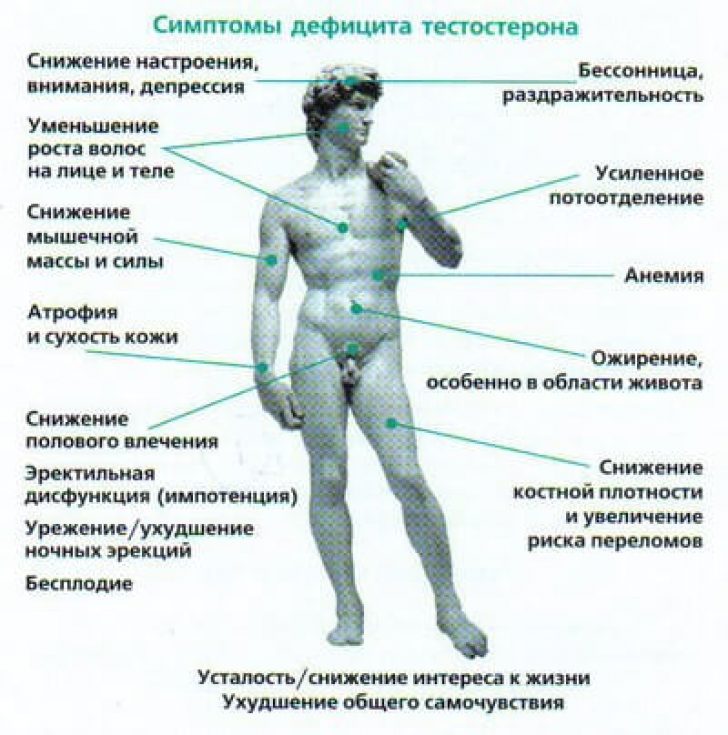 Этот процесс может сопровождаться недостаточностью тропных гормонов, в том числе и гонадотропинов. Центральный гипогонадизм может также являться следствием черепно-мозговой травмы (развивается примерно у 25% лиц, перенесших тяжелую или средне-тяжелую травму головного мозга) [3].
Этот процесс может сопровождаться недостаточностью тропных гормонов, в том числе и гонадотропинов. Центральный гипогонадизм может также являться следствием черепно-мозговой травмы (развивается примерно у 25% лиц, перенесших тяжелую или средне-тяжелую травму головного мозга) [3].
Функциональная гонадотропная недостаточность (или так называемая «функциональная гипоталамическая аменорея») является причиной примерно 30–35% случаев вторичной аменореи. В этих случаях причиной гипогонадизма становится снижение частоты и/или амплитуды импульсной секреции гонадотропин-рилизинг-гормона (ГнРГ), возникающее в отсутствие органического поражения гипоталамо-гипофизарной области [4]. Диагностическими критериями функциональной гонадотропной недостаточности можно считать отсутствие менструаций более 6 мес на фоне низких (<5 Ед/л) концентраций ЛГ и ФСГ при исключении других причин нарушений менструального цикла (гиперпролактинемии, гипотиреоза, гиперандрогении и пр.) и при отсутствии изменений гипоталамо-гипофизарной области, по данным магнитно-резонансной томографии (МРТ) головного мозга [4].
Одной из самых распространенных причин функциональной гонадотропной недостаточности является хронический стресс («психогенная» или «стрессорная» аменорея). Другими причинами также считаются чрезмерные физические нагрузки (профессиональный спорт) и критическое снижение массы тела, крайняя форма которого наблюдается при нервной анорексии [4, 5].
В формировании функциональной гипоталамической аменореи принимают участие различные нейропептиды: нейропептид Y (NPY), кортикотропин-рилизинг-гормон (КРГ), лептин, грелин и β-эндорфин, влияющие на секрецию ГнРГ. Патогенез функциональной аменореи при стрессе, избыточных физических нагрузках и потере массы тела сходен, хотя при различных заболеваниях являются ведущими те или иные нарушения секреции нейропептидов. Например, при физических нагрузках и потере массы тела в бóльшей степени наблюдается нарушение секреции NPY, при стресс-индуцированной аменорее и на фоне физических нагрузок – чрезмерная активация КРГ и т.д.
В патофизиологии стрессовой аменореи важную роль играет КРГ. У женщин с функциональной аменореей отмечается повышение секреции КРГ по сравнению со здоровыми женщинами [6], что, с одной стороны, считается косвенным подтверждением хронического стресса, а с другой – фактором нарушения секреции ГнРГ/гонадотропинов. Повышенная секреция КРГ прямо подавляет электрофизиологическую активность импульсного генератора ГнРГ [7]. Кроме того, повышение продукции КРГ стимулирует выработку адренокортикотропного гормона (АКТГ) и β-эндорфина, обладающих самостоятельным ингибирующим действием на гипоталамо-гипофизарно-гонадную ось [8]. При аменорее, индуцированной стрессом и физическими нагрузками, отмечается бóльшее повышение опиодергической активации по сравнению с аменореей на фоне потери массы тела [4].
У женщин с функциональной аменореей отмечается повышение секреции КРГ по сравнению со здоровыми женщинами [6], что, с одной стороны, считается косвенным подтверждением хронического стресса, а с другой – фактором нарушения секреции ГнРГ/гонадотропинов. Повышенная секреция КРГ прямо подавляет электрофизиологическую активность импульсного генератора ГнРГ [7]. Кроме того, повышение продукции КРГ стимулирует выработку адренокортикотропного гормона (АКТГ) и β-эндорфина, обладающих самостоятельным ингибирующим действием на гипоталамо-гипофизарно-гонадную ось [8]. При аменорее, индуцированной стрессом и физическими нагрузками, отмечается бóльшее повышение опиодергической активации по сравнению с аменореей на фоне потери массы тела [4].
При снижении массы тела следствием уменьшения доли жировой ткани является не только истощение энергетических запасов, но и нарушение регулярных механизмов репродуктивной функции, связанных с гормональной активностью адипоцитов (например, продукцией лептина и др. факторов). При индексе массы тела (ИМТ) от 18 до 25 кг/м2 функциональные нарушения менструального цикла встречаются менее часто по сравнению с пациентками с ИМТ<17 кг/м2 [9]. Концентрация лептина коррелирует с массой тела, ИМТ и процентным содержанием жировой ткани в организме [10]. Снижение концентрации лептина сопровождается снижением импульсной секреции ЛГ [11]. Кроме того, гиполептинемия приводит к активизации адренергической системы и повышению секреции КРГ и NPY, что стимулирует секрецию АКТГ и кортизола и является дополнительными факторами подавления секреции ГнРГ и ЛГ [12]. Снижение массы жировой ткани у женщин с аменореей на фоне дефицита массы тела является наиболее важным фактором снижения концентрации лептина. Прием пищи и энергетический баланс у женщин с аменореей влияют на соотношения «масса тела/ лептин» и «ИМТ/лептин»: увеличение массы тела всего лишь на 1 кг тут же приводит к быстрому повышению концентрации лептина [13]. Однако лептин может участвовать в формировании аменореи и без снижения массы тела.
факторов). При индексе массы тела (ИМТ) от 18 до 25 кг/м2 функциональные нарушения менструального цикла встречаются менее часто по сравнению с пациентками с ИМТ<17 кг/м2 [9]. Концентрация лептина коррелирует с массой тела, ИМТ и процентным содержанием жировой ткани в организме [10]. Снижение концентрации лептина сопровождается снижением импульсной секреции ЛГ [11]. Кроме того, гиполептинемия приводит к активизации адренергической системы и повышению секреции КРГ и NPY, что стимулирует секрецию АКТГ и кортизола и является дополнительными факторами подавления секреции ГнРГ и ЛГ [12]. Снижение массы жировой ткани у женщин с аменореей на фоне дефицита массы тела является наиболее важным фактором снижения концентрации лептина. Прием пищи и энергетический баланс у женщин с аменореей влияют на соотношения «масса тела/ лептин» и «ИМТ/лептин»: увеличение массы тела всего лишь на 1 кг тут же приводит к быстрому повышению концентрации лептина [13]. Однако лептин может участвовать в формировании аменореи и без снижения массы тела.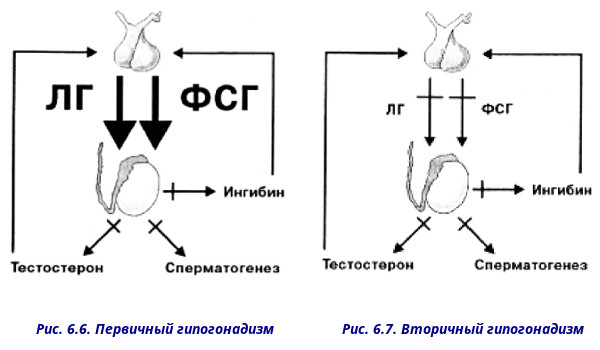 Было показано, что у женщин, сравнимых по возрасту, массе тела и содержанию жировой ткани в организме, при аменорее имелись более низкие концентрации лептина, чем при нормальном менструальном цикле [4]. Есть сообщения об успешном лечении гипоталамической аменореи рекомбинантным лептином [14].
Было показано, что у женщин, сравнимых по возрасту, массе тела и содержанию жировой ткани в организме, при аменорее имелись более низкие концентрации лептина, чем при нормальном менструальном цикле [4]. Есть сообщения об успешном лечении гипоталамической аменореи рекомбинантным лептином [14].
У пациенток функциональной аменореей на фоне снижения массы тела также отмечается снижение базальной концентрации NPY [15]. Есть предположения, что NPY может быть основным кандидатом на роль координатора питания и репродукции на уровне центральной нервной системы [16]. Кроме того, в патогенезе функциональной аменореи при потере массы тела участвует грелин, который также подавляет активность гипоталамо-гипофизарно-гонадной оси. Высокие концентрации грелина были отмечены после потери массы тела, индуцированной диетой или хирургическим вмешательством, при неадекватном пищевом поведении (даже на фоне нормального калоража) и при отрицательном энергетическом балансе [17, 18]. Концентрации грелина у женщин с неврогенной анорексией и аменореей значительно выше, чем у здоровых худеньких женщин [19]. Высокие концентрации грелина могут быть ответственны за продолжение аменореи после восстановления нормальной массы тела и нормализации концентраций лептина [20, 21].
Высокие концентрации грелина могут быть ответственны за продолжение аменореи после восстановления нормальной массы тела и нормализации концентраций лептина [20, 21].
Среди спортсменок особенно часто нарушения менструального цикла возникают у гимнасток, балерин, ныряльщиц и легкоатлеток, бегущих на длинные дистанции. У этих пациенток отмечается активизация секреции КРГ, β-эндорфина и грелина [22], а также крайне низкие концентрации лептина [23].
Врожденные нарушения секреции гонадотропинов, проявляющиеся гипогонадизмом, могут быть вызваны генетическими дефектами, которые обна-руживаются на разных уровнях гипоталамо-гипофизарно-гонадной оси: нарушения секреции ГнРГ (с аносмией – синдром Каллмана, без аносмии – изолированный гипогонадотропный гипогонадизм), мутации гена рецептора ГнРГ, приводящие к снижению его активности; мутации β-субъединицы ФСГ; дефекты в гонадотрофах (мутации генов SF-1, DAX-1), нарушения в генах рецепторов ЛГ и ФСГ [24]. Большинство выявляемых врожденных случаев – спорадические, хотя встречается и Х-сцепленное наследование. Известны дефекты по меньшей мере двух аутосомных генов, приводящих к недостаточности ГнРГ [25]. Генетические мутации непосредственно самих молекул гонадотропинов ЛГ и ФСГ встречаются крайне редко.
Известны дефекты по меньшей мере двух аутосомных генов, приводящих к недостаточности ГнРГ [25]. Генетические мутации непосредственно самих молекул гонадотропинов ЛГ и ФСГ встречаются крайне редко.
Нарушения центральной регуляции синтеза и/или секреции гонадотропинов приводят к снижению уровня половых стероидов и развитию клинической симптоматики гипогонадизма. У пациенток с гипогонадизмом отмечаются нарушения регулярности менструального цикла по типу олиго/опсоменореи или аменореи (в 100% случаев), бесплодие, атрофические изменения слизистой оболочки гениталий, приводящие к урогенитальным расстройствам (до 70% случаев), гипоплазия молочных желез (40–60% случаев), скудное половое оволосение (20– 40%) [26, 27]. Кроме того, дефицит эстрогенов приводит к развитию остеопении той или иной степени (86% пациенток) и дислипидемических нарушений (до 45% пациенток) [28]. Вазомоторные нарушения, ассоциирующиеся с дефицитом эстрогенов в постменопаузе, возникают при центральном гипогонадизме редко – не более 10% случаев, однако бывают ярко выраженными и существенно ухудшают самочувствие женщины.
Начальные диагностические исследования включают определение содержания эстрадиола в сыворотке крови (для подтверждения гипоэстрогении), определение уровней ФСГ, ЛГ и пролактина для дифференциальной диагностики между центральным и яичниковым уровнями поражения гипоталамо-гипофизарно-овариальной оси и исключения гиперпролактинемического гипогонадизма. Обязательно нужно провести определение уровней ТТГ и свободного тироксина для исключения нарушений функции щитовидной железы как причины менструальной дисфункции. Ультразвуковое исследование органов малого таза уточнит исходное состояние матки и яичников, а также будет простым и доступным методом контроля проводимого лечения. Для пациенток с первичной аменореей обязательно исследование кариотипа для исключения или диагностики генетических отклонений. Учитывая тот факт, что нарушения функции репродуктивной системы могут быть следствием органического поражения гипоталамо-гипофизарных структур, пациенткам с низкими уровнями гонадотропинов показано проведение МРТ головного мозга для исключения опухолей хиазмально-селлярной области [29, 30].
Женщинам с длительностью аменореи более года показано исследование минеральной плотности костной ткани (МПК), оптимальным методом обследования является дуальная энергетическая рентгеновская абсорбциометрия. По нашим данным, у большинства пациенток (58%) с изолированным гипогонадотропным гипогонадизмом часто отмечаются сниженные показатели МПК как в шейке бедра, так и в поясничных позвонках, поэтому целесообразно проводить исследование обеих точек скелета [31]. По нашим данным, для пациенток с гипопитуитаризмом более характерно снижение МПК именно в позвоночнике (-2,5 SD по Z-критерию у 50% пациенток), поэтому этот отдел скелета является более важным для исследования [28, 31].
Дополнительные исследования могут включать биохимический анализ крови (определение показателей липидного спектра, ферментов печени, показателей минерального обмена), определение содержания других тропных гормонов гипофиза, а также необходимые лабораторно-инструментальные исследования, направленные на уточнение эндокринных нарушений, сопутствующих гипогонадизму.
В ряде случаев лечение заболеваний, сопровождающихся гипогонадизмом, приводит к восстановлению менструального цикла, и длительной заместительной терапии половыми гормонами в таких случаях не требуется. При функциональных нейроэндокринных расстройствах для восстановления нормальной менструальной функции необходимо исключение причин возникновения заболевания (ликвидация стресса, исключение физических нагрузок) и/или восстановление нормальной массы тела. Хирургическое, медикаментозное и/или лучевое лечение гормонально-активных опухолей гипофиза может приводить к восстановлению менструальной функции и фертильности. Так, например у женщин с гиперпролактинемическим гипогонадизмом лечение агонистами дофамина в подавляющем большинстве случаев (до 70% случаев) позволяет добиться нормализации функции репродуктивной системы [32]. В тех случаях, когда восстановить нормальный уровень половых стероидов не удается (например, после удаления опухолей хиазмально-селлярной области, при синдроме «пустого» турецкого седла), необходимо назначить лечение, направленное на восстановление менструальной функции, а также на предотвращение развития отдаленных последствий гипоэстрогении. Кроме того, отсутствие адекватной терапии половыми стероидами существенно снижает качество жизни пациенток с гипогонадотропным гипогонадизмом, особенно если присутствуют и другие виды гипофизарной недостаточности [33].
Кроме того, отсутствие адекватной терапии половыми стероидами существенно снижает качество жизни пациенток с гипогонадотропным гипогонадизмом, особенно если присутствуют и другие виды гипофизарной недостаточности [33].
Для женщин репродуктивного возраста принципы гормональной терапии основываются на восстановлении нормального уровня половых стероидов и поддержании регулярных циклов. Последовательное примененеие эстрогенов в постоянном адекватном дозовом режиме позволяет добиться регрессии симптомов гипоэстрогении, сочетание с прогестинами в циклическом режиме предупреждает пролиферативное воздействие эстрогенов на эндометрий и молочные железы. С этих позиций для пациенток с гипогонадотропным гипогонадизмом наиболее оптимальной для проведения длительного лечения является комбинация 17β-эстрадиола и дидрогестерона – аналога прогестерона, не теряющего своей активности при пероральном введении [28, 31, 33]. Принимать гормоны предпочтительно непрерывно, в двухфазном циклическом режиме: первые 14 дней принимают перорально 2 мг 17β-эстрадиола, следующие 14 дней – 2 мг 17β-эстрадиола и 10 мг дидрогестерона (дюфастон).
17β-эстрадиол оказывает положительное влияние на состояние урогенитального тракта, показатели липидного спектра крови и плотность костной ткани в различных отделах скелета. Дидрогестерон не обладает побочными гормональными эффектами и не оказывает отрицательного влияния на свертывающую систему крови, углеводный и липидный обмены. Более того, есть данные о том, что применение дидрогестерона в сочетании с 17β-эстрадиолом усиливает защитный эффект эстрогенов на сердечно-сосудистую систему [34].
Показанием к назначению эстрогенгестагенной терапии пациенткам той группы является необратимое нарушение менструальной функции, отсутствие возможности восстановления менструального цикла.
Длительный (более 5 лет) опыт применения комбинации 2 мг 17β-эстрадиола и 10 мг дидрогестерона (дюфастон) у пациенток с гипогонадотропным гипогонадизмом свидетельствует о высокой эффективности и безопасности такого лечения. На фоне гормонального лечения у женщин существенно снижалось число жалоб, улучшалось общее состояние, отмечалось статистически значимое снижение содержания холестерина, триглицеридов, ионизированного кальция и щелочной фосфатазы, повышение МПК в поясничных позвонках на 8–10% и в проксимальной части бедра до 5–6% [28, 31]. Кроме того, на фоне гормональной терапии этими половыми стероидами отмечено существенное повышение качества жизни пациенток [33]
Кроме того, на фоне гормональной терапии этими половыми стероидами отмечено существенное повышение качества жизни пациенток [33]
Эстрогенгестагенную терапию женщинам с гипогонадотропным гипогонадизмом желательно проводить до 50 лет – то есть до возраста предполагаемой менопаузы. После этого рубежа подходы к проведению заместительной гормональной терапии должны быть такими же, как и для всех женщин в климактерическом периоде. Необходимо учесть, что женщины с длительным анамнезом гипогонадизма имеют более высокий риск развития остеопороза. Одной из наиболее важных задач современной клинической эндокринологии является нормализация метаболических изменений, возникающих при недостаточном содержании тех или иных гормонов в организме больного человека. Неполноценность гормонального баланса может сопровождаться различной симптоматикой и, в конечном итоге, приводить к значительному ухудшению качества жизни. Гипогонадизм является полиэтиологическим заболеванием, возникающим на фоне различных вариантов нарушений синтеза и секреции гонадотропинов. В большинстве случаев диагноз может быть подтвержден рутинными гормональными исследованиями без проведения специальных фармакодинамических тестов. Эстрогенгестагенная терапия должна проводиться большинству женщин с центральным гипогонадизмом. Своевременная диагностика гипогонадизма и назначение адекватного лечения помогут существенно улучшить качество жизни женщин репродуктивного возраста с гипоталамо-гипофизарными заболеваниями.
В большинстве случаев диагноз может быть подтвержден рутинными гормональными исследованиями без проведения специальных фармакодинамических тестов. Эстрогенгестагенная терапия должна проводиться большинству женщин с центральным гипогонадизмом. Своевременная диагностика гипогонадизма и назначение адекватного лечения помогут существенно улучшить качество жизни женщин репродуктивного возраста с гипоталамо-гипофизарными заболеваниями.
1. Иловайская И.А. Этиология приобретенного гипопитуитаризма у взрослых. Доктор Ру. 2010: 7 (58, ч. 2): 8–13.
2. De Bellis A., Ruocco G., Battaglia M., Conte M., Coronella C., Tirelli G. et al. Immunological and clinical aspects of lymphocytic hypophysitis. Clin. Sci. (Lond). 2008; 114(6): 413–21.
3. Bondanelli M., De Marinis L., Ambrosio M.R., Monesi M., Valle D., Zatelli M.C. et al. Occurrence of pituitary dysfunction following traumatic brain injury. J. Neurotrauma. 2004; 21(6): 685–96.
4. Meczekalski B., Podfigurna-Stopa A., Warenik-Szymankiewicz A.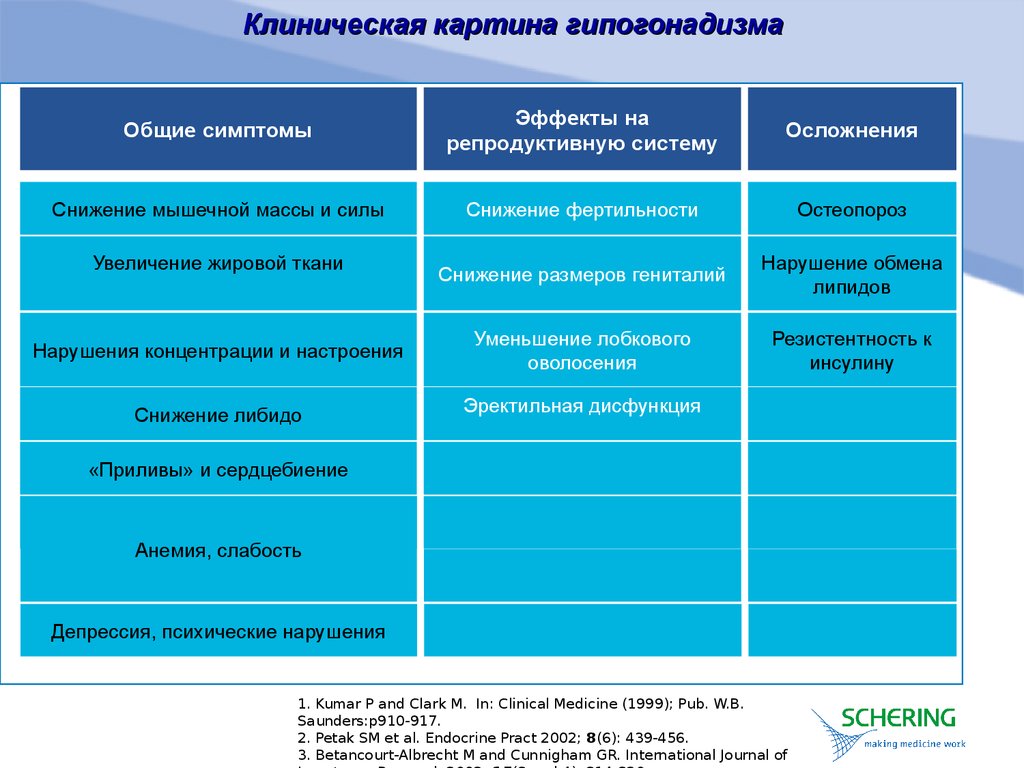 , Genazzani A.R. Functional hypothalamic amenorrhea: current view on neuroendocrine aberrations. Gynecol. Endocrinol. 2008; 24(1): 4–11.
, Genazzani A.R. Functional hypothalamic amenorrhea: current view on neuroendocrine aberrations. Gynecol. Endocrinol. 2008; 24(1): 4–11.
5. Marshall L. A. Clinical evaluation of amenorrhea in active and athletic women. Clin. Sports Med. 1994; 13: 371–87.
6. Berga S.L., Loucks-Daniels T.L., Adler L.J., Chrousos G.P., Cameron J.L., Matthews K.A., Marcus M.D. Cerebrospinal fluid levels of corticotropin-releasing hormone in women with functional hypothalamic amenorrhea. Am. J. Obstet. Gynecol. 2000; 182(4): 776–81; discussion 781–4.
7. Genazzani A.D. Neuroendocrine aspects of amenorrhea related to stress. Pediatr. Endocrinol. Rev. 2005; 2(4): 661–8.
8. Rivier C., Brownstein M., Spiess J., Rivier J., Vale W. In vivo corticotropin-releasing factor-induced secretion of adrenocorticotropin, beta-endorphin, and corticosterone. Endocrinology. 1982; 110(1): 272–78.
9. Moschos S., Chan J.L., Mantzoros C.S. Leptin and reproduction: a review. Fertil. Steril. 2002; 77: 433–44.
10. Ahima R.S. Body fat, leptin, and hypothalamic amenorrhea. N. Engl. J. Med. 2004; 351: 959–62.
Ahima R.S. Body fat, leptin, and hypothalamic amenorrhea. N. Engl. J. Med. 2004; 351: 959–62.
11. Carro E., Pinilla L., Seoane L.M., Considine R.V., Aguilar E., Casanueva F.F., Dieguez C. Influence of endogenous leptin tone on the estrous cycle and luteinizing hormone pulsatility in female rats. Neuroendocrinology. 1997; 66(6): 375–7.
12. Herpertz S., Albers N., Wagner R., Pelz B., Köpp W., Mann K. et al. Longitudinal changes of circadian leptin, insulin and cortisol plasma levels and their correlation during refeeding in patients with anorexia nervosa. Eur. J. Endocrinol. 2000; 142(4): 373–9.
13. Andrico S., Gambera A., Specchia C., Pellegrini C., Falsetti L., Sartori E. Leptin in functional hypothalamic amenorrhoea. Hum. Reprod. 2002; 17(8): 2043–8.
14. Welt C.K., Chan J.L., Bullen J., Murphy R., Smith P., DePaoli A.M. et al. Recombinant human leptin in women with hypothalamic amenorrhea. N. Engl. J. Med. 2004; 351(10): 987–97.
15. Pedrazzini T., Pralong F., Grouzmann E.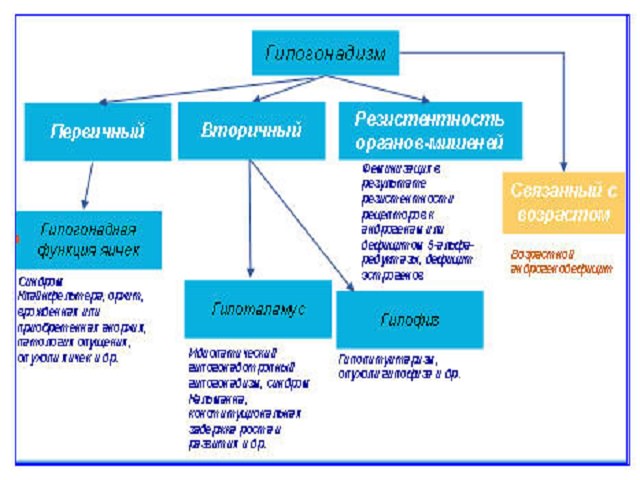 Neuropeptide Y: the universal soldier. Cell. Mol. Life Sci. 2003; 60: 350–77.
Neuropeptide Y: the universal soldier. Cell. Mol. Life Sci. 2003; 60: 350–77.
16. Wójcik-Gładysz A., Polkowska J. Neuropeptide Y — a neuromodulatory link between nutrition and reproduction at the central nervous system level. Reprod. Biol. 2006; 6 (Suppl. 2): 21–8.
17. Cummings D.E., Weigle D.S., Frayo R.S., Breen P.A., Ma M.K., Dellinger E.P., Purnell J.Q. Plasma ghrelin levels after diet-induced weight loss or gastric bypass surgery. N. Engl. J. Med. 2002; 346(21): 1623–30.
18. Schneider L.F., Warren M.P. Functional hypothalamic amenorrhea is associated with elevated ghrelin and disordered eating. Fertil. Steril. 2006; 86(6): 1744–9.
19. Tolle V., Kadem M., Bluet-Pajot M.T., Frere D., Foulon C., Bossu C. et al. Balance in ghrelin and leptin plasma levels in anorexia nervosa patients and constitutionally thin women. J. Clin. Endocrinol. Metab. 2003; 88(1): 109–16.
20. Schneider L.F., Warren M.P. Functional hypothalamic amenorrhea is associated with elevated ghrelin and disordered eating.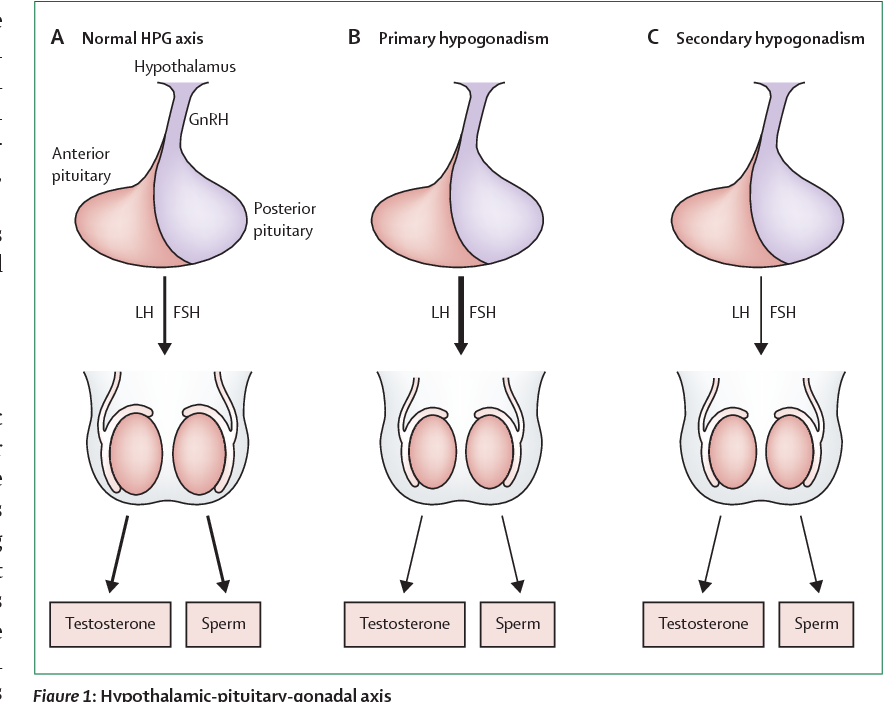 Fertil. Steril. 2006; 86(6): 1744–9.
Fertil. Steril. 2006; 86(6): 1744–9.
21. Chan J.L., Bullen J., Lee J.H., Yiannakouris N., Mantzoros C.S. Ghrelin levels are not regulated by recombinant leptin administration and/or three days of fasting in healthy subjects. J. Clin. Endocrinol. Metab. 2004; 89(1): 335–43.
22. De Souza M.J., Leidy H.J., O’Donnell E., Lasley B., Williams N.I. Fasting ghrelin levels in physically active women: relationship with menstrual disturbances and metabolic hormones. J. Clin. Endocrinol. Metab. 2004; 89(7): 3536–42.
23. Marcus M.D., Loucks T.L., Berga S.L. Psychological correlates of functional hypothalamic amenorrhea. Fertil. Steril. 2001; 76(2): 310–6.
24. Bry-Gauillard H., Trabado S., Bouligand J., Sarfati J., Francou B., Salenave S. et al. Congenital hypogonadotropic hypogonadism in females: clinical spectrum, evaluation and genetics. Ann. Endocrinol. (Paris). 2010; 71(3): 158–62.
25. Tsutsumi R., Webster N.J. GnRH pulsatility, the pituitary response and reproductive dysfunction. Endocr. J. 2009; 56(6): 729–37.
Endocr. J. 2009; 56(6): 729–37.
26. Зыряева Н.А. Системные изменения и их коррекция при гипогонадотропном гипогонадизме у женщин: Автореф. дис. … канд. мед. наук. М.; 2004. 29 с.
27. Иловайская И.А., Зекцер В.Ю., Пищулин А.А., Гончаров Н.П., Марова Е.И. Эффективность заместительной гормональной терапии в лечении женщин с гипогонадотропным гипогонадизмом. Акушерство и гинекология. 2005; 4: 53–4.
28. Зекцер В.Ю., Иловайская И.А., Ильин А.В., Колесникова Г.С., Марова Е.И., Мельниченко Г.А. Нарушения метаболизма и их коррекция у женщин с гипогонадотропной аменореей. Ожирение и метаболизм. 2006; 4: 54–7.
29. Иловайская И.А. Диагностика и лечение гипопитуитаризма. В кн.: Дедов И.И., ред. Клиническая нейроэндокринология. М.: УП Принт; 2011: 220–38.
30. Дедов И.И., Марова Е.И., Иловайская И.А., Манченко О.В. Гипогонадотропный гипогонадизм у женщин. Акушерство и гинекология. 2001; 3: 6-10.
31. Иловайская И.А., Зекцер В.Ю., Ильин А.В., Гончаров Н.П., Дедов И.И. Эффекты длительного применения эстроген-гестагенной терапии у женщин репродуктивного возраста с изолированным гипогонадотропным гипогонадизмом.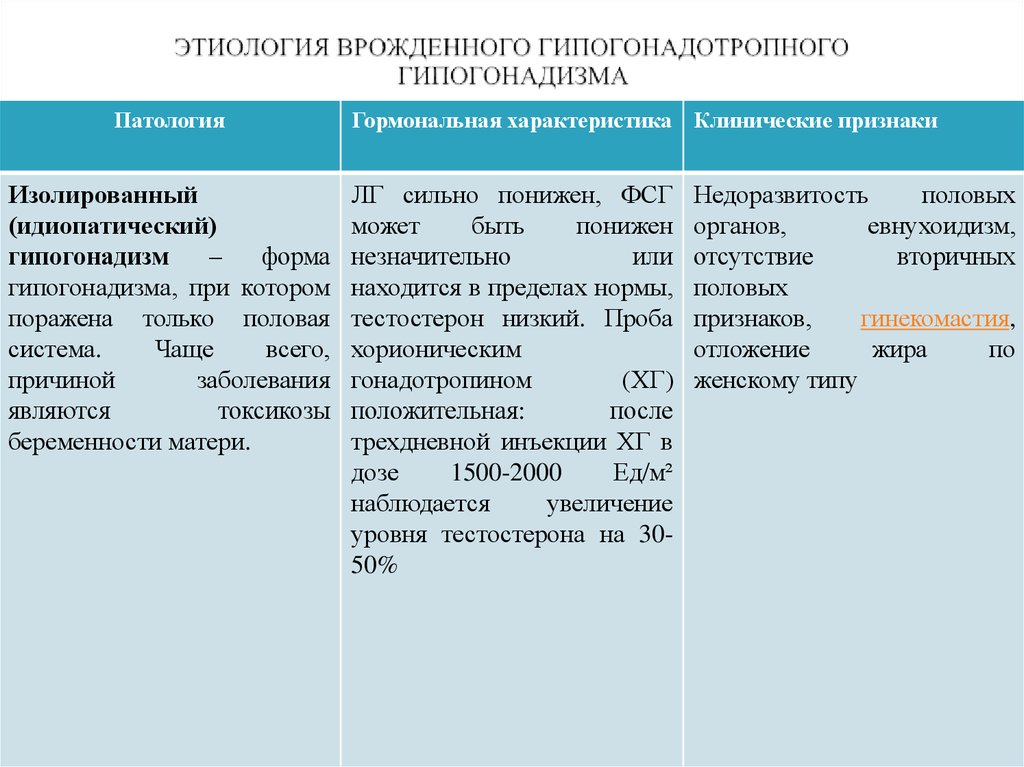 Ожирение и метаболизм. 2010; 1: 52–7.
Ожирение и метаболизм. 2010; 1: 52–7.
32.Дедов И.И., Мельниченко Г.А., Романцова Т.И., Дзеранова Л.К. и др. Гиперпролактинемия. Современные подходы и старые проблемы. Вестник репродуктивного здоровья. 2009; 2: 2–8.
33.Иловайская И.А., Зекцер В.Ю., Михайлова Д.С., Гончаров Н.П., Мельниченко Г.А. Влияние заместительной гормональной терапии на качество жизни пациенток с гипогонадотропным гипогонадизмом. Вопросы гинекологии, акушерства и перинатологии. 2008; 7(3): 48–55.
34.Seeger H., Mueck A.O. Effects of dydrogesterone on the vascular system. Gynecol. Endocrinol. 2007; 23 (Suppl. 1): 2–8.
Дедов Иван Иванович, доктор медицинских наук, профессор, академик РАН и РАМН, директор ФГБУ Эндокринологический научный центр Минздравсоцразвития РФ, директор Федерального диабетологического центра Минздравсоцразвития РФ, заведующий кафедрой эндокринологии Первого МГМУ им. И.М. Сеченова, президент РАМН, лауреат премии и золотой медали им. Н.И. Пирогова, заслуженный деятель науки РФ
Адрес: 117036, Россия, Москва, ул. Дм. Ульянова, д. 11. Телефон: 8 (499) 124-43-00. E-mail: [email protected]
Дм. Ульянова, д. 11. Телефон: 8 (499) 124-43-00. E-mail: [email protected]
Мельниченко Галина Афанасьевна, доктор медицинских наук, профессор, заместитель директора по научной работе ФГБУ Эндокринологический научный центр Минздравсоцразвития России, директор Института клинической эндокринологии Эндокринологического научного центра, академик РАМН
Адрес: 117036, Россия, Москва, ул. Дм. Ульянова, д. 11. Телефон: 8 (495) 500-00-96. E-mail: [email protected]
Иловайская Ирэна Адольфовна, кандидат медицинских наук, доцент, ведущий научный сотрудник отделения терапевтической эндокринологии ГБУЗ МО Московский областной научно-исследовательский клинический институт (МОНИКИ) им. М.Ф. Владимирского
Адрес: 129110, Россия, Москва, ул. Щепкина, д. 61/2, корпус 9. Телефон: 8 (901) 545-38-09. E-mail: [email protected]@yandex.ru
Гипогонадизм – симптомы, причины и способы лечения
Приходила на УЗИ органов малого таза. Врач задавала много вопросов, интересовалась проблемой, из-за которой я пришла. Показывала и рассказывала, какая ситуация на сегодняшний день. Все ок! Стоимость УЗИ адекватная. Мне все понравилось! Отдельно хочу отметить девушку на ресепшн. Очень приятная и вежливая.
Показывала и рассказывала, какая ситуация на сегодняшний день. Все ок! Стоимость УЗИ адекватная. Мне все понравилось! Отдельно хочу отметить девушку на ресепшн. Очень приятная и вежливая.
Последние несколько лет посещаю данную клинику. Наблюдаюсь у гинеколога Серёгиной Анны Андреевны.
Хочу поблагодарить врача Витонене Надежду Владимировну за внимание, чуткость и высокий профессионализм. Муж наблюдается у Надежды Владимировны первый год, но очень доволен.
Делала в этом центре УЗИ сердца, а ранее проходила и другие исследования. Все понравилось: удобное расположение клиники, вежливый персонал, чисто, всё прошло без задержек и профессионально выполнена процедура.
А мне все понравилось. Ничего лишнего не навязывают. Пришла к терапевту с головной болью и давлением, всю осмотрели, послушали, ни сантиметра не пропустили. Результаты анализов в этот же день. Все потом разъяснили, что к чему. Я довольна.
Была на приеме у Серегиной Анны Андреевны. Тактичный, подробный доктор. Не назначила бессмысленных анализов, осталось хорошее впечатление.
Не назначила бессмысленных анализов, осталось хорошее впечатление.
Записалась на УЗИ срочно, попала к первому свободному узисту рядом с домом. Доктор побеседовал со мной, вникла,тщательно посмотрела. Дала рекомендации, как лучше поступить в моем случае. Пришлось немного подождать заключение, но это мелочи. Врач в женской консультации очень похвалила, сказала,что описано очень подробно и хорошо, записала меня на рекомендуемую операцию. Доктор молодая, но толковая. Буду советовать
Прекрасный медцентр с профессиональными и дружелюбными специалистами!! Спасибо!
Была сегодня в этой клинике на узи у доктора Кузнецовой. Понравилось все! Вежливый персонал, вежливая спокойная врач. Всё было сделано быстро. Работать начинают рано, что позволяет успеть сделать все процедуры до рабочего дня. С удовольствием обращусь ещё!
Обожаю Инвитро в целом, в частности этот центр. Была на приеме у гинеколога Рачевской, очень приятная девушка, которая успокоила во многих вещах, все очень аккуратно, результаты быстрые
Практически не пишу отзывы, лень) Но сегодня не удержалась. В этой клинике есть замечательный гинеколог Серегина Анна Андреевна. Великолепный врач!!!! Брала марок так, что я почти ни чего не почувствовала!!!! От говорила от преждеаременных анализов. Ответила на все вопросы Думаю, другие врачи., предложили бы оплатить за эти вопросы, как за консультацию. У Анны Андреевны очень лёгкая рука. Хоть я могу получать бесплатную услугу гинеколога по ОМС, точно теперь стану ее постоянным клиентом… Очень надеюсь, что мне не часто понадобится данная услуга.
В этой клинике есть замечательный гинеколог Серегина Анна Андреевна. Великолепный врач!!!! Брала марок так, что я почти ни чего не почувствовала!!!! От говорила от преждеаременных анализов. Ответила на все вопросы Думаю, другие врачи., предложили бы оплатить за эти вопросы, как за консультацию. У Анны Андреевны очень лёгкая рука. Хоть я могу получать бесплатную услугу гинеколога по ОМС, точно теперь стану ее постоянным клиентом… Очень надеюсь, что мне не часто понадобится данная услуга.
Все прошло отлично. Приняли четко по записи, очень приятный персонал и врач.
Очень часто обращаюсь в эту клинику. Анализы берут максимально аккуратно. Консультации и диагнозтика у гинеколога Булатовой Любовь Николаевны всегда на высшем уровне (хожу к ней уже несколько лет). Девушки администраторы всегда приветливы и решают любой вопрос. Спасибо вам всем за качественную работу!
На приеме мне делали УЗИ для беременных. Специалист общался со мной корректно, все было хорошо. Клинику выбрала по близости к дому, наличию необходимой услуги. Результаты диагностики получила на руки.
Результаты диагностики получила на руки.
Была на приеме у гинеколога Рачевской Юлии Юрьевны. Все понятно, подробно рассказывала, рисовала. Ушла из кабинета с полным пониманием своей проблемы. Доктор молодая, но очень толковая. Очереди не было, прием был по времени. Отношение доброжелательное
Сегодня посетил данную клинику. Сдал анализ на IgG к хеликобактер пилори, забор на 5+ точно, быстро, без синяков. Результаты уже пришли. Сделал узи органов брюшной полости, тоже прошло всё отлично. Персонал вежливый, опрятный. Приятно, что рядом с домом есть такая клиника.
Доктор Витонене Н. В. очень внимательна к пациенту, профессиональна. Я очень доволен. Обратился по поводу проблем с кишечником в постоперационный период. Операция проводилась по поводу абдоминальной ишемии кишечника в конце сентября.
Был на узи. Все рассказали по поводу здоровья. Обслуживанием доволен
Великолепный доктор эндокринолог Забелина Валерия Дмитриевна. Опытная, внимательная, добрая. Профессиональный и вежливый весь персонал отделения на сходненской.
Сдавала плановые анализы, результаты пришли на следующий день. На консультации врач всё подробно рассказала. После визита осталась очень довольна!
Испытываю боли в эпигастральной области. Прекрасно знаю о своём хроническом гастрите, поэтому изначально пошёл в городскую поликлинику, хотел взять направления на УЗИ, ФГДС и анализы. В итоге врач назначила таблетки, которые я и без неё пил. =) Ну и просила сдать на IgG к хеликобактер пилори. Чтобы не ждать ещё 2 недели, решил сделать УЗИ органов брюшной полости, чтобы исключить другие болячки, в ближайшей платной клинике, заодно и анализ сдать. Всё сделал меньше чем за час. И то потому, что сам рано приехал.
Прекрасный чуткий персонал, и на ресепшен, и медсестра которая брала кровь на анализы, и врач-гинеколог. Все максимально приятные, тактичные и заботливые. Благодарю за качество обслуживания.
Очень хорошая клиника. Была на УЗИ у Булатовой Л. Н. — замечательный специалист, дала дополнительные рекомендации по лечению, так как у меня есть особенности в строении организма. В клинике очень чисто, все на высшем уровне! Спасибо!
В клинике очень чисто, все на высшем уровне! Спасибо!
Замечательное место! Девушки на посту очень милые, быстро работают. В отделении чисто, в очереди почти никогда не попадала. Хожу сюда к Серегиной Анне Андреевне уже больше года: самый грамотный, ответственный, внимательный и душевный врач в своей области, к которому я когда-либо попадала)
Очень приятный в общении врач, вежливый, внимательный, с чувством юмора, заинтересованный в клиенте, как мне показалось, никуда не торопящийся, внимательно выслушивающий, знает свое дело, комфортно, спокойно. Все очень хорошо прошло. Первое впечатление очень приятное. Анна Андреевна сделал все что должна была сделать, выслушала, осмотрела, рассказала какие анализы, зачем, какое лечение сейчас можно, что бы облегчить ситуацию. Прием длился минут 25. Все хорошо. Повторно обратилась бы.
Показать больше
Этиология и лечение гипогонадизма у подростков
1. Boyar R, Finkelstein J, Roffwarg H, et al. Синхронизация повышенной секреции лютеинизирующего гормона со сном в период полового созревания. N Engl J Med. 1972; 287 (12): 582–6. [PubMed] [Google Scholar]
N Engl J Med. 1972; 287 (12): 582–6. [PubMed] [Google Scholar]
2. Apter D, Butzow TL, Laughlin GA, et al. Активность генератора импульсов гонадотропин-рилизинг-гормона в период полового созревания у девочек: пульсирующий и суточный характер циркулирующих гонадотропинов. J Clin Endocrinol Metab. 1993;76(4):940–9. [PubMed] [Google Scholar]
3. Sedlmeyer IL, Palmert MR. Задержка полового созревания: анализ большой серии случаев из академического центра. J Clin Endocrinol Metab. 2002;87(4):1613–20. [PubMed] [Google Scholar]
4. von Kalckreuth G, Haverkamp F, Kessler M, et al. Конституциональная задержка роста и полового созревания: действительно ли они достигают своего целевого роста? Горм Рез. 1991;35(6):222–5. [PubMed] [Google Scholar]
5. Bergada I, Bergada C. Длительное лечение низкими дозами тестостерона при конституциональной задержке роста и полового созревания: влияние на созревание костного возраста и прогрессирование полового созревания. J Pediatr Endocrinol Metab. 1995;8(2):117–22. [PubMed] [Google Scholar]
1995;8(2):117–22. [PubMed] [Google Scholar]
6. Achermann JC, Weiss J, Lee EJ, et al. Наследственные нарушения гонадотропных гормонов. Мол Селл Эндокринол. 2001; 179(1–2):89–96. [PubMed] [Google Scholar]
7. Kohler B, Lin L, Ferraz-de-Souza B, et al. Пять новых мутаций стероидогенного фактора 1 (SF1, NR5A1) у 46 пациентов XY с тяжелой недостаточностью андрогенов, но без надпочечниковой недостаточности. Хум Мутат. 2008;29(1):59–64. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Биасон-Лаубер А., Шенле Э.Дж. По-видимому, нормальная дифференцировка яичников у девочки препубертатного возраста с транскрипционно неактивным стероидогенным фактором 1 (NR5A1/SF-1) и недостаточностью коры надпочечников. Am J Hum Genet. 2000;67(6):1563–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Muscatelli F, Strom TM, Walker AP, et al. Мутации в гене DAX-1 вызывают как врожденную гипоплазию надпочечников, сцепленную с Х-хромосомой, так и гипогонадотропный гипогонадизм. Природа. 1994;372(6507):672–6. [PubMed] [Академия Google]
Природа. 1994;372(6507):672–6. [PubMed] [Академия Google]
10. Ян Ф., Ханаки К., Киношита Т. и др. Врожденная гипоплазия надпочечников с поздним началом, вызванная новой мутацией гена DAX-1. Eur J Педиатр. 2009; 168: 329–31. [PubMed] [Google Scholar]
11. Habiby RL, Boepple P, Nachtigall L, et al. Врожденная гипоплазия надпочечников с гипогонадотропным гипогонадизмом: доказательства того, что мутации DAX-1 приводят к комбинированным гипоталамо-гипофизарным дефектам продукции гонадотропинов. Джей Клин Инвест. 1996; 98(4):1055–62. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Mantovani G, De Menis E, Borretta G, et al. DAX1 и врожденная гипоплазия надпочечников, сцепленная с Х-хромосомой: клинический и молекулярный анализ у пяти пациентов. Евр Дж Эндокринол. 2006;154(5):685–9. [PubMed] [Google Scholar]
13. Franco B, Guioli S, Pragliola A, et al. Ген, делетированный при синдроме Каллмана, имеет гомологию с адгезией нервных клеток и молекулами поиска пути аксонов. Природа. 1991;353(6344):529–36. [PubMed] [Google Scholar]
Природа. 1991;353(6344):529–36. [PubMed] [Google Scholar]
14. Vogl TJ, Stemmler J, Heye B, et al. Синдром Каллмана в сравнении с идиопатическим гипогонадотропным гипогонадизмом при МРТ. Радиология. 1994;191(1):53–7. [PubMed] [Google Scholar]
15. Оливейра Л.М., Семинара С.Б., Беранова М. и соавт. Значение аутосомных генов при синдроме Каллмана: корреляции генотип-фенотип и нейроэндокринные характеристики. J Clin Endocrinol Metab. 2001;86(4):1532–1538. [PubMed] [Google Scholar]
16. Сато Н., Кацумата Н., Кагами М. и соавт. Клиническая оценка и анализ мутаций синдрома Каллмана 1 (KAL1) и рецептора 1 фактора роста фибробластов (FGFR1 или KAL2) в пяти семьях и 18 спорадических пациентах. J Clin Endocrinol Metab. 2004;89(3): 1079–88. [PubMed] [Google Scholar]
17. Piteloud N, Zhang C, Pignatelli D, et al. Мутация потери функции в гене прокинетина 2 вызывает синдром Каллмана и нормосмический идиопатический гипогонадотропный гипогонадизм. Proc Natl Acad Sci U S A. 2007;104(44):17447–52. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2007;104(44):17447–52. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. de Roux N, Young J, Misrahi M, et al. Семья с гипогонадотропным гипогонадизмом и мутациями в рецепторе гонадотропин-рилизинг-гормона. N Engl J Med. 1997;337(22):1597–602. [PubMed] [Google Scholar]
19. де Ру Н., Милгром Э. Наследственные нарушения рецепторов ГнРГ и гонадотропина. Мол Селл Эндокринол. 2001; 179 (1–2): 83–7. [PubMed] [Google Scholar]
20. de Roux N, Genin E, Carel JC, et al. Гипогонадотропный гипогонадизм из-за потери функции производного KiSS1 пептидного рецептора GPR54. Proc Natl Acad Sci U S A. 2003;100(19):10972–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Raivio T, Falardeau J, Dwyer A, et al. Реверсия идиопатического гипогонадотропного гипогонадизма. N Engl J Med. 2007;357(9): 863–73. [PubMed] [Google Scholar]
22. Pfaffle RW, Blankenstein O, Wuller S, et al. Комбинированный дефицит гормонов гипофиза: роль Pit-1 и Prop-1. Приложение Acta Pediatr. 1999;88(433):33–41. [PubMed] [Google Scholar]
1999;88(433):33–41. [PubMed] [Google Scholar]
23. Lazar L, Gat-Yablonski G, Kornreich L, et al. Мутация гена PROP-1 (R120C), вызывающая комбинированный дефицит гормонов гипофиза с вариабельным клиническим течением у восьми братьев и сестер одной еврейской марокканской семьи. Горм Рез. 2003;60(5):227–31. [PubMed] [Академия Google]
24. Dasen JS, Barbera JP, Herman TS, et al. Временная регуляция парного комплекса гомеодоменовый репрессор/корепрессор TLE и родственный активатор необходима для органогенеза гипофиза. Гены Дев. 2001;15(23):3193–207. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Dattani MT, Martinez-Barbera JP, Thomas PQ, et al. Мутации в гене гомеобокса HESX1/Hesx1 связаны с септооптической дисплазией у человека и мыши. Нат Жене. 1998;19(2):125–33. [PubMed] [Академия Google]
26. Хаддад Н.Г., Югстер Э.А. Гипопитуитаризм и аномалии развития нервной системы в связи со структурными дефектами центральной нервной системы у детей с гипоплазией зрительного нерва. J Pediatr Endocrinol Metab. 2005;18(9):853–8. [PubMed] [Google Scholar]
J Pediatr Endocrinol Metab. 2005;18(9):853–8. [PubMed] [Google Scholar]
27. Pfaeffle RW, Hunter CS, Savage JJ, et al. Три новые миссенс-мутации в гене LHX4 связаны с различными дефицитами гормонов гипофиза. J Clin Endocrinol Metab. 2008;93(3):1062–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Kelberman D, Rizzoti K, Avilion A, et al. Мутации внутри Sox2/SOX2 связаны с аномалиями гипоталамо-гипофизарно-гонадной оси у мышей и людей. Джей Клин Инвест. 2006;116(9):2442–55. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Farooqi IS, Matarese G, Lord GM, et al. Благотворное влияние лептина на ожирение, гипореактивность Т-клеток и нейроэндокринную/метаболическую дисфункцию при врожденном дефиците лептина у человека. Джей Клин Инвест. 2002;110(8):1093–103. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Farooqi IS, Wangensteen T, Collins S, et al. Клинико-молекулярно-генетический спектр врожденной недостаточности рецептора лептина. N Engl J Med. 2007;356(3):237–47. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2007;356(3):237–47. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Wharton RH, Loechner KJ. Генетические и клинические достижения синдрома Прадера-Вилли. Curr Opin Педиатр. 1996;8(6):618–24. [PubMed] [Google Scholar]
32. Jeffcoate WJ, Laurance BM, Edwards CR, et al. Эндокринная функция при синдроме Прадера-Вилли. Клин Эндокринол (Oxf) 1980;12(1):81–9. [PubMed] [Google Scholar]
33. Crino A, Schiaffini R, Ciampalini P, et al. Гипогонадизм и пубертатное развитие при синдроме Прадера-Вилли. Eur J Педиатр. 2003;162(5):327–33. [PubMed] [Google Scholar]
34. Schulze A, Mogensen H, Hamborg-Petersen B, et al. Фертильность при синдроме Прадера-Вилли: история болезни с синдромом Ангельмана у потомства. Акта Педиатр. 2001;90(4):455–9. [PubMed] [Google Scholar]
35. Акефельдт А., Торнхейдж С.Дж., Гиллберг С. Женщина с синдромом Прадера-Вилли рожает здоровую девочку. Dev Med Child Neurol. 1999;41(11):789–90. [PubMed] [Google Scholar]
36. Мортон М. В., Веман П. Психосоциальные и эмоциональные последствия у лиц с черепно-мозговой травмой: обзор литературы и рекомендации. Инъекция мозга. 1995;9(1):81–92. [PubMed] [Google Scholar]
В., Веман П. Психосоциальные и эмоциональные последствия у лиц с черепно-мозговой травмой: обзор литературы и рекомендации. Инъекция мозга. 1995;9(1):81–92. [PubMed] [Google Scholar]
37. Kelly DF, Gonzalo IT, Cohan P, et al. Гипопитуитаризм после черепно-мозговой травмы и аневризматического субарахноидального кровоизлияния: предварительный отчет. Дж Нейрохирург. 2000;93(5):743–52. [PubMed] [Google Scholar]
38. Lieberman SA, Oberoi AL, Gilkison CR, et al. Распространенность нейроэндокринной дисфункции у пациентов, перенесших черепно-мозговую травму. J Clin Endocrinol Metab. 2001;86(6):2752–6. [PubMed] [Академия Google]
39. Benvenga S, Campenni A, Ruggeri RM, et al. Клинический обзор 113: гипопитуитаризм, вторичный по отношению к черепно-мозговой травме. J Clin Endocrinol Metab. 2000;85(4):1353–61. [PubMed] [Google Scholar]
40. Tanriverdi F, Senyurek H, Unluhizarci K, et al. Высокий риск гипопитуитаризма после черепно-мозговой травмы: проспективное исследование функции передней доли гипофиза в остром периоде и через 12 мес после травмы. J Clin Endocrinol Metab. 2006;91(6):2105–11. [PubMed] [Академия Google]
J Clin Endocrinol Metab. 2006;91(6):2105–11. [PubMed] [Академия Google]
41. Merchant TE, Williams T, Smith JM, et al. Долучевые эндокринопатии у детей с опухолями головного мозга, определяемые с помощью динамических тестов эндокринной функции. Int J Radiat Oncol Biol Phys. 2002;54(1):45–50. [PubMed] [Google Scholar]
42. Gonc EN, Yordam N, Ozon A, et al. Эндокринологические результаты различных вариантов лечения детей с краниофарингиомой: ретроспективный анализ 66 случаев. Педиатр Нейрохирург. 2004;40(3):112–9. [PubMed] [Google Scholar]
43. Mills JL, Fears TR, Robison LL, et al. Менархе у когорты из 188 пациентов, перенесших острый лимфобластный лейкоз в течение длительного времени. J Педиатр. 1997;131(4):598–602. [PubMed] [Google Scholar]
44. Constine LS, Woolf PD, Cann D, et al. Гипоталамо-гипофизарная дисфункция после лучевой терапии опухолей головного мозга. N Engl J Med. 1993;328(2):87–94. [PubMed] [Google Scholar]
45. Rappaport R, Brauner R, Czernichow P, et al. Влияние облучения гипоталамуса и гипофиза на половое развитие детей с опухолями черепа. J Clin Endocrinol Metab. 1982; 54 (6): 1164–8. [PubMed] [Google Scholar]
Влияние облучения гипоталамуса и гипофиза на половое развитие детей с опухолями черепа. J Clin Endocrinol Metab. 1982; 54 (6): 1164–8. [PubMed] [Google Scholar]
46. Nandagopal R, Laverdiere C, Mulrooney D, et al. Эндокринные поздние эффекты терапии рака у детей: отчет детской онкологической группы. Горм Рез. 2008;69(2): 65–74. [PubMed] [Google Scholar]
47. Чан Дж.Л., Манцорос С.С. Роль лептина в состояниях энергетической депривации: нормальная физиология человека и клинические последствия гипоталамической аменореи и нервной анорексии. Ланцет. 2005;366(9479):74–85. [PubMed] [Google Scholar]
48. Welt CK, Chan JL, Bullen J, et al. Рекомбинантный человеческий лептин у женщин с гипоталамической аменореей. N Engl J Med. 2004;351(10):987–97. [PubMed] [Google Scholar]
49. Nielsen J, Wohlert M. Хромосомные аномалии обнаружены среди 34,910 новорожденных детей: результаты 13-летнего исследования заболеваемости в Орхусе, Дания. Хам Жене. 1991;87(1):81–3. [PubMed] [Google Scholar]
50. Bondy CA. Уход за девочками и женщинами с синдромом Тернера: руководство Группы по изучению синдрома Тернера. J Clin Endocrinol Metab. 2007;92(1):10–25. [PubMed] [Google Scholar]
Bondy CA. Уход за девочками и женщинами с синдромом Тернера: руководство Группы по изучению синдрома Тернера. J Clin Endocrinol Metab. 2007;92(1):10–25. [PubMed] [Google Scholar]
51. Pasquino AM, Passeri F, Pucarelli I, et al. Спонтанное половое развитие при синдроме Тернера. Итальянская группа по изучению синдрома Тернера. J Clin Endocrinol Metab. 1997;82(6):1810–3. [PubMed] [Google Scholar]
52. Ховатта О. Беременность у женщин с синдромом Тернера. Энн Мед. 1999;31(2):106–10. [PubMed] [Google Scholar]
53. Fechner PY, Davenport ML, Qualy RL, et al. Различия в секреции фолликулостимулирующего гормона между моносомией 45, X при синдроме Тернера и мозаицизмом 45, X/46, XX проявляются в раннем возрасте. J Clin Endocrinol Metab. 2006;91(12):4896–902. [PubMed] [Google Scholar]
54. Bojesen A, Juul S, Gravholt CH. Пренатальная и постнатальная распространенность синдрома Клайнфельтера: исследование национального реестра. J Clin Endocrinol Metab. 2003;88(2):622–6. [PubMed] [Академия Google]
[PubMed] [Академия Google]
55. Абулхасан С.Дж., Тайел С.М., аль-Авади С.А. Мозаичный синдром Тернера: цитогенетика против FISH. Энн Хам Жене. 1999; 63 (часть 3): 199–206. [PubMed] [Google Scholar]
56. Rizzolio F, Bione S, Sala C, et al. Хромосомные перестройки в Xq и преждевременная недостаточность яичников: картирование 25 новых случаев и обзор литературы. Хум Репрод. 2006;21(6):1477–83. [PubMed] [Google Scholar]
57. Linden MG, Bender BG, Harmon RJ, et al. 47, XXX: каков прогноз? Педиатрия. 1988;82(4):619–30. [PubMed] [Google Scholar]
58. Lin HJ, Ndiforchu F, Patell S. Экстрофия клоаки у ребенка 47 лет XXX: обзор пороков развития мочеполовой системы у пациентов с тройным X. Am J Med Genet. 1993;45(6):761–3. [PubMed] [Google Scholar]
59. Holland CM. 47, XXX у подростка с преждевременной недостаточностью яичников и аутоиммунным заболеванием. J Pediatr Adolesc Gynecol. 2001;14(2):77–80. [PubMed] [Google Scholar]
60. Matthews CH, Borgato S, Beck-Peccoz P, et al. Первичная аменорея и бесплодие вследствие мутации бета-субъединицы фолликулостимулирующего гормона. Нат Жене. 1993;5(1):83–6. [PubMed] [Google Scholar]
Первичная аменорея и бесплодие вследствие мутации бета-субъединицы фолликулостимулирующего гормона. Нат Жене. 1993;5(1):83–6. [PubMed] [Google Scholar]
61. Layman LC, Lee EJ, Peak DB, et al. Задержка полового созревания и гипогонадизм, вызванные мутациями в гене бета-субъединицы фолликулостимулирующего гормона. N Engl J Med. 1997;337(9):607–11. [PubMed] [Google Scholar]
62. Lindstedt G, Nystrom E, Matthews C, et al. Дефицит фоллитропина (ФСГ) у бесплодного мужчины из-за мутации гена ФСГбета. Синдром нормального полового созревания и вирилизации, но недоразвитые яички с азооспермией, низким уровнем ФСГ, но высоким уровнем лютропина и нормальной концентрацией тестостерона в сыворотке. Clin Chem Lab Med. 1998;36(8):663–5. [PubMed] [Google Scholar]
63. Weiss J, Axelrod L, Whitcomb RW, et al. Гипогонадизм, вызванный заменой одной аминокислоты в бета-субъединице лютеинизирующего гормона. N Engl J Med. 1992;326(3):179–83. [PubMed] [Google Scholar]
64. Furui K, Suganuma N, Tsukahara S, et al. Выявление двух точечных мутаций в гене, кодирующем бета-субъединицу лютеинизирующего гормона (ЛГ), ассоциированных с иммунологически аномальными вариантами ЛГ. J Clin Endocrinol Metab. 1994;78(1):107–13. [PubMed] [Академия Google]
Выявление двух точечных мутаций в гене, кодирующем бета-субъединицу лютеинизирующего гормона (ЛГ), ассоциированных с иммунологически аномальными вариантами ЛГ. J Clin Endocrinol Metab. 1994;78(1):107–13. [PubMed] [Академия Google]
65. Kremer H, Kraaij R, Toledo SP, et al. Мужской псевдогермафродитизм вследствие гомозиготной миссенс-мутации гена рецептора лютеинизирующего гормона. Нат Жене. 1995;9(2):160–4. [PubMed] [Google Scholar]
66. Latronico AC, Anasti J, Arnhold IJ, et al. Краткий отчет: резистентность яичек и яичников к лютеинизирующему гормону, вызванная инактивирующими мутациями гена рецептора лютеинизирующего гормона. N Engl J Med. 1996;334(8):507–12. [PubMed] [Google Scholar]
67. Arnhold IJ, Latronico AC, Batista MC, et al. Клинические особенности женщин с резистентностью к лютеинизирующему гормону. Клин Эндокринол (Oxf) 1999;51(6):701–7. [PubMed] [Google Scholar]
68. Айттомаки К. Генетика XX дисгенезии гонад. Am J Hum Genet. 1994;54(5):844–51. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
69. de Zegher F, Jaeken J. Эндокринология синдрома дефицита углеводов гликопротеина типа 1 от рождения до подросткового возраста. Педиатр Рез. 1995; 37 (4 ч. 1): 395–401. [PubMed] [Google Scholar]
70. Gelfand IM, Eugster EA, DiMeglio LA. Представление и клиническое прогрессирование псевдогипопаратиреоза с полигормональной резистентностью и наследственной остеодистрофией Олбрайта: серия случаев. J Педиатр. 2006;149(6): 877–80. [PubMed] [Google Scholar]
71. Lee PA, Houk CP, Ahmed SF, et al. Консенсусное заявление по ведению интерсексуальных расстройств. Международная консенсусная конференция по интерсекс-педиатрии. 2006;118(2):e488–500. [PubMed] [Google Scholar]
72. Michala L, Goswami D, Creighton SM, et al. Синдром Свайера: проявления и исходы. БЖОГ. 2008 г., май; 115 (6): 737–41. [PubMed] [Google Scholar]
73. Zielinska D, Zajaczek S, Rzepka-Gorska I. Опухоли дисгенетических половых желез при синдроме Свайера. J Pediatr Surg. 2007;42(10):1721–4. [PubMed] [Академия Google]
J Pediatr Surg. 2007;42(10):1721–4. [PubMed] [Академия Google]
74. Oakes MB, Eyvazzadeh AD, Quint E, et al. Синдром полной нечувствительности к андрогенам — обзор. J Pediatr Adolesc Gynecol. 2008;21(6):305–10. [PubMed] [Google Scholar]
75. Сарпел У., Палмер С.К., Долгин С.Е. Частота полной нечувствительности к андрогенам у девочек с паховыми грыжами и оценка результатов скрининга путем измерения длины влагалища. J Pediatr Surg. 2005;40(1):133–6. обсуждение: 136–7. [PubMed] [Google Scholar]
76. Коста-Сантос М., Катер С.Е., Охус Р.Дж. Две распространенные мутации CYP17 и корреляции генотип-фенотип у 24 бразильских пациентов с дефицитом 17-гидроксилазы. J Clin Endocrinol Metab. 2004;89(1): 49–60. [PubMed] [Google Scholar]
77. Yang J, Cui B, Sun S, et al. Корреляция фенотип-генотип у восьми китайских пациентов с дефицитом 17альфа-гидроксилазы/17,20 лиазы с пятью новыми мутациями гена CYP17A1. J Clin Endocrinol Metab. 2006;91(9):3619–25. [PubMed] [Google Scholar]
78. al Kandari H, Katsumata N, Alexander S, et al. Гомозиготная мутация гена фермента расщепления боковой цепи P450 (CYP11A1) у пациента 46, XY с надпочечниковой недостаточностью, полной сменой пола и агенезией мозолистого тела. J Clin Endocrinol Metab. 2006;91(8):2821-6. [PubMed] [Google Scholar]
al Kandari H, Katsumata N, Alexander S, et al. Гомозиготная мутация гена фермента расщепления боковой цепи P450 (CYP11A1) у пациента 46, XY с надпочечниковой недостаточностью, полной сменой пола и агенезией мозолистого тела. J Clin Endocrinol Metab. 2006;91(8):2821-6. [PubMed] [Google Scholar]
79. Baker BY, Lin L, Kim CJ, et al. Неклассическая врожденная липоидная гиперплазия надпочечников: новое нарушение стероидогенного острого регуляторного белка с очень поздним проявлением и нормальными мужскими гениталиями. J Clin Endocrinol Metab. 2006; 91(12):4781–5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
80. Fujieda K, Tajima T, Nakae J, et al. Спонтанное половое созревание у 46, XX лиц с врожденной липоидной гиперплазией коры надпочечников. Овариальный стероидогенез в некоторой степени сохраняется, несмотря на инактивирующие мутации в гене острого регуляторного белка стероидогенеза (StAR). Джей Клин Инвест. 1997;99(6):1265–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]
81. Kaufman FR, Kogut MD, Donnell GN, et al. Гипергонадотропный гипогонадизм у женщин, больных галактоземией. N Engl J Med. 1981;304(17):994–8. [PubMed] [Google Scholar]
Kaufman FR, Kogut MD, Donnell GN, et al. Гипергонадотропный гипогонадизм у женщин, больных галактоземией. N Engl J Med. 1981;304(17):994–8. [PubMed] [Google Scholar]
82. Prestoz LL, Couto AS, Shin YS, et al. Измененные изоформы фолликулостимулирующего гормона у женщин, больных галактоземией. Eur J Педиатр. 1997;156(2):116–20. [PubMed] [Google Scholar]
83. Smith NM, Byyard RW, Bourne AJ. Синдром регрессии яичек — патологоанатомическое исследование 77 случаев. Гистопатология. 1991;19(3):269–72. [PubMed] [Google Scholar]
84. Law H, Mushtaq I, Wingrove K, et al. Гистопатологические особенности синдрома регрессии яичек: связь с возрастом пациента и последствия для лечения. Фетальный педиатр патол. 2006;25(2):119–29. [PubMed] [Google Scholar]
85. Imbeud S, Rey R, Berta P, et al. Дегенерация яичек у трех пациентов с синдромом персистирующего мюллерова протока. Eur J Педиатр. 1995;154(3):187–90. [PubMed] [Google Scholar]
86. Vinci G, Anjot MN, Trivin C, et al. Анализ генетических факторов, участвующих в опущении яичек в когорте из 14 пациентов мужского пола с анорхией. J Clin Endocrinol Metab. 2004;89(12): 6282–5. [PubMed] [Google Scholar]
Анализ генетических факторов, участвующих в опущении яичек в когорте из 14 пациентов мужского пола с анорхией. J Clin Endocrinol Metab. 2004;89(12): 6282–5. [PubMed] [Google Scholar]
87. Уоллес В.Х., Томсон А.Б., Келси Т.В. Радиочувствительность ооцита человека. Хум Репрод. 2003;18(1):117–21. [PubMed] [Google Scholar]
88. Larsen EC, Muller J, Schmiegelow K, et al. Снижение функции яичников у выживших в течение длительного времени после лучевой и химиотерапии рака у детей. J Clin Endocrinol Metab. 2003;88(11):5307–14. [PubMed] [Google Scholar]
89. Lopez Andreu JA, Fernandez PJ, Ferris i Tortajada J, et al. Стойкий измененный сперматогенез у детей, перенесших рак в течение длительного времени. Педиатр Гематол Онкол. 2000;17(1):21–30. [PubMed] [Академия Google]
90. Шалет С.М., Цацулис А., Уайтхед Э. и др. Уязвимость клетки Лейдига человека к радиационному повреждению зависит от возраста. J Эндокринол. 1989;120(1):161–5. [PubMed] [Google Scholar]
91. Steffens M, Beauloye V, Brichard B, et al. Эндокринные и метаболические нарушения у молодых взрослых, перенесших острый лимфобластный лейкоз (ОЛЛ) или неходжкинскую лимфому (НХЛ) в детском возрасте Clin Endocrinol (Oxf) 2008;69(5):819–27. [PubMed] [Google Scholar]
Steffens M, Beauloye V, Brichard B, et al. Эндокринные и метаболические нарушения у молодых взрослых, перенесших острый лимфобластный лейкоз (ОЛЛ) или неходжкинскую лимфому (НХЛ) в детском возрасте Clin Endocrinol (Oxf) 2008;69(5):819–27. [PubMed] [Google Scholar]
92. Rahhal SN, Eugster EA. Неожиданное восстановление функции яичников через много лет после трансплантации костного мозга. J Педиатр. 2008;152(2):289–90. [PubMed] [Google Scholar]
93. Meacham LR, Ghim TT, Crocker IR, et al. Системный подход к выявлению эндокринных нарушений у детей, пролеченных по поводу опухолей головного мозга. Мед Педиатр Онкол. 1997;29(2):86–91. [PubMed] [Google Scholar]
94. Schatz DA, Winter WE. Аутоиммунный полигландулярный синдром. II: клинический синдром и лечение. Эндокринол Метаб Клин Норт Ам. 2002;31(2):339–52. [PubMed] [Google Scholar]
95. Wolff AS, Erichsen MM, Meager A, et al. Аутоиммунный полиэндокринный синдром 1 типа в Норвегии: фенотипическая изменчивость, аутоантитела и новые мутации в гене аутоиммунного регулятора. J Clin Endocrinol Metab. 2007;92(2):595–603. [PubMed] [Google Scholar]
J Clin Endocrinol Metab. 2007;92(2):595–603. [PubMed] [Google Scholar]
96. Ahonen P, Miettinen A, Perheentupa J. Антитела к надпочечникам и стероидным клеткам у пациентов с аутоиммунным полигландулярным заболеванием I типа и риском недостаточности надпочечников и яичников. J Clin Endocrinol Metab. 1987;64(3):494–500. [PubMed] [Google Scholar]
97. Uibo R, Aavik E, Peterson P, et al. Аутоантитела к ферментам цитохрома Р450 P450scc, P450c17 и P450c21 при аутоиммунных полигландулярных заболеваниях I и II типов и при изолированной болезни Аддисона. J Clin Endocrinol Metab. 1994;78(2):323–8. [PubMed] [Google Scholar]
98. Hoek A, Schoemaker J, Drexhage HA. Преждевременная недостаточность яичников и аутоиммунитет яичников. Endocr Rev. 1997;18(1):107–34. [PubMed] [Google Scholar]
99. Buzi F, Badolato R, Mazza C, et al. Синдром аутоиммунной полиэндокринопатии-кандидоза-эктодермальной дистрофии: время пересмотреть диагностические критерии? J Clin Endocrinol Metab. 2003;88(7):3146–8. [PubMed] [Google Scholar]
2003;88(7):3146–8. [PubMed] [Google Scholar]
100. Perniola R, Falorni A, Clemente MG, et al. Органоспецифические и неорганоспецифические аутоантитела у детей и молодых людей с аутоиммунной полиэндокринопатией-кандидозно-эктодермальной дистрофией (АПЕСЕД) Eur J Endocrinol. 2000;143(4):497–503. [PubMed] [Google Scholar]
101. Sinisi AA, D’Apuzzo A, Pasquali D, et al. Антиспермальные антитела у мальчиков препубертатного возраста, получавших химиотерапию по поводу злокачественных или незлокачественных заболеваний, а также у мальчиков с патологиями половых путей. Int J Androl. 1997;20(1):23–8. [PubMed] [Google Scholar]
102. Goodpasture JC, Ghai K, Cara JF, et al. Возможности агонистов гонадотропин-рилизинг-гормона в диагностике нарушений полового созревания у девочек. Клин Обстет Гинекол. 1993;36(3):773–85. [PubMed] [Академия Google]
103. Rosenfield RL, Perovic N, Devine N, et al. Оптимизация заместительной терапии эстрогенами при синдроме Тернера. Педиатрия. 1998; 102 (2 часть 3): 486–8. [PubMed] [Google Scholar]
1998; 102 (2 часть 3): 486–8. [PubMed] [Google Scholar]
104. Дональдсон М.Д., Голт Э.Дж., Тан К.В. и соавт. Оптимизация лечения синдрома Тернера: от младенчества до перевода во взрослую жизнь. Арч Дис Чайлд. 2006;91(6):513–20. [Бесплатная статья PMC] [PubMed] [Google Scholar]
105. Mauras N, Shulman D, Hsiang HY, et al. Метаболические эффекты перорального эстрогена по сравнению с трансдермальным у девочек с синдромом Тернера, получавших гормон роста. J Clin Endocrinol Metab. 2007;92(11):4154–60. [PubMed] [Google Scholar]
106. Ankarberg-Lindgren C, Elfving M, Wikland KA, et al. Ночное применение трансдермальных пластырей с эстрадиолом приводит к образованию уровней эстрадиола, которые имитируют уровни, наблюдаемые в начале спонтанного полового созревания у девочек. J Clin Endocrinol Metab. 2001;86(7):3039–44. [PubMed] [Google Scholar]
107. Chetkowski RJ, Meldrum DR, Steingold KA, et al. Биологические эффекты трансдермального эстрадиола. N Engl J Med. 1986;314(25):1615–20. [PubMed] [Академия Google]
[PubMed] [Академия Google]
108. Nabhan ZM, DiMeglio LA, Qi R, et al. Пероральное и трансдермальное замещение эстрогена у девочек с синдромом Тернера: экспериментальное сравнительное исследование. J Clin Endocrinol Metab. 2009;94(6):2009–14. [PubMed] [Google Scholar]
109. Piippo S, Lenko H, Kainulainen P, et al. Использование чрескожного геля эстрогена для индукции полового созревания у девочек с синдромом Тернера. J Clin Endocrinol Metab. 2004;89(7):3241–7. [PubMed] [Google Scholar]
110. Richman RA, Kirsch LR. Терапия тестостероном у мальчиков-подростков с конституциональной задержкой роста и развития. N Engl J Med. 1988;319(24):1563-7. [PubMed] [Google Scholar]
111. Солиман А.Т., Хадир М.М., Асфур М. Лечение тестостероном у мальчиков-подростков с конституциональной задержкой роста и развития. Метаболизм. 1995;44(8):1013–5. [PubMed] [Google Scholar]
112. Арсланян С., Супрасонгсин С. Лечение тестостероном у подростков с задержкой полового созревания: изменения в составе тела, метаболизме белков, жиров и глюкозы. J Clin Endocrinol Metab. 1997;82(10):3213–20. [PubMed] [Академия Google]
J Clin Endocrinol Metab. 1997;82(10):3213–20. [PubMed] [Академия Google]
113. Роголь А.Д. Андрогенная терапия полового созревания у мальчиков. Pediatr Endocrinol Rev. 2005;2(3):383–90. [PubMed] [Google Scholar]
114. Кассманн К., Раппапорт Р., Бройер М. Краткосрочное влияние тестостерона на рост мальчиков на гемодиализе. Клин Нефрол. 1992;37(3):148–54. [PubMed] [Google Scholar]
115. Mayo A, Macintyre H, Wallace AM, et al. Применение трансдермального тестостерона: фармакокинетика и влияние на пубертатный статус, краткосрочный рост и метаболизм костной ткани. J Clin Endocrinol Metab. 2004;89(2): 681–7. [PubMed] [Google Scholar]
116. Eiholzer U, Grieser J, Schlumpf M, et al. Клинические эффекты лечения гипогонадизма у подростков мужского пола с синдромом Прадера-Лабхарта-Вилли. Горм Рез. 2007;68(4):178–84. [PubMed] [Google Scholar]
Гипергонадотропный гипогонадизм/Fertilitypedia
Гипергонадотропный гипогонадизм (ГГ) — состояние со сниженной функциональной активностью половых желез, с задержкой полового развития, что связано с секрецией высокого уровня гонадотропинов.
Гипогонадизм означает снижение функциональной активности гонад — семенников у мужчин или яичников у женщин, что может привести к снижению биосинтеза половых гормонов (образование химических соединений живым организмом). Половые гормоны необходимы для контроля вторичных половых признаков, таких как развитие яичек у мужчин и развитие молочных желез у женщин. Для обоих полов рост волос на лобке является общим признаком пола. Менструальный цикл и выработка спермы также контролируются половыми гормонами.
Врачи измеряют гонадотропины (лютеинизирующий гормон — ЛГ и фолликулостимулирующий гормон — ФСГ), чтобы отличить гипергонадотропный гипогонадизм от гипогонадотропного. При гипергонадотропном (также известном как первичный) гипогонадизм обычно повышены ЛГ и/или ФСГ, что означает, что проблема связана с яичками или яичниками, тогда как при гипогонадотропном (также известном как вторичный) гипогонадизм оба являются нормальными или низкими, что предполагает наличие проблемы. в мозгу.
Гиперонадотропный гипогонадизм может проявляться как врожденный, так и приобретенный, но в большинстве случаев имеет первую природу.
Врожденные причины включают следующее:
- Хромосомные аномалии — Синдром Тернера (состояние, при котором у женщин частично или полностью отсутствует Х-хромосома, рис. 1), синдром Клайнфельтера (совокупность симптомов, возникающих в результате наличия двух или более Х-хромосом у мужчин, рис. 2) , синдром Свайера (редкое заболевание, характеризующееся недостаточностью развития мужских половых желез) и дисгенезия гонад XX (тип гипогонадизма у человека с кариотипом 46, XY).
- Дефекты ферментов , участвующих в гонадном биосинтезе половых гормонов.
- Резистентность к гонадотропинам (например, из-за инактивирующих мутаций рецепторов гонадотропинов) — Гипоплазия клеток Лейдига (или нечувствительность к ЛГ) у мужчин, нечувствительность к ФСГ у женщин.
Приобретенные причины (из-за повреждения или дисфункции половых желез) включают перекрут яичников, исчезновение/анорхию (отсутствие обоих яичек при рождении), орхит (воспаление яичек), преждевременную недостаточность яичников (потерю нормального функции ваших яичников в возрасте до 40 лет), синдром резистентности яичников (причина недостаточности функции яичников, которая может привести к отсутствию менструальных циклов), травма, хирургическое вмешательство, аутоиммунитет, химиотерапия, облучение, инфекции (например, венерические заболевания), токсины ( например, эндокринные разрушители) и лекарственные препараты (например, антиандрогены, опиоиды, алкоголь).
Если есть подозрение, что пациент страдает гипогонадизмом, первый этап тестирования будет включать проверку уровня половых гормонов. Образец крови будет проверен на уровни ФСГ и ЛГ. Тестостерон и эстроген являются другими гормонами, которые необходимо измерять. Иногда эти гормоны снижены из-за анемии, которая может быть вызвана дефицитом железа.
Для исключения вторичного гипогонадизма необходимо проверить гормоны и функцию гипофиза.
HH можно лечить заместительной гормональной терапией.
Сопутствующие заболевания
- Синдром Клайнфельтера
- Синдром Тернера
- паротит
- варикоцеле (аномальное расширение венозного сплетения в мошонке)
- Синдром Свайера
- XX дисгенезия гонад
осложнения и возможный связанный с этим дефицит витамина D), все это приводит к хрупким переломам.
У взрослых мужчин низкий уровень тестостерона является независимым фактором риска перелома шейки бедра, особенно у пожилых людей, а заместительная терапия дает положительный эффект, повышая минеральную плотность поясничной и тазобедренной костей (МПКТ).
